Conjugados de PSMA-anticuerpo-fármaco.
Un conjugado anticuerpo-fármaco, que comprende:
un anticuerpo o fragmento de unión a antígeno del mismo que se une un antígeno prostático específico demembrana (PSMA),
conjugado a monometilauristatina norefedrina o monomentilauristatina fenilalanina, en dondeel conjugado anticuerpo-fármaco tiene una selectividad por células PC3 a células C4-2 o LNCaP de al menos 250,y 3 ó 4 moléculas de monometilauristatina norefedrina o monomentilauristatina fenilalanina están conjugadas alanticuerpo o fragmento de unión a antígeno del mismo.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2006/024182.
Solicitante: Psma Development Company, L.L.C.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: PROGENICS PHARMACEUTICALS, 777 OLD SAW MILL RIVER ROAD TARRYTOWN, NEW YORK 10591 ESTADOS UNIDOS DE AMERICA.
Inventor/es: SENTER, PETER D., OLSON,WILLIAM,C, MADDON,PAUL,J, MA,DANGSHE, DORONINA,SVETLANA,O, TOKI,Brian,E.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/337 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › que tienen ciclos de cuatro eslabones, p. ej. taxol.
- A61K31/573 A61K 31/00 […] › sustituidos en posición 21, p. ej. cortisona, dexametasona, prednisona o aldosterona.
- A61K38/19 A61K […] › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Citoquinas; Linfoquinas; Interferones.
- A61K38/20 A61K 38/00 […] › Interleuquinas.
- A61K38/21 A61K 38/00 […] › Interferones.
- A61K47/48
PDF original: ES-2440482_T3.pdf
Fragmento de la descripción:
Conjugados de PSMA-anticuerpo-fármaco
Campo de la invención Esta invención se refiere, en general, a conjugados anticuerpo-fármaco (ADCs – siglas en inglés) . En particular, la invención se refiere a ADCs que comprenden un anticuerpo o fragmento de unión a antígeno del mismo que se une a un antígeno prostático específico de membrana (PSMA – siglas en inglés) y está conjugado a monometilauristatin norefredina (MMAE – siglas en inglés) o monometilauristatin fenilalanina (MMAF – siglas en inglés) . El conjugado anticuerpo-fármaco tiene una selectividad por células PC-3™ a células C4-2 o LNCaP™ de al menos 250. La invención también se refiere, en parte, a composiciones de los ADCs. Los métodos proporcionados incluyen, por ejemplo, métodos para tratar una enfermedad mediada por PSMA.
Antecedentes de la invención El cáncer de próstata es el cáncer más común y la segunda causa destacada de fallecimientos por cáncer en el hombre en los Estados Unidos de América (Jemal A, et al., CA Cancer J Clin 2005; 55:10-30) . El cáncer de próstata localizado es tratado típicamente con cirugía o radiación, y la enfermedad recurrente puede ser controlada temporalmente con la ablación de andrógenos (Klein EA, et al., Urol Clin North Am 2003; 30:315-30) . Sin embargo, casi todos los carcinomas de próstata se convierten finalmente en hormona-refractarios y progresan entonces rápidamente (Denmeade SR, et al., Nat Rev Cancer 2002; 2:389-96) . El cáncer de próstata hormona-refractario o andrógeno-independiente ha demostrado ser ampliamente resistente a una quimioterapia convencional. Con la excepción de un cuidado paliativo, la única quimioterapia aprobada es docetaxel en combinación con prednisona, que ofrece un beneficio de supervivencia modesto (2, 4 meses) (Gulley J. et al., Am J Ther. 2004; 351: 1513-20; Petr y lak DP, et al., New Engl J Med 2004; 351:1513-20) . Se necesitan nuevas terapias molecularmente dirigidas.
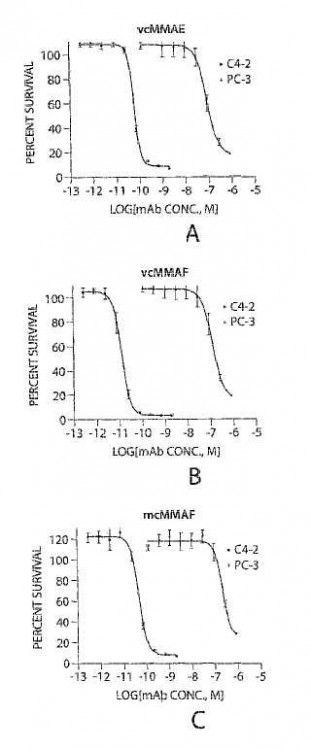
Sumario de la invención La invención proporcionada en esta memoria se refiere a ADCs que exhiben una selectividad particularmente elevada. En un aspecto de la invención, se proporciona un conjugado anticuerpo-fármaco que comprende un anticuerpo o fragmento de unión a antígeno del mismo que se une a PSMA y está conjugado a monometilauristatin norefredina o monometilauristatin fenilalanina, en donde el conjugado anticuerpo-fármaco tiene una selectividad por células PC-3™ a células C4-2 o LNCaP™ de al menos 250, y 3 ó 4 moléculas de monometilauristatin norefedrina o monometilauristatin fenilalanina están conjugadas al anticuerpo o fragmento de unión a antígeno del mismo. En una realización, la selectividad es al menos 500, 1000, 2500, 6000 ó 13.000. En otra realización, la selectividad es 1567, 6286 ó 13.636.
Se proporcionan en esta memoria ejemplos de anticuerpos que se pueden utilizar en las composiciones y los métodos de la invención, en algunas realizaciones. En otra realización, el anticuerpo o fragmento de unión a antígeno del mismo es un anticuerpo monoclonal o fragmento de unión a antígeno del mismo que se une específicamente a PSMA. Todavía en otra realización, el anticuerpo o fragmento de unión a antígeno del mismo es un anticuerpo monoclonal o fragmento de unión a antígeno del mismo que se une específicamente a un dominio extracelular de PSMA. En una realización adicional, el anticuerpo o fragmento de unión a antígeno del mismo es un anticuerpo monoclonal o fragmento de unión a antígeno del mismo que se une específicamente a un epítopo conformacional de PSMA.
En algunas realizaciones, el anticuerpo o fragmento de unión a antígeno del mismo (i) inhibe competitivamente la unión específica de un segundo anticuerpo a su epítopo diana en PSMA, o (ii) se une a un epítopo en PSMA definido por un anticuerpo seleccionado del grupo que consiste en PSMA 3.7, PSMA 3.8, PSMA 3.9, PSMA 3.11, PSMA 5.4, PSMA 7.1, PSMA 7.3, PSMA 10.3, PSMA 1.8.3, PSMA A3.1.3, PSMA A3.3.1, Abgenix 4.248.2, Abgenix 4.360, 3, Abgenix 4.7.1, Abgenix 4.4.1, Abgenix 4.177.3, Abgenix 4.16.1, Abgenix 4.22.3, Abgenix 4.28.3, Abgenix 4.40.2, Abgenix 4.48.3, Abgenix 4.49.1, Abgenix 4.209.3, Abgenix 4.219.3, Abgenix 4.288.1, Abgenix 4.333.1, Abgenix 4.54.1, Abgenix 4.153.1, Abgenix 4.232.3, Abgenix 4.292.3, Abgenix 4.304.1, Abgenix 4.78.1 y Abgenix
4.152.1. En otras realizaciones, el anticuerpo o fragmento de unión a antígeno del mismo se une a un epítopo en PSMA definido por un anticuerpo seleccionado del grupo que consiste en anticuerpos que comprenden (a) una cadena pesada codificada por una molécula de ácido nucleico que comprende una región o regiones codificadoras de una secuencia de nucleótidos seleccionada del grupo que consiste en secuencias de nucleótidos recogidas como SEQ ID NOs: 2-7, y (b) una cadena ligera codificada por una molécula de ácido nucleico que comprende una región o regiones codificadoras de una secuencia de nucleótidos seleccionada del grupo que consiste en secuencias de nucleotídos recogidas como SEQ ID NOs: 8-13.
En algunas realizaciones, el segundo anticuerpo se selecciona del grupo que consiste en PSMA 3.7, PSMA 3.8, PSMA 3.9, PSMA 3.11, PSMA 5.4, PSMA 7.1, PSMA 7.3, PSMA 10.3, PSMA 1.8.3, PSMA A3.1.3, PSMA A3.3.1, 5 Abgenix 4.248.2, Abgenix 4.360, 3, Abgenix 4.7.1, Abgenix 4.4.1, Abgenix 4.177.3, Abgenix 4.16.1, Abgenix 4.22.3, Abgenix 4.28.3, Abgenix 4.40.2, Abgenix 4.48.3, Abgenix 4.49.1, Abgenix 4.209.3, Abgenix 4.219.3, Abgenix 4.288.1, Abgenix 4.333.1, Abgenix 4.54.1, Abgenix 4.153.1, Abgenix 4.232.3, Abgenix 4.292.3, Abgenix 4.304.1, Abgenix 4.78.1 y Abgenix 4.152.1 y anticuerpos que comprenden (a) una cadena pesada codificada por una molécula de ácido nucleico que comprende una región o regiones codificadoras de una secuencia de nucleótidos seleccionada del grupo que consiste en secuencias de nucleótidos recogidas como SEQ ID NOs: 2-7, y (b) una cadena ligera codificada por una molécula de ácido nucleico que comprende una región o regiones codificadoras de una secuencia de nucleótidos seleccionada del grupo que consiste en secuencias de nucleotídos recogidas como SEQ ID NOs: 8-13.
En otras realizaciones, el segundo anticuerpo se selecciona del grupo que consiste en AB-PG1-XG1-006, AB-PG1XG1-026 y anticuerpos que comprenden (a) una cadena pesada codificada por una molécula de ácido nucleico que comprende una región o regiones codificadoras de una secuencia de nucleótidos seleccionada del grupo que consiste en secuencias de nucleótidos recogidas como SEQ ID NOs: 2 y 3, y (b) una cadena ligera codificada por una molécula de ácido nucleico que comprende una región o regiones codificadoras de una secuencia de nucleótidos seleccionada del grupo que consiste en secuencias de nucleótidos recogidas como SEQ ID NOs: 8 y 9. En una realización, el segundo anticuerpo comprende (a) una cadena pesada codificada por una molécula de ácido nucleico que comprende una región o regiones codificadoras de una secuencia de nucleótidos recogida como SEQ ID NO: 2, y (b) una cadena ligera codificada por una molécula de ácido nucleico que comprende una región o regiones codificadoras de una secuencia de nucleótidos recogida como SEQ ID NO: 8. En una realización adicional, el segundo anticuerpo comprende (a) una cadena pesada codificada por una molécula de ácido nucleico que comprende una región o regiones codificadoras de una secuencia de nucleótidos recogida como SEQ ID NO: 3, y (b) una cadena ligera codificada por una molécula de ácido nucleico que comprende una región o regiones codificadoras de una secuencia de nucleótidos recogida como SEQ ID NO: 9.
En algunas realizaciones, el anticuerpo del conjugado anticuerpo-fármaco es un anticuerpo codificado por una molécula de ácido nucleico que comprende una secuencia de nucleótidos que es al menos 90% idéntica a una secuencia de nucleótidos que codifica un anticuerpo seleccionado del grupo que consiste en AB-PG1-XG1-006, AB-PG1-XG1-026 y anticuerpos que comprenden (a) una cadena pesada codificada por una molécula de ácido nucleico que comprende una región o regiones codificadoras de una secuencia de nucleótidos seleccionada del
grupo que consiste en secuencias de nucleótidos recogidas como SEQ ID NOs: 2 y 3, y (b) una cadena ligera codificada por una molécula de ácido nucleico que comprende una región o regiones codificadoras de una secuencia de nucleótidos seleccionada del grupo que consiste en secuencias de nucleótidos recogidas como SEQ ID NOs: 8 y 9. En una realización, el anticuerpo es codificado por una molécula de ácido nucleico que comprende una secuencia de nucleótidos que es al menos 95% idéntica. En otra realización el anticuerpo es codificado por
una molécula de ácido nucleico que comprende... [Seguir leyendo]
Reivindicaciones:
1. Un conjugado anticuerpo-fármaco, que comprende:
un anticuerpo o fragmento de unión a antígeno del mismo que se une un antígeno prostático específico de membrana (PSMA) , conjugado a monometilauristatina norefedrina o monomentilauristatina fenilalanina, en donde el conjugado anticuerpo-fármaco tiene una selectividad por células PC3 a células C4-2 o LNCaP de al menos 250, y 3 ó 4 moléculas de monometilauristatina norefedrina o monomentilauristatina fenilalanina están conjugadas al anticuerpo o fragmento de unión a antígeno del mismo.
2. El conjugado anticuerpo-fármaco de la reivindicación 1, en donde el anticuerpo o fragmento de unión a antígeno del mismo es un anticuerpo monoclonal o fragmento de unión a antígeno del mismo que se une específicamente a:
(a) PSMA;
(b) un dominio extracelular de PSMA; o
(c) a un epítopo conformacional de PSMA.
3. El conjugado anticuerpo-fármaco de la reivindicación 1, en donde el anticuerpo es codificado por una molécula de ácido nucleico que comprende una secuencia de nucleótidos que es al menos 90, 95, 97, 98 ó 99% idéntica a una secuencia de nucleótidos que codifica un anticuerpo seleccionado del grupo que consiste en: AB-PG1-XG1006, AB-PGI-XG1-026 y anticuerpos que comprenden:
(a) una cadena pesada codificada por una molécula de ácido nucleico que comprende la región o regiones codificadoras de una secuencia de nucleótidos seleccionada del grupo que consiste en secuencias de nucleótidos recogidas como SEQ ID NOs: 2 y 3, y
(b) una cadena ligera codificada por una molécula de ácido nucleico que comprende la región o regiones codificadoras de una secuencia de nucleótidos seleccionada del grupo que consiste en secuencias de nucleótidos recogidas como SEQ ID NOs: 8 y 9, o
(c) una región variable de la cadena pesada codificada por una molécula de ácido nucleico que comprende la región o regiones codificadoras de una secuencia de nucleótidos seleccionada del grupo que consiste en secuencias de nucleótidos recogidas como SEQ ID NOs: 14 y 18, y
(d) una región variable de la cadena ligera codificada por una molécula de ácido nucleico que comprende la región o regiones codificadoras de una secuencia de nucleótidos seleccionada del grupo que consiste en secuencias de nucleótidos recogidas como SEQ ID NOs: 16 y 20.
4. El conjugado anticuerpo-fármaco de la reivindicación 1, en donde el anticuerpo o fragmento de unión a antígeno del mismo es AB-PGI-XG1-006, AI3-PGI-XG1-026 o un fragmento de unión a antígeno del mismo.
5. El conjugado anticuerpo-fármaco de la reivindicación 1, en donde el anticuerpo o fragmento de unión a antígeno del mismo se selecciona del grupo que consiste en:
(a) anticuerpos que comprenden una cadena pesada codificada por una molécula de ácido nucleico que comprende la región o regiones codificadoras de una secuencia de nucleótidos seleccionada del grupo que consiste en secuencias de nucleótidos recogidas como SEQ ID NOs: 2 y 3, y una cadena ligera codificada por una molécula de ácido nucleico que comprende la región o regiones codificadoras de una secuencia de nucleótidos seleccionada del grupo que consiste en secuencias de nucleótidos recogidas como SEQ ID NOs: 8 y 9, y
fragmentos de unión a antígeno de los mismos;
(b) anticuerpos que comprenden una cadena pesada codificada por una molécula de ácido nucleico que comprende la región o regiones codificadoras de una secuencia de nucleótidos recogida como SEQ ID NO: 2, y una cadena ligera codificada por una molécula de ácido nucleico que comprende la región o regiones codificadoras de una secuencia de nucleótidos recogida como SEQ ID NO: 8, y
fragmentos de unión a antígeno de los mismos; y
(c) anticuerpos que comprenden una cadena pesada codificada por una molécula de ácido nucleico que comprende la región o regiones codificadoras de una secuencia de nucleótidos recogida como SEQ ID NO: 3, y una cadena ligera codificada por una molécula de ácido nucleico que comprende la región o regiones codificadoras de una secuencia de nucleótidos recogida como SEQ ID NO: 9, y
fragmentos de unión a antígeno de los mismos; y
(d) anticuerpos que comprenden una región variable de la cadena pesada codificada por una molécula de ácido nucleico que comprende la región o regiones codificadoras de una secuencia de nucleótidos seleccionada del grupo que consiste en secuencias de nucleótidos recogidas como SEQ ID NOs: 14 y 18, y una región variable de la cadena ligera codificada por una molécula de ácido nucleico que comprende la región o regiones codificadoras de una secuencia de nucleótidos seleccionada del grupo que consiste en secuencias de nucleótidos recogidas como SEQ ID NOs: 16 y 20, y
fragmentos de unión a antígeno de los mismos; y
(e) anticuerpos que comprenden una región variable de la cadena pesada codificada por una molécula de ácido nucleico que comprende la región o regiones codificadoras de una secuencia de nucleótidos recogida como SEQ ID NO: 14, y una región variable de la cadena ligera codificada por una molécula de ácido nucleico que
comprende la región o regiones codificadoras de una secuencia de nucleótidos recogida como SEQ ID NO: 16, y fragmentos de unión a antígeno de los mismos; y
(f) anticuerpos que comprenden una región variable de la cadena pesada codificada por una molécula de ácido nucleico que comprende la región o regiones codificadoras de una secuencia de nucleótidos recogida como SEQ ID NO: 18, y una región variable de la cadena ligera codificada por una molécula de ácido nucleico que comprende la región o regiones codificadoras de una secuencia de nucleótidos recogida como SEQ ID NO: 20, y fragmentos de unión a antígeno de los mismos.
6. El conjugado anticuerpo-fármaco de la reivindicación 1, en donde el anticuerpo o fragmento de unión a antígeno del mismo es IgG1, IgG2, IgG3, IgG4, IgM, IgA1, IgA2, IgAsec, IgD, IgE o tiene un dominio constante y/o variable de inmunoglobulina de IgG1, IgG2, IgG3, IgG4, IgM, IgA1, IgA2, IgAsec, IgD o IgE.
7. El conjugado anticuerpo-fármaco de la reivindicación 1, en donde el anticuerpo es un anticuerpo monoclonal, humanizado, humano, recombinante, quimérico, biespecífico o multiespecífico.
8. El conjugado anticuerpo-fármaco de la reivindicación 1, en donde el fragmento de unión a antígeno es un fragmento Fab, un fragmento F (ab’) 2, un fragmento Fv o un fragmento que contiene CDR3.
9. El conjugado anticuerpo-fármaco de la reivindicación 1, en donde la selectividad por células PC-3 a células C42 o LNCaP es al menos 500, 1000, 2500, 6000 ó 13.000.
2.
10. El conjugado anticuerpo-fármaco de la reivindicación 1, en donde la monometilauristatin norefredina o monometilauristatin fenilalanina está conjugada al anticuerpo o fragmento de unión a antígeno del mismo con un compuesto de la fórmula:
- An-Ym-Zm-Xn-Wn-, 30 en donde A es una unidad acilo carboxílica; Y es un aminoácido; Z es un aminoácido; X y W son cada uno un espaciador auto-inmolativo; n es un número entero de 0 ó 1; y m es un número entero de 0 ó 1, 2, 3, 4, 5 ó
6.
11. El conjugado anticuerpo-fármaco de la reivindicación 10, en donde A es 35 (a)
en que q es 1-10,
(b) 4- (N-succinimidometil) ciclohexano-1-carbonilo,
(c) m-succinimidobenzoilo, 40 (d) 4- (p-succinimidofenil) -butirilo,
(e) 4- (2-acetamido) benzoilo,
(f) 3-tiopropionilo,
(g) 4- (1-tioetil) -benzoilo,
(h) 6- (3-tiopropionilamido) -hexanoilo, o 45 (i) maleimida-caproilo.
12. El conjugado anticuerpo-fármaco de la reivindicación 10, en donde Y es alanina, valina, leucina, isoleucina, metionina, fenilalanina, triptófano o prolina.
13. El conjugado anticuerpo-fármaco de la reivindicación 10, en donde Z es lisina, lisina protegida con acetilo o formilo, arginina, arginina protegida con tosilo o grupos nitro, histidina, ornitina, ornitina protegida con acetilo o formilo, o citrulina. 14. El conjugado anticuerpo-fármaco de la reivindicación 10, en donde Ym-Zm es valina-citrulina.
15. El conjugado anticuerpo-fármaco de la reivindicación 10, en donde Ym-Zm es una secuencia de proteínas que es selectivamente escindible por una proteasa.
16. El conjugado anticuerpo-fármaco de la reivindicación 10, en donde X es:
(a) un compuesto que tiene la fórmula 10
en que T es O, N o S;
(b) un compuesto que tiene la fórmula - HN-R1-COT, 15 en que R1 es alquilo C1-C5, T es O, N o S;
(c) un compuesto que tiene la fórmula
en que T es O, N o S, R2 es H o alquilo C1-C5;
(d) p-aminobencilcarbamoiloxi; 20 (e) alcohol p-aminobencílico;
(f) carbamato de p-aminobencilo;
(g) p-aminobenciloxicarbonilo; o
(h) ácido γ-aminobutírico; ácido α, α-dimetil-γ-aminobutírico o ácido β, β-dimetil-γ-aminobutírico.
2517. El conjugado anticuerpo-fármaco de la reivindicación 10, en donde W es en que T es O, S o N.
3.
18. El conjugado anticuerpo-fármaco de cualquiera de las reivindicaciones 10-17, en donde m y n son 0.
19. El conjugado anticuerpo-fármaco de la reivindicación 1, que es AB-PG1-XG1-006-maleimida caproil-valinacitrulina-p-aminobenciloxicarbonil-monometilauristatin norefredina, AB-PG1-XG1-006-maleimida caproil-valinacitrulina-p-aminobenciloxicarbonil-monometilauristatin fenilalanina, AB-PG1-XG1-006-maleimida-caproil35 monometilauristatin fenilalanina, AB-PG1-XG1-006-maleimida-caproil-valina-citrulina-p-carbamato de aminobencilo-monometilauristatin norefedrina, AB-PG1-XG1-006-maleimida-caproil-valina-citrulina-p-carbamato de aminobencilo-monometilauristatin fenilalanina, AB-PG1-XG1-026-maleimida-caproil-valina-citrulina-paminobenciloxicarbonil-monometilauristatin norefedrina, AB-PG1-XG1-026-maleimida-caproil-valina-citrulina-paminobenciloxicarbonil-monometilauristatin fenilalanina o AB-PG1-XG1-026-maleimida-caproil-monometilauristatin fenilalanina.
20. El conjugado anticuerpo-fármaco de la reivindicación 1, en donde el conjugado anticuerpo-fármaco une una célula tumoral, preferiblemente una célula de tumor de próstata.
21. El conjugado anticuerpo-fármaco de la reivindicación 1, en donde el conjugado anticuerpo-fármaco une células endoteliales de la neovasculatura de un tumor, no requiere de una lisis celular para unirse a PSMA, conduce a una paralización del ciclo celular y/o inhibe el crecimiento de células que expresan PSMA.
22. El conjugado anticuerpo-fármaco de la reivindicación 1, en donde el conjugado anticuerpo-fármaco media en el exterminio de células específico de células que expresan PSMA con una CI50 de:
(a) menor que 1X10-10 , 1X10-11 1X10-12 M;
(b) 11-.
4. .
6. o -65 -208X10-12 M; o
(c) 11, 42, 60 u 83X10-12 M.
23. El conjugado anticuerpo-fármaco de la reivindicación 1, en donde el conjugado anticuerpo-fármaco, cuando se administra a ratones con un régimen de q4d x 6 a una dosis de 6 mg/kg resulta una tasa de curación de al menos 20%, 30%, 40% o 50%.
24. El conjugado anticuerpo-fármaco de la reivindicación 1, unido a un marcador, preferiblemente un marcador fluorescente, un marcador enzimático, un marcador radiactivo, un marcador activo de resonancia magnética nuclear, un marcador luminiscente o un marcador cromóforo.
25. El conjugado anticuerpo-fármaco de la reivindicación 1, envasado en forma liofilizada o acuosa.
26. El conjugado anticuerpo-fármaco de la reivindicación 1, en una forma estéril.
27. Una composición que comprende:
(a) el conjugado anticuerpo-fármaco de la reivindicación 1 y un vehículo, excipiente o estabilizador farmacéuticamente aceptable; o
(b) una combinación de dos o más conjugados anticuerpo-fármaco diferentes de acuerdo con la reivindicación 1 y un vehículo, excipiente o estabilizador farmacéuticamente aceptable.
28. La composición de la reivindicación 27 que comprende, además, un agente antitumoral, un agente inmunoestimulante, un inmunomodulador, corticosteroides o una combinación de los mismos.
29. La composición de la reivindicación 28, en donde el agente antitumoral es un agente citotóxico, un agente que actúa sobre la neovasculatura del tumor o una combinación de los mismos, preferiblemente docetaxel.
30. La composición de la reivindicación 28, en donde el inmunomodulador es una citoquina, quimioquina, adyuvante o una combinación de los mismos.
31. La composición de la reivindicación 28, en donde el agente inmunoestimulante es interleuquina-2, α-interferón, γ-interferón, factor α de necrosis tumoral, un oligonucleótido inmunoestimulante o una combinación de los mismos.
32. La composición de la reivindicación 28, en donde el corticosteroide es prednisona o hidrocortisona.
33. Una composición, que comprende:
uno o más conjugados anticuerpo-fármaco de la reivindicación 1, y uno o más anticuerpos anti-PSMA no conjugados.
34. Un conjugado anticuerpo-fármaco según cualquiera de las reivindicaciones 1-23, para uso en un método para inhibir el crecimiento de una célula que expresa PSMA, en donde el conjugado se ha de poner en contacto con la célula que expresa PSMA.
35. Un conjugado anticuerpo-fármaco según la reivindicación 34, en donde la célula que expresa PSMA es una célula de tumor de próstata, una célula de la neovasculatura de un tumor no prostático, una célula andrógenodependiente o una célula andrógeno-independiente.
36. Un conjugado anticuerpo-fármaco según la reivindicación 34, en donde, en dicho método, la célula que expresa PSMA se ha de poner adicionalmente en contacto con un agente antitumoral, un agente inmunoestimulante, un inmunomodulador, corticosteroide o una combinación de los mismos.
37. Un método ex vivo para inhibir el crecimiento de una célula que expresa PSMA, que comprende poner en contacto la célula que expresa PSMA con una cantidad de un conjugado anticuerpo-fármaco según cualquiera de las reivindicaciones 1-23, eficaz para inhibir el crecimiento de la célula que expresa PSMA.
38. Un método según la reivindicación 37, en el que la célula que expresa PSMA es una célula de tumor de próstata, una célula de la neovasculatura de un tumor no prostático, una célula andrógeno-dependiente o una célula andrógeno-independiente.
39. Un método según la reivindicación 37, que comprende, además, poner en contacto la célula que expresa PSMA con un agente antitumoral, un agente inmunoestimulante, un inmunomodulador, corticosteroide o una combinación de los mismos.
40. Un conjugado anticuerpo-fármaco según cualquiera una de las reivindicaciones 1-23, para uso en un método de efectuar la paralización del ciclo celular en una célula que expresa PSMA, en el que el conjugado se ha de poner en contacto con la célula que expresa PSMA.
41. Un conjugado anticuerpo-fármaco según cualquiera de las reivindicaciones 1-23, para uso en un método para tratar el cáncer, opcionalmente cáncer de próstata, o un cáncer no prostático, y dicho cáncer no prostático, opcionalmente, es cáncer de vejiga, cáncer pancreático, cáncer de pulmón, cáncer de riñones, sarcoma, cáncer de mama, cáncer de cerebro, carcinoma neuroendocrino, cáncer de colon, cáncer testicular o melanoma.
42. Un conjugado anticuerpo-fármaco para uso en un método para tratar el cáncer según la reivindicación 41, en donde, en dicho método, otro agente terapéutico se ha de co-administrar para tratar el cáncer, en donde la coadministración se ha de realizar antes, durante o después de la administración del conjugado anticuerpo-fármaco.
43. Un conjugado anticuerpo-fármaco para uso en un método para tratar el cáncer según la reivindicación 42, en donde el otro agente terapéutico es un agente antitumoral, un agente inmunoestimulante, un inmunomodulador, corticosteroide o una combinación de los mismos.
44. Un conjugado anticuerpo-fármaco para uso en un método para inhibir el crecimiento de una célula que expresa PSMA según la reivindicación 36, un conjugado anticuerpo-fármaco para uso en un método para tratar el cáncer según la reivindicación 43, o un método según la reivindicación 39, en donde el agente antitumoral es un agente citotóxico, un agente que actúa sobre la neovasculatura del tumor o una combinación de los mismos y, preferiblemente, docetaxel.
45. Un conjugado anticuerpo-fármaco para uso en un método para inhibir el crecimiento de una célula que expresa PSMA según la reivindicación 36, un conjugado anticuerpo-fármaco para uso en un método para tratar el cáncer según la reivindicación 43, o un método según la reivindicación 39, en donde el inmunomodulador es una citoquina, quimioquina, adyuvante o una combinación de los mismos.
46. Un conjugado anticuerpo-fármaco para uso en un método para inhibir el crecimiento de una célula que expresa PSMA según la reivindicación 36, un conjugado anticuerpo-fármaco para uso en un método para tratar el cáncer según la reivindicación 43, o un método según la reivindicación 39, en donde el agente inmunoestimulante es interleuquina-2, α-interferón, γ-interferón, factor α de necrosis tumoral, un oligonucleótido inmunoestimulante o una combinación de los mismos.
47. Un conjugado anticuerpo-fármaco para uso en un método para inhibir el crecimiento de una célula que expresa PSMA según la reivindicación 36, un conjugado anticuerpo-fármaco para uso en un método para tratar el cáncer según la reivindicación 43, o un método según la reivindicación 39, en donde el corticosteroide es prednisona o hidrocortisona.
48. Un conjugado anticuerpo-fármaco para uso en un método para tratar el cáncer según la reivindicación 42, en donde el agente terapéutico es una vacuna, preferiblemente una vacuna que inmuniza contra PSMA.
49. Un conjugado anticuerpo-fármaco para uso en un método para inhibir el crecimiento de una célula que expresa PSMA según la reivindicación 44, o un conjugado anticuerpo-fármaco para uso en un método para tratar el cáncer según una cualquiera de las reivindicacione.
4. 44, en donde, en dicho método, se ha de administrar
todavía otro agente terapeútico, preferiblemente prednisona.
50. Un conjugado anticuerpo-fármaco según cualquiera de las reivindicaciones 1-23, para uso en un método para inhibir el crecimiento de un tumor, en donde dicho conjugado se ha de poner en contacto con células que expresan PSMA de la neovasculatura del tumor, para inhibir con ello el crecimiento del tumor.
1.
51. Un conjugado anticuerpo-fármaco para uso en un método para inhibir el crecimiento de un tumor según la reivindicación 50, en donde, en dicho método, las células que expresan PSMA se han de poner en contacto, adicionalmente, con un agente antitumoral, un agente inmunoestimulante, un inmunomodulador, corticosteroide o una combinación de los mismos.
1.
52. Un conjugado anticuerpo-fármaco para uso en un método para inhibir el crecimiento de un tumor según la reivindicación 51, en donde:
(a) el agente antitumoral es un agente citotóxico, un agente que actúa sobre la neovasculatura del tumor o una combinación de los mismos; 20 (b) el inmunomodulador es una citoquina, quimioquina, adyuvante o una combinación de los mismos; y/o (c) el agente inmunoestimulante es interleuquina-2, α-interferón, γ-interferón, factor α de necrosis tumoral, oligonucleótidos inmunoestimulantes o una combinación de los mismos.
Fig. 2
Fig. 3A
Fig. 3B
Fig. 5
Patentes similares o relacionadas:
Derivativos del ácido siálico para la derivatización y conjugación de proteínas, del 20 de Diciembre de 2019, de LIPOXEN TECHNOLOGIES LIMITED: Un procedimiento de producción de un derivativo aldehído de un ácido siálico en el que un material de partida que tiene una unidad de ácido siálico en el […]
GELES DE QUITOSANO(A) CONTENIENDO NANOPARTICULAS METALICAS DE COBRE, PLATA Y ANTIBIOTICOS (CIPROFLOXACINO, CEFOTAXIME, GENTAMICINA Y CLOXACILINA), del 12 de Diciembre de 2019, de CARDENAS Y CIA LTDA: En la presente invención se describen geles de quitosano (poli-beta-glucosamina) con propiedades bactericidas y fungicidas en mezcla con nanopartículas […]
Compuestos de polímero de polialquileno y usos de los mismos, del 20 de Noviembre de 2019, de Biogen MA Inc: Una composición farmacéutica que comprende un conjugado y un vehículo, adyuvante, diluyente, conservante y/o solubilizante farmacéuticamente […]
Composiciones y métodos para la liberación dirigida de fármacos in vitro e in vivo a células de mamíferos mediante minicélulas intactas derivadas de bacterias, del 23 de Octubre de 2019, de ENGENEIC MOLECULAR DELIVERY PTY LTD: Una composición que comprende: (a) una pluralidad de minicélulas intactas derivadas de bacterias que tienen paredes celulares intactas, en donde la pluralidad […]
Moléculas con semividas prolongadas, composiciones y usos de las mismas, del 16 de Octubre de 2019, de MEDIMMUNE, LLC: Una molécula modificada que comprende una proteína o agente no de proteína y un dominio constante de IgG, en la que el dominio constante de IgG comprende un dominio CH3 humano […]
Método para la preparación de oligo etilenglicol monodisperso, del 19 de Junio de 2019, de NEKTAR THERAPEUTICS: Un método para preparar un oligo (etilenglicol) monodisperso, comprendiendo dicho método: (i) hacer reaccionar un oligo (etilenglicol) terminado […]
Construcciones de moléculas MHC y sus usos para el diagnóstico y terapia, del 29 de Mayo de 2019, de DAKO DENMARK A/S: Una construcción de moléculas MHC en forma soluble en un medio de solubilización o inmovilizada en un soporte sólido o semi-sólido, comprendiendo dicha construcción de moléculas […]
Usos terapéuticos de anticuerpos monoclonales frente al receptor de la angiotensina II tipo 1, del 17 de Mayo de 2019, de QUEEN MARY AND WESTFIELD COLLEGE: Un anticuerpo monoclonal o un fragmento del mismo que se une al péptido que consiste en la secuencia EDGIKRIQDD para su uso en el tratamiento de la proliferación […]