Composiciones monovalentes para la unión a CD40L y procedimientos de uso.
Uso de un polipéptido de anticuerpo que comprende un polipéptido de dominio variable sencillo de anticuerpo enla preparación de un medicamento para el tratamiento o la prevención de un síntoma de enfermedadautoinmunitaria,
en el que dicho polipéptido de dominio variable sencillo es monovalente para unión con CD40L(gp39) y antagoniza una actividad de CD40 o CD40L o de ambos, y en el que dicho polipéptido de anticuerpo inhibela unión de un dominio variable sencillo de anticuerpo que comprende la secuencia de aminoácidos de la SEC ID Nº:26 con CD40L.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/GB2005/003562.
Solicitante: DOMANTIS LIMITED.
Nacionalidad solicitante: Reino Unido.
Dirección: 980 GREAT WEST ROAD BRENTFORD, MIDDLESEX TW8 9GS REINO UNIDO.
Inventor/es: GRANT,STEVEN, LIU,HAIQUN, MOULDER,KEVIN.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K39/395 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Anticuerpos (aglutininas A61K 38/36 ); Inmunoglobulinas; Inmunosuero, p. ej. suero antilinfocitario.
- A61P37/06 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 37/00 Medicamentos para el tratamiento de problemas inmunológicos o alérgicos. › Inmunosupresores, p. ej. medicamentos para el tratamiento del rechazo en injertos.
- C07K16/28 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › contra receptores, antígenos celulares de superficie o determinantes celulares de superficie.
PDF original: ES-2442455_T3.pdf
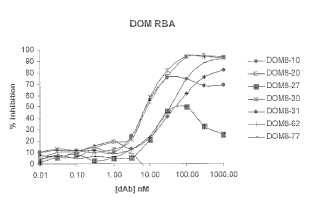
Fragmento de la descripción:
Composiciones monovalentes para la unión a CD40L y procedimientos de uso
Antecedentes de la invención CD40 es una molécula de glucoproteína de superficie celular de 50 kD expresada en la superficie de linfocitos B maduros e inmaduros, macrófagos, células dendríticas foliculares, epitelio tímico, epitelio basal normal, y algunas líneas celulares derivadas de tumores. La molécula CD40 es un miembro de la familia de receptores de TNF, y tiene importantes funciones de señalización que conducen a diversos efectos posteriores en diversos tipos celulares. Estudios tempranos muestran que la reticulación de CD40 sobre la superficie de los linfocitos B con un anticuerpo da como resultado la proliferación y activación de linfocitos B. La reticulación de CD40 con anticuerpos en presencia de IL4 induce la proliferación y cambio de clase in vitro, la agregación de linfocitos B mediante LFA-1 (Gordon y col., 1988, J. Immunol. 140: 1425) , y la fosforilación de serina/treonina y tirosina de diversos sustratos intracelulares (Gordon y col., 1988, supra; Uckun y col., 1991, J. Biol. Chem. 266: 17478) . Los anticuerpos monoclonales anti-CD40 también sensibilizan los linfocitos B para que proliferen en respuesta a agentes tales como PMA (Gordon y col., 1987, Eur. J. Immunol. 17: 1535) y anticuerpos anti-CD20 (Clark y Ledbetter, 1986, Proc. Natl. Acad. Sci. Estados Unidos 83: 4494) .
La homología del receptor de CD40 y estudios de reticulación de anticuerpos muestran una función principal de CD40 en la activación de linfocitos B que estimulan la búsqueda de un ligando natural. Se descubrió un mutante de la línea de linfocitos T Jurkat que activa constitutivamente linfocitos B humanos para secretar inmunoglobulina (Yellin y col., 1991, J. Immunol. 147: 3389-3395) . Se generó un anticuerpo monoclonal, denominado 5c8, que reaccionaba específicamente con la línea mutante, pero no con la línea de células Jurkat parental. El anticuerpo 5c8 inmunoprecipita un polipéptido de la superficie celular de 30 kD (más precisamente, 29, 3 kD, 261 aminoácidos) y se descubrió que inhibía específicamente la función auxiliar de los linfocitos B en la línea celular mutante. (Lederman y col., 1992, J. Exp. Med., 175: 1091-1101; Lederman y col., 1992, J. Immunol. 149: 3817-3826; Lederman y col., 1993, Curr. Opin. Immunol. 5: 439-444) . El ligando polipeptídico de 30 kD del anticuerpo 5c8 se denominó T-BAM, por la molécula activadora de linfocitos T-B. Una segunda línea de estudios usó técnicas de clonación molecular para identificar polipéptidos que se unen específicamente a la molécula CD40. Clones de ADNc para un ligando específico de CD40 se identificaron en un ensayo de unión a CD40 y como alternativa se denominó ligando CD40 (CD40L) , gp39, CD154 o TRAP (Graf y col., 1992, Eur. J. Immunol. 22: 3191-3194; Armitage y col., 1992, Nature 357: 80-82; y Aruffo y col., 1993, Cell 72: 291-300) . Posteriormente, se descubrió que el clon CD40L tenía la misma estructura que T-BAM (Covey y col., 1994, Mol. Immunol. 31: 471-484) . La proteína CD40L humana muestra una identidad del 82, 8 % y 77, 4 % en el ácido nucleico y aminoácidos, respectivamente, con una proteína similar aislada de células de timoma EL4 murino. Ambas proteínas son ligandos del antígeno de superficie celular CD40 expresado en linfocitos B en reposo. También se ha descrito que CD40L como IMD3, una proteína implicada en el síndrome de inmunodeficiencia hiper-IgM.
El gen humano que codifica CD40L mapea el cromosoma Xq26.3-q27. El gen contiene cinco exones. Se han descubierto deleciones, mutaciones puntuales y mutaciones por desplazamiento de marco agrupadas dentro de una región limitada del dominio extracelular de CD40L como la base de un síndrome raro de inmunodeficiencia asociado al cromosoma X (síndrome de inmunodeficiencia hiper-IgM, HIGM1) caracterizado por infecciones bacterianas recurrentes, niveles séricos muy bajos o ausencia de IgG, IgA e IgE y niveles séricos normales a aumentados de IgM e IgD. Se han descubierto mutaciones causalmente relacionadas que consisten en deleciones agrupadas que surgen por mutaciones donantes de corte y empalme con salto de exón, mutaciones aceptoras de corte y empalme con uso de un sitio de corte y empalme críptico y acontecimientos de deleción/inserción con la creación de un nuevo sitio de corte y empalme.
CD40L se expresa en linfocitos T CD4+ activados, pero no en reposo y se ha descubierto que desempeña una función particularmente importante en la respuesta inmunitaria humoral, que está asociada a la proliferación de linfocitos B, producción de anticuerpos y citocinas y viabilidad celular. La deleción o mutación de CD40L in vivo conduce a inmunodeficiencia grave tanto en ratones como en seres humanos, caracterizada por hipogammaglobulinemia y déficits de linfocitos T en la inmunidad mediada por células (Chess, C., 2001, in Therapeutic Immunology, 2ª edición, Austen, K.F., Burakoff, S., Rosen, F. y Strom, T., eds., Blackwell Sciences, págs. 441-456) . Los linfocitos T CD4+ humanos infectados por el VIH1, que produce grave disfunción en la inmunidad celular, pero paradójicamente da como resultado una activación policlonal intensa de los linfocitos B, no expresan CD40L. La expresión génica y en la superficie de células CD40L por linfocitos B activados se ha demostrado que está deprimida en un subgrupo de pacientes con inmunodeficiencia variable común (IVC) . Por tanto, la señalización ineficaz mediante CD40 puede ser responsable, al menos en parte, de la incorrecta diferenciación de los linfocitos B en estos pacientes.
Las consecuencias funcionales de la unión de CD40L a CD40 incluye, por ejemplo, a) rescate de linfocitos B de apoptosis inducida por Fas o reticulación de IgM, b) inducción de moléculas coestimuladoras CD80 (B7-1) y CD86 (B7-2) que interactúan con CD28 y CD152 (CTLA-4) sobre la superficie de linfocitos T activados; c) expresión aumentada de otras moléculas de activación de la superficie celular incluyendo CD23, CD54, CD95 y linfotoxina-a; y d) inducción del cambio de clase de inmunoglobulina (véase Chess, citado anteriormente, y las referencias 25, 44 y
47. 60 citadas en su dicho documento) . La unión de CD40L a CD40 también aumenta las funciones presentadoras de antígeno de las células dendríticas, inducen el mantenimiento de altos niveles de antígenos MHC de clase II y regulación positiva de moléculas accesorias incluyendo CD58 (LFA-3) . CD40L induce la producción de citocinas y la actividad tumoricida en monocitos de sangre periférica. CD40L también coestimula la proliferación de linfocitos T activados y la coestimulación viene acompañada por la producción de IFN-!, TNF-∀ e IL2. La expresión de CD40L en linfocitos T auxiliares murinos y en linfocitos T CD4+ está inhibida por IFN-!, y está inhibida en linfocitos T auxiliares de tipo 2 mediante TGF-#.
CD40L regula positivamente la expresión de CD54 por células de Hodgkin y Reed-Stemberg cultivadas. El aumento de la expresión en superficie de CD54 va acompañado del aumento en la diseminación de CD54 unido a la superficie.
También se ha sugerido que CD40L es importante en la inducción de tolerancia a CD80 y CD86, que está regulada positivamente por CD40L, interacciona con CD28 para proporcionar coestimulación esencial de linfocitos T en concierto con la activación de receptores de linfocitos T que da como resultado la activación completa de linfocitos T. En ausencia de CD80 y de la activación de CD28 desencadenada por CD86, la anergia o tolerancia se produce como consecuencia de la estimulación antigénica (Linsley y Ledbetter, 1993, Ann. Rev. Immunol. 11: 191-212; Jenkins y col., 1993, Curr Opin. Immunol. 5: 361-367; y Boussiotis y col., 1996, Immunol. Rev. 153: 5-26) .
La ruta de CD40L/CD40 se ha implicado en la sensibilización in vivo de linfocitos T citotóxicos CD8+ (CTS) por linfocitos T CD4+. Como se observa, CD40L expresado en la superficie de linfocitos T CD4+ activados interacciona con CD40 expresada en células dendríticas, induciendo a las células dendríticas a expresar más MHC y la señalización a través de CD40 puede sustituir la necesidad de linfocitos T auxiliares CD4+ en la sensibilización de respuestas CTL CD8+. El bloqueo de CD40L inhibe la sensibilización de CTL, resaltando la función vital de las interacciones CD40L/CD40 en la sensibilización de CTL por linfocitos T auxiliares (Ridge y col., 1998, Nature 393: 474-478; Schoenberger y col., 1998, Nature 393: 480-483; Bennett y col., 1998, Nature 393: 478-480) .
CD40L también puede mediar interacciones funcionales de linfocitos T CD4+ con otras células que expresan CD40, tales como fibroblastos, células sinoviales y células endoteliales (Yellin y col., 1995, J. Leuko. Biol. 58: 209-216; Yellin... [Seguir leyendo]
Reivindicaciones:
1. Uso de un polipéptido de anticuerpo que comprende un polipéptido de dominio variable sencillo de anticuerpo en la preparación de un medicamento para el tratamiento o la prevención de un síntoma de enfermedad autoinmunitaria, en el que dicho polipéptido de dominio variable sencillo es monovalente para unión con CD40L (gp39) y antagoniza una actividad de CD40 o CD40L o de ambos, y en el que dicho polipéptido de anticuerpo inhibe la unión de un dominio variable sencillo de anticuerpo que comprende la secuencia de aminoácidos de la SEC ID Nº: 26 con CD40L.
2. El uso de acuerdo con la reivindicación 1 en el que dicha enfermedad autoinmunitaria es una enfermedad seleccionada del grupo que consiste en lupus eritematoso sistémico, esclerosis múltiple, artritis reumatoide, diabetes, rechazo de aloinjerto, trasplante y rechazo de xenoinjertos.
3. El uso de acuerdo con una cualquiera de las reivindicaciones 1 o 2 en el que dicho polipéptido de anticuerpo inhibe la unión de CD40L con CD40.
4. El uso de acuerdo con una cualquiera de las reivindicaciones 1 a 3, en el que dicho polipéptido de anticuerpo consiste en el polipéptido de dominio variable sencillo.
5. El uso de acuerdo con una cualquiera de las reivindicaciones 1 a 4 en el que dicho polipéptido de dominio variable sencillo es un polipéptido de dominio variable sencillo de anticuerpo humano.
6. El uso de acuerdo con una cualquiera de las reivindicaciones 1 a 5 en el que dicho polipéptido de dominio variable sencillo es un dominio VH o VL.
7. El uso de acuerdo con una cualquiera de las reivindicaciones 1 a 6, en el que dicho polipéptido de anticuerpo es humano e inhibe la unión de CD40L con CD40 con una CI50 en el intervalo de 20 pM a 1, 5 %M
8. El uso de acuerdo con una cualquiera de las reivindicaciones 1 a 7 en el que dicho polipéptido de dominio variable sencillo comprende la secuencia de aminoácidos de CDR1, CDR2 y CDR3 de la SEC ID Nº: 26.
9. El uso de acuerdo con una cualquiera de las reivindicaciones 1 a 8 en el que dicho polipéptido de anticuerpo tiene una secuencia de aminoácidos que es al menos un 80 % homóloga a la SEC ID Nº: 26.
10. El uso de acuerdo con una cualquiera de las reivindicaciones 1 a 9 en el que dicho polipéptido de anticuerpo tiene una secuencia de aminoácidos que es idéntica a la SEC ID Nº: 26.
11. El uso de acuerdo con una cualquiera de las reivindicaciones 1 a 10 en el que la unión de dicho polipéptido de anticuerpo con CD40L no agoniza sustanciamente la actividad de CD40 y/o CD40L.
12. El uso de acuerdo con una cualquiera de las reivindicaciones 1 a 11 en el que la presencia de dicho polipéptido de anticuerpo en un ensayo de agregación plaquetaria convencional no da como resultado la agregación de más del 25 % sobre la agregación observada en un ensayo de control negativo.
13. El uso de acuerdo con una cualquiera de las reivindicaciones 1 a 12 en el que el polipéptido de dominio variable sencillo está presente como un homo-o heteromultímero con dominios VH o VL adicionales, en el que el polipéptido de dominio variable sencillo se une a CD40L independientemente de los dominios VH o VL adicionales.
14. Un polipéptido de anticuerpo que comprende o consiste en un dominio variable sencillo de anticuerpo que se une de forma específica y monovalente a CD40L, en el que dicho polipéptido inhibe sustancialmente la unión de CD40L con CD40, y en el que dicho polipéptido de anticuerpo inhibe la unión de un dominio variable sencillo de anticuerpo que comprende la secuencia de aminoácidos de SEC ID Nº: 26 a CD40L.
15. El polipéptido de anticuerpo de la reivindicación 14 en el que dicho polipéptido de anticuerpo es humano e inhibe la unión de CD40L con CD40 con una CI50 en el intervalo de 20 pM a 1, 5 %M.
16. El polipéptido de anticuerpo de la reivindicación 14 o 15 en el que dicho polipéptido de anticuerpo inhibe la unión de CD40 con CD40L, y no agoniza sustancialmente la señalización por CD40.
17. El polipéptido de anticuerpo de la reivindicación 14 o 15 en el que la unión de dicho polipéptido de anticuerpo con CD40L no induce sustancialmente fosforilación de JNK en linfocitos T Jurkat.
18. El polipéptido de anticuerpo de la reivindicación 14 o 15 en el que la unión de dicho polipéptido de anticuerpo con CD40L no induce sustancialmente secreción de IFN-! por linfocitos T Jurkat coestimulados con anticuerpo anti-CD3.
19. El polipéptido de anticuerpo de la reivindicación 14 o 15 en el que la presencia de dicho polipéptido de anticuerpo en un ensayo de agregación plaquetaria convencional no da como resultado la agregación de más del 25 % sobre la agregación observada en un ensayo de control negativo.
20. El polipéptido de anticuerpo de la reivindicación 14 o 15 que es monovalente para unión con CD40L (gp39) , en el que la presencia de dicho polipéptido de anticuerpo en un ensayo de agregación plaquetaria convencional no da como resultado la agregación de más del 25 % sobre la agregación observada en un ensayo de control negativo.
21. El polipéptido de anticuerpo de la reivindicación 14 o 15 en el que el polipéptido es humano y está ligado a PEG.
22. El polipéptido de anticuerpo unido a PEG de la reivindicación 21 que tiene un tamaño hidrodinámico de al menos 24 kD.
23. El polipéptido de anticuerpo ligado a PEG de la reivindicación 21 en el que dicho PEG está ligado a dicho anticuerpo en un resto de cisteína o de lisina.
24. El polipéptido de anticuerpo ligado a PEG de la reivindicación 21 en el que el tamaño de PEG total es de 20 a 60 kD, inclusives.
25. El polipéptido de anticuerpo ligado a PEG de la reivindicación 21 que tiene un tamaño hidrodinámico de al menos 200 kD.
26. El polipéptido de anticuerpo ligado a PEG de la reivindicación 21 que tiene una semivida in vivo aumentada en relación con la misma composición polipeptídica que carece de polietilenglicol ligado.
27. El polipéptido de anticuerpo ligado a PEG de la reivindicación 26 en el que la semivida ta de la composición polipeptídica aumenta en el 10 % o más.
28. El polipéptido de anticuerpo ligado a PEG de la reivindicación 26 en el que la semivida ta de la composición polipeptídica está en el intervalo de 0, 25 minutos a 12 horas.
29. El polipéptido de anticuerpo ligado a PEG de la reivindicación 26 en el que la semivida t# de la composición polipeptídica aumenta en el 10 % o más.
30. El polipéptido de anticuerpo ligado a PEG de la reivindicación 26 en el que la semivida t# está en el intervalo de 12 a 48 horas.
31. El polipéptido de anticuerpo de la reivindicación 14 o 15 que es humano y carece de un dominio Fc.
32. El polipéptido de anticuerpo de la reivindicación 31 en el que la presencia de dicho polipéptido de anticuerpo en un ensayo de agregación plaquetaria convencional no da como resultado la agregación de más del 25 % sobre la agregación observada en un ensayo de control negativo.
33. Un polipéptido de la reivindicación 14 o 15, en el que el polipéptido de anticuerpo comprende una o más regiones marco conservadas que comprenden una secuencia de aminoácidos que es la misma que la secuencia de aminoácidos de una región marco conservada correspondiente codificada por un segmento génico de anticuerpo de línea germinal humana, o la secuencia de aminoácidos de una o más de dichas regiones marco conservadas comprende conjuntamente hasta 5 diferencias de aminoácidos en relación con la secuencia de aminoácidos de dicha región marco conservada correspondiente codificada por un segmento génico de anticuerpo de línea germinal humana.
34. Un polipéptido de la reivindicación 14 o 15, en el que las secuencias de aminoácidos de FW1, FW2, FW3 y FW4 del polipéptido de anticuerpo son las mismas que las secuencias de aminoácidos de las regiones marco conservadas correspondientes codificadas por un segmento génico de anticuerpo de línea germinal humana, o las secuencias de aminoácidos de FW1, FW2, FW3 y FW4 contienen conjuntamente hasta 10 diferencias de aminoácidos en relación con las secuencias de aminoácidos de las regiones marco conservadas correspondientes codificadas por dicho segmento génico de anticuerpo de línea germinal humana.
35. El polipéptido de acuerdo con la reivindicación 34, en el que las secuencias de aminoácidos de dichas FW1, FW2 y FW3 del polipéptido de anticuerpo son las mismas que las secuencias de aminoácidos de regiones marco conservadas correspondientes codificadas por segmentos génicos de anticuerpo de línea germinal humana.
36. El polipéptido de acuerdo con la reivindicación 34, en el que dicho segmento génico de anticuerpo de línea germinal humana se selecciona del grupo que consiste en DP47, DP45, DP48 y DPK9.
37. Un polipéptido de anticuerpo de la reivindicación 14 o 15 en el que dicho polipéptido de dominio variable sencillo comprende la secuencia de aminoácidos de CDR1, CDR2 y CDR3 de la SEC ID Nº: 26.
38. Un polipéptido de anticuerpo de la reivindicación 14 o 15 en el que el polipéptido de dominio variable sencillo que se une a CD40L comprende la secuencia de la SEC ID Nº: 26.
39. Un polipéptido de anticuerpo de la reivindicación 14 o 15 en el que el polipéptido de dominio variable sencillo está presente como un homo-o heteromultímero con dominios VH o VL adicionales, en el que el polipéptido de
dominio variable sencillo se une a CD40L independientemente de los dominios VH o VL adicionales.
40. Una composición que comprende el polipéptido de anticuerpo de la reivindicación 14 o 15 y un segundo polipéptido de anticuerpo que se une a un ligando distinto de CD40L, en el que dicho polipéptido de anticuerpo que se une a un ligando distinto de CD40L se une a un ligando seleccionado del grupo que consiste en HSA, TNF∀, IL1, IL-2, IL-4, IL-6, IL-8, IL-12, IL-18, IFN-!, CD2, CD4, CD8, LFA1, LFA3, VLA4, CD80, B7-1, CD28, CD86.
8. 2, CTLA-4, CD28, molécula coestimuladora inducible (ICOS) , CD27, CD30, OX40, CD45, CD69, CD3, CD70, ligando de molécula coestimuladora inducible (ICOSL) , OX40L, HVEM (mediador de entrada del herpesvirus) , UGHT.
41. Una formulación farmacéutica de liberación prolongada que comprende un polipéptido de anticuerpo monovalente anti-CD40L de una cualquiera de las reivindicaciones 14 o 15.
42. Un ligando específico doble que comprende un polipéptido de dominio variable sencillo de anticuerpo de la reivindicación 14 que tiene una especificidad de unión con un primer antígeno y un segundo dominio variable sencillo que tiene una actividad de unión con un segundo antígeno, en el que el primer antígeno es CD40L y el segundo dominio variable sencillo es un antígeno de superficie de célula presentadora de antígenos o un antígeno de superficie de linfocito T.
43. Un ligando de acuerdo con la reivindicación 42 en el que el antígeno de superficie de célula presentadora de antígenos se selecciona del grupo que consiste en antígenos de superficie de macrófagos activados, antígenos de superficie de linfocitos B activados, antígenos de superficie de rutas de señalización co-estimuladoras y MHC.
44. Un ligando de acuerdo con la reivindicación 43 en el que el MHC es de clase II.
45. Un ligando de acuerdo con la reivindicación 44 en el que el MHC de clase II es alfa.
46. Un ligando de acuerdo con la reivindicación 44 en el que el MHC de clase II es beta.
47. Un ligando de acuerdo con la reivindicación 43 en el que el antígeno de superficie de célula presentadora de antígenos se selecciona del grupo que consiste en CD28, molécula coestimuladora inducible (ICOS) , CD27, CD30, OX40, CD45, CD69, CD3, CD70, ligando de molécula coestimuladora inducible (ICOSL) , OX40L, CD80, CD86, HVEM (mediador de entrada del herpesvirus) y LIGHT.
48. Un ligando de acuerdo con la reivindicación 43 en el que el antígeno de superficie de célula presentadora de antígenos se selecciona del grupo que consiste en CD28, molécula coestimuladora inducible (ICOS) , CD27, CD30, OX40, CD45, CD69 y CD3.
49. Un ligando de acuerdo con la reivindicación 43 en el que el antígeno de superficie es un antígeno de superficie de gen B7.
50. Un ligando de acuerdo con la reivindicación 49 en el que el antígeno de superficie de gen B7 es B7-2 o B7-1.
51. Un polipéptido de anticuerpo que comprende un polipéptido de dominio variable sencillo de anticuerpo para tratar
o prevenir un síntoma de enfermedad autoinmunitaria, en el que dicho polipéptido de dominio variable sencillo es monovalente para unión con CD40L (gp39) y antagoniza una actividad de CD40 o CD40L o ambas, y en el que dicho polipéptido de anticuerpo inhibe la unión de un dominio variable sencillo de anticuerpo que comprende la secuencia de aminoácidos de SEC ID Nº: 26 con CD40L.
52. El polipéptido de anticuerpo de acuerdo con la reivindicación 51 en el que dicha enfermedad autoinmunitarias es una enfermedad seleccionada del grupo que consiste en lupus eritematoso sistémico, esclerosis múltiple, artritis reumatoide, diabetes, rechazo de aloinjertos, trasplante y rechazo de xenoinjertos.
53. El polipéptido de anticuerpo de acuerdo con una cualquiera de las reivindicaciones 51 o 52 en el que dicho polipéptido de anticuerpo inhibe la unión de CD40L con CD40.
54. El polipéptido de anticuerpo de acuerdo con una cualquiera de las reivindicaciones 51 a 53 en el que dicho polipéptido de anticuerpo consiste en el polipéptido de dominio variable sencillo.
55. El polipéptido de anticuerpo de acuerdo con una cualquiera de las reivindicaciones 51 a 54 en el que dicho polipéptido de dominio variable sencillo es un polipéptido de dominio variable sencillo de anticuerpo humano.
56. El polipéptido de anticuerpo de acuerdo con una cualquiera de las reivindicaciones 51 a 55 en el que dicho polipéptido de dominio variable sencillo es un dominio VH o VL.
57. El polipéptido de anticuerpo de acuerdo con una cualquiera de las reivindicaciones 51 a 56 en el que dicho polipéptido de anticuerpo es humano e inhibe la unión de CD40L con CD40 con una CI50 en el intervalo de 20 pM a 1, 5 %M.
58. El polipéptido de anticuerpo de acuerdo con una cualquiera de las reivindicaciones 51 a 57 en el que dicho polipéptido de dominio variable sencillo comprende la secuencia de aminoácidos de CDR1, CDR2 y CDR3 de SEC ID Nº: 26.
59. El polipéptido de anticuerpo de acuerdo con una cualquiera de las reivindicaciones 51 a 58 en el que dicho 5 polipéptido de anticuerpo tiene una secuencia de aminoácidos que es al menos un 80 % homóloga a la SEC ID Nº:
26.
60. El polipéptido de anticuerpo de acuerdo con una cualquiera de las reivindicaciones 51 a 59, en el que dicho polipéptido de anticuerpo tiene una secuencia de aminoácidos que es idéntica a la SEC ID Nº: 26.
61. El polipéptido de anticuerpo de acuerdo con una cualquiera de las reivindicaciones 51 a 60 en el que la unión de 10 dicho polipéptido de anticuerpo con CD40L no agoniza sustancialmente la actividad de CD40 y/o CD40L.
62. Un polipéptido de anticuerpo de acuerdo con una cualquiera de las reivindicaciones 51 a 61 en el que la presencia de dicho polipéptido de anticuerpo en un ensayo de agregación plaquetaria convencional no da como resultado la agregación de más del 25 % sobre la agregación observada en un ensayo de control negativo.
63. El polipéptido de anticuerpo de acuerdo con una cualquiera de las reivindicaciones 51 a 62 en el que el
polipéptido de dominio variable sencillo está presente como un homo-o heteromultímero con dominios VH o VL adicionales, en el que el polipéptido de dominio variable sencillo se une a CD40L independientemente de los dominios VH o VL adicionales.
Patentes similares o relacionadas:
Formulaciones estabilizadas que contienen anticuerpos anti-receptor de interleucina 4 (IL-4R), del 29 de Julio de 2020, de REGENERON PHARMACEUTICALS, INC.: Una jeringuilla precargada que contiene una formulación farmacéutica líquida estable, en la que la formulación farmacéutica líquida comprende: […]
Métodos y composiciones para tratar y prevenir enfermedades asociadas con la integrina AVB8, del 29 de Julio de 2020, de THE REGENTS OF THE UNIVERSITY OF CALIFORNIA: Un anticuerpo aislado que se une específicamente a la integrina β8 humana e inhibe la adhesión del péptido asociado a latencia (LAP) a ανβ8, en donde el […]
 Métodos para producir proteínas bicatenarias en bacterias, del 29 de Julio de 2020, de GENENTECH, INC.: Un método para producir un receptor de linfocitos T monoclonal de movilización inmunitaria contra el cáncer (ImmTAC) que comprende una cadena alfa del receptor de linfocitos […]
Métodos para producir proteínas bicatenarias en bacterias, del 29 de Julio de 2020, de GENENTECH, INC.: Un método para producir un receptor de linfocitos T monoclonal de movilización inmunitaria contra el cáncer (ImmTAC) que comprende una cadena alfa del receptor de linfocitos […]
Anticuerpos anti-alfa-sinucleína y procedimientos de uso, del 29 de Julio de 2020, de F. HOFFMANN-LA ROCHE AG: Un anticuerpo anti-alfa-sinucleína humana que comprende (a) HVR-H1 que comprende la secuencia de aminoácidos de SEQ ID NO: 21; (b) HVR-H2 que […]
Bloqueo de CD73, del 22 de Julio de 2020, de Innate Pharma: Un anticuerpo aislado que específicamente se une a un polipéptido CD73 humano en la superficie de una célula y que tiene capacidad de neutralizar […]
Composición de anticuerpos monoclonales dirigidos contra BDCA-2, del 22 de Julio de 2020, de LABORATOIRE FRANCAIS DU FRACTIONNEMENT ET DES BIOTECHNOLOGIES: Composición de anticuerpos monoclonales dirigidos contra la proteína BDCA-2, presentando dichos anticuerpos un porcentaje de fucosilación inferior al 60% […]
Anticuerpos anti-PD-L1 y usos de los mismos, del 22 de Julio de 2020, de MERCK PATENT GMBH: Un anticuerpo anti-PD-L1 aislado o su fragmento de union a antigeno que comprende una secuencia de region variable de cadena pesada y de cadena ligera, en donde: […]
Utilización de anticuerpos optimizados en ADCC para tratar a los pacientes con bajo nivel de respuesta, del 22 de Julio de 2020, de LABORATOIRE FRANCAIS DU FRACTIONNEMENT ET DES BIOTECHNOLOGIES: Utilización de una composición de anticuerpo monoclonal quimérico, humanizado o humano de isotipo IgG1 anti- Rhesus del glóbulo rojo humano cuya […]