Análisis inmunohistoquímico multiplex in situ.
Un método inmunohistoquímico para detectar simultáneamente la presencia o ausencia de al menos tres dianasen una muestra biológica,
que comprende las etapas de:(a) realizar recuperación de antígenos en la muestra biológica, en donde dicha recuperación de antígenoscomprende las etapas:
i. desparafinar y rehidratar la muestra biológica; y
ii. llevar a ebullición en tampón de recuperación de antígenos;
(b) realizar reducción de autofluorescencia en la muestra biológica antes de la etapa (a), la etapa (c) o la etapa(d), en donde dicha reducción de autofluorescencia comprende incubar dicha muestra biológica en una soluciónque comprende ácido clorhídrico al 1 % y etanol al 70 %;
(c) poner en contacto a la muestra biológica con (1) un primer anticuerpo específico para una primera diana, (2)un primer reactivo de marcado en donde dicho primer reactivo de marcado comprende un resto de unión alanticuerpo para dicho primer anticuerpo y un primer resto de detección, (3) un segundo anticuerpo específicopara una segunda diana, (4) un segundo reactivo de marcado que comprende un resto de unión al anticuerpopara dicho segundo anticuerpo y un segundo resto de detección, (5) un tercer anticuerpo específico para unatercera diana, y (6) un tercer reactivo de marcado que comprende un resto de unión al anticuerpo para dichotercer anticuerpo y un tercer resto de detección; y
(d) detectar cada uno de dichos primer, segundo y tercer reactivos de marcado, respectivamente, en dichamuestra biológica con lo que la presencia de dichos primer, segundo y tercer reactivos de marcado,respectivamente, indica la presencia de dichas primera, segunda o tercera dianas, respectivamente, en dichamuestra biológica y la ausencia de dichos primer, segundo o tercer reactivos de marcado indica la ausencia dedichas primera, segunda o tercera dianas, respectivamente, en dicha muestra biológica,
en el que dicha muestra biológica es tejido humano incluido en parafina.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2006/040113.
Solicitante: Fundação D. Anna Sommer Champalimaud E Dr. Carlos Montez Champalimaud.
Nacionalidad solicitante: Portugal.
Dirección: Avenida Brasilia 1400-038 Lisboa PORTUGAL.
Inventor/es: DONOVAN,MICHAEL,J, HAMANN,STEFAN, CLAYTON,MARK, KOTSIANTI,ANGELIKI.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- G01N1/30 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 1/00 Muestreo; Preparación de muestras para la investigación (manipulación de materiales para un análisis automático G01N 35/00). › Tintura; Impregnación.
- G01N33/53 G01N […] › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › Ensayos inmunológicos; Ensayos en los que interviene la formación de uniones bioespecíficas; Materiales a este efecto.
- G01N33/68 G01N 33/00 […] › en los que intervienen proteínas, péptidos o aminoácidos.
PDF original: ES-2434491_T3.pdf
Fragmento de la descripción:
Análisis inmunohistoquímico multiplex in situ La inmunofluorescencia es un método para detectar la distribución de un antígeno en una muestra biológica a través de la unión específica de un anticuerpo que, a su vez, está acoplado a un agente fluorescente. El anticuerpo se une específicamente a la molécula diana de modo que la marca fluorescente indica cualitativa y/o cuantitativamente la presencia de la diana.
Se han desarrollado diferentes métodos para la unión de la marca fluorescente. El método de marcado directo utiliza un anticuerpo primario (un anticuerpo que reconoce a la diana) que es acoplado a continuación al agente fluorescente. Este método requiere mucho trabajo y cierta cantidad de anticuerpo podría inactivarse en el proceso (si la propia marca se une a la región de reconocimiento del antígeno del anticuerpo) .
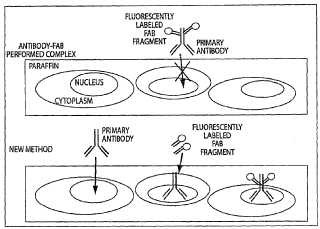
El método indirecto utiliza un anticuerpo secundario - un anticuerpo que reconoce al anticuerpo primario - acoplado a un agente fluorescente para unirse a la marca. Se han descrito varias variaciones diferentes de este método. A menudo el anticuerpo primario se aplica primero a la muestra, seguido por una etapa de lavado y la aplicación de un anticuerpo secundario específico de especie que porta una marca fluorescente. Esto da como resultado, a menudo, problemas de fondo debido a unión inespecífica del anticuerpo secundario al tejido. Otra estrategia ha utilizado complejos de anticuerpo primario-secundario formados previamente (Tuson et al. 1990) . Este método permite el marcado indirecto de anticuerpos primarios derivados de la misma especie, pero el uso de anticuerpos secundarios divalentes puede conducir a complejos entrecruzados.
Una estrategia similar que evita este problema es el uso de fragmentos Fab específicos de Fc monovalentes para la generación de complejos formados previamente y ha sido comercializada por Molecular Probes (Zenon; Eugene, OR) . Otros han modificado este método utilizando fragmentos Fab que reconocen las regiones tanto Fc como f (ab') 2 del anticuerpo primario (Brown et al. 2004) . Esta estrategia se describe en la solicitud estadounidense 10/118.204 presentada el 5 de abril de 2002 y en el documento WO 03/030817.
Todos los métodos anteriores tienen en común que el anticuerpo primario se marca antes de ponerlo en contacto con una muestra biológica. El anticuerpo primario es marcado directamente con un fluoróforo (a través de medios químicos, mediante unión al anticuerpo secundario o un fragmento Fab marcado con un agente fluorescente) o los anticuerpos primarios son detectados con un anticuerpo secundario bivalente que está marcado con un fluoróforo (habitualmente por medios químicos) . Esto puede causar problemas, especialmente en una muestra de tejido incluida en parafina y fijada que es generalmente menos accesible a moléculas grandes que otras muestras biológicas (por ejemplo células cultivadas permeabilizadas y fijadas) . Por ejemplo, un anticuerpo en un complejo formado previamente con un anticuerpo secundario tiene dos veces el peso molecular del anticuerpo primario. Un anticuerpo en un complejo formado previamente con fragmentos Fab tiene aproximadamente dos veces el peso molecular del anticuerpo primario si están unidos tres fragmentos Fab por anticuerpo.
El mayor tamaño de estos complejos puede impedir la penetración suficiente del tejido y, por lo tanto, restringir o inhibir la detección de la molécula diana, causar una excesiva tinción de fondo y, por lo tanto, complicar la detección de la molécula diana. Esto es especialmente relevante para la detección de un biomarcador nuclear, donde los complejos anticuerpo - Fab son incapaces de penetrar en la proteína complejada del núcleo y en su lugar se 45 encuentran acumulados en el citoplasma. Por lo tanto, existe una necesidad de métodos mejorados para analizar antígenos intracelulares.
El documento G.M. Wessel y D.R. McClay, Journal of Histochemistr y and Cytochemistr y vol 34, no. 6 págs. 703-706 (1986) desvela un método inmunohistoquímico en el que la muestra se pone en contacto con anticuerpos no marcados específicos para un antígeno diana dado y posteriormente se pone en contacto con reactivo de marcado. El método se usa para detectar dos (y no más) dianas, específicamente en tejido de erizo de mar.
El documento M Semar et al. (1969) Quantitative Comparison Immunohistochemistr y . Clinical Chemistr y 15 (6) págs. 505-508 desvela la autofluorescencia de proteínas tisulares. El documento S.A. Pilen et al. (1997) Journal of
Pathology 183, págs. 116-123 proporciona una comparación de diferentes métodos de técnicas de recuperación de antígenos en inmunohistoquímica.
Existen cada vez más evidencias de que la proliferación de células tumorales tiene importancia en el pronóstico para diversos tumores que se producen habitualmente, incluyendo linfoma (Braylan R. C., Diamond L. W., Powell M.L., Harty-Golder B. Percentage of cells in the S phase of the cell cycle in human lymphoma determined by flow cytometr y : Correlation with labeling index and patient survival. Cytometr y 1980; 1: 171-174; y Bauer K. D., Merkel D.E., Winter J.N., et al. Prognostic implications of ploidy and proliferative activity in diffuse large cell lymphomas. Cancer Res 1986; 46: 3173-3178) , cáncer de mama (Clark G.M., Dressler L.G:, Owens M.A., Pounds G., Oldaker T., McGuire W.L. Predictions of relapse or survival in patients with mode-negative breast cancer by DNA flow cytometr y . 65 N. Engl J Med 1989; 320: 627-633; Silvestrini R., Daidone M. G., Gasparini G. Cell kinetics as a prognostic marker in node-negative breast cancer. Cancer 1985; 56: 982-1987; y Sigurdsson H, Baldetorp B, Borg A., et al. Indicators of
prognosis in node negative breast cancer. N Engl J Med 1990; 322: 1045-1053) y cáncer de colon (Bauer K. D., Lincoln S. T., Vera-Roman J.M., et al. al. Prognostic implications of proliferative activity and DNA aneuploidy in colonic adenocarcinomas Lab Invest 1987; 57: 329 -335) . En algunos estudios, la proliferación de células tumorales tiene importancia en el pronóstico independiente, incluso aunque el análisis del contenido total de ADN (“ploidía”) no la tenga (Visscher D. W., Zarbo R. J., Greenawald K. A., Crissman J. D. Prognostic significance of morphological parameters and flow cytometric DNA analysis in carcinoma of the breast. Pathol Ann 1990; 25 (Parte-I) : 171-210) .
La citometría de flujo (FCM) se ha usado ampliamente para determinar la actividad del ciclo celular, principalmente mediante cuantificación de la parte de fase S del análisis del contenido de ADN (“ploidía”) . Este método padece una serie de graves limitaciones técnicas, sin embargo. En primer lugar, puede ser difícil obtener suspensiones de células individuales a partir de tumores sólidos, y pueden perderse cantidades variables de células tumorales durante la preparación. En segundo lugar, las células tumorales son diluidas de forma variable por células normales e inflamatorias benignas, lo que puede conducir a subestimación de la fracción de fase S, particularmente para tumores con ADN diploide. En tercer lugar, la complejidad del análisis del contenido de ADN (“ploidía”) , que está
constituida por una serie de curvas solapantes, puede excluir el uso preciso de algoritmos de ajuste de curva para medir la parte de fase S del histograma. Estudios multicentro han mostrado mala reproducibilidad para fracción de fase S de citometría de flujo, haciendo a la utilidad clínica práctica de la medición algo dudosa. Otro problema asociado con la medición de la cinética celular mediante citometría de flujo es que, normalmente, sólo se determina la fracción de fase S, mientras que una proporción significativa de la población de células tumorales puede residir en la fase G1 del ciclo celular, compuesta por células dispuestas a entrar en el ciclo pero que aún no sintetizan ADN. Posiblemente, dos tumores pueden tener fracciones de fase S idénticas pero diferir significativamente en la fracción total de células en estado no de reposo y, por lo tanto, pueden mostrar cinética de crecimiento y respuesta a agentes quimioterapéuticos dependientes del ciclo diferentes.
Por todas estas razones, métodos in situ de análisis del ciclo de células tumorales pueden proporcionar más información biológicamente significativa de la que puede obtenerse usando células tumorales desagregadas (Weinberg D. S. Relative applicability of image analysis and flow cytometr y in clinical medicine. En: Bauer K. D., Duque R. E., eds. Flow cytometr y : Principles and applications. Baltimore: Williams y Wllkins; 1992: 359-372; y Weinberg D. S. Proliferation indices in solid tumors. Adv Pathol Lab Med 1992; 5: 163--191) . Además de garantizar... [Seguir leyendo]
Reivindicaciones:
1. Un método inmunohistoquímico para detectar simultáneamente la presencia o ausencia de al menos tres dianas en una muestra biológica, que comprende las etapas de: 5
(a) realizar recuperación de antígenos en la muestra biológica, en donde dicha recuperación de antígenos comprende las etapas:
i. desparafinar y rehidratar la muestra biológica; y
ii. llevar a ebullición en tampón de recuperación de antígenos;
(b) realizar reducción de autofluorescencia en la muestra biológica antes de la etapa (a) , la etapa (c) o la etapa (d) , en donde dicha reducción de autofluorescencia comprende incubar dicha muestra biológica en una solución que comprende ácido clorhídrico al 1 % y etanol al 70 %;
(c) poner en contacto a la muestra biológica con (1) un primer anticuerpo específico para una primera diana, (2) un primer reactivo de marcado en donde dicho primer reactivo de marcado comprende un resto de unión al anticuerpo para dicho primer anticuerpo y un primer resto de detección, (3) un segundo anticuerpo específico para una segunda diana, (4) un segundo reactivo de marcado que comprende un resto de unión al anticuerpo para dicho segundo anticuerpo y un segundo resto de detección, (5) un tercer anticuerpo específico para una tercera diana, y (6) un tercer reactivo de marcado que comprende un resto de unión al anticuerpo para dicho tercer anticuerpo y un tercer resto de detección; y
(d) detectar cada uno de dichos primer, segundo y tercer reactivos de marcado, respectivamente, en dicha muestra biológica con lo que la presencia de dichos primer, segundo y tercer reactivos de marcado, respectivamente, indica la presencia de dichas primera, segunda o tercera dianas, respectivamente, en dicha muestra biológica y la ausencia de dichos primer, segundo o tercer reactivos de marcado indica la ausencia de dichas primera, segunda o tercera dianas, respectivamente, en dicha muestra biológica,
en el que dicha muestra biológica es tejido humano incluido en parafina.
2. Un método inmunohistoquímico de acuerdo con la reivindicación 1, en el que la etapa (c) comprende:
poner en contacto dicha muestra biológica con i. un primer complejo, que comprende el primer anticuerpo específico para la primera diana y el primer
reactivo de marcado en el que dicho reactivo de marcado comprende un resto de unión al anticuerpo específico para dicho primer anticuerpo y un resto de detección;
ii. el segundo anticuerpo específico para la segunda diana y el segundo reactivo de marcado en donde dicho reactivo de marcado comprende un resto de unión al anticuerpo específico para dicho segundo anticuerpo y un segundo resto de detección; y
iii. el tercer anticuerpo específico para la tercera diana, y el tercer reactivo de marcado que comprende un anticuerpo que comprende un resto de unión al anticuerpo para dicho tercer anticuerpo y un tercer resto de detección.
3. El método de la reivindicación 1 o la reivindicación 2, que comprende además la etapa de lavar dicha muestra 45 biológica antes de la etapa (c) o antes de la etapa (d) .
4. El método de la reivindicación 1 o la reivindicación 2, en el que dicho resto de unión al anticuerpo de al menos uno de dichos primer, segundo o tercer reactivos de marcado es un fragmento de anticuerpo monovalente o una proteína no anticuerpo.
5. El método de la reivindicación 4, en el que dicho fragmento de anticuerpo monovalente es un fragmento Fab o Fab'.
6. El método de la reivindicación 5, en el que dicho fragmento Fab o Fab' se selecciona entre el grupo constituido por
un fragmento de anticuerpo anti-Fc, un fragmento de anticuerpo anti-cadena ligera kappa, un fragmento de anticuerpo anti-cadena ligera lambda y un fragmento de anticuerpo de cadena sencilla.
7. El método de la reivindicación 4, en el que
(a) dicho fragmento de anticuerpo monovalente se deriva de un anticuerpo monoclonal o un anticuerpo policlonal; o
(b) dicha proteína no anticuerpo se selecciona entre el grupo constituido por una proteína G, una proteína A, una proteína L y una lectina.
8. El método de la reivindicación 1 o la reivindicación 2, en el que dicha muestra biológica tiene al menos 10 años de antigüedad.
9. El método de la reivindicación 1 o la reivindicación 2, en el que al menos una de dichas dianas es una proteína nuclear o una oncoproteína.
10. El método de la reivindicación 1 o la reivindicación 2, en el que la presencia de al menos una de dichas dianas 5 es indicativa de la heterogeneidad de las células tumorales.
11. El método de la reivindicación 1 o la reivindicación 2, en el que al menos una de dichas dianas es un receptor de andrógenos, una citoqueratina 18 o una proteína PTEN.
12. El método de la reivindicación 1 o la reivindicación 2, en el que al menos uno de dichos anticuerpos es un anticuerpo monoclonal.
13. El método de la reivindicación 1 o la reivindicación 2, en el que se forma al menos un complejo proteína de marcado-anticuerpo dentro de dicha sección de tejido. 15
14. El método de la reivindicación 1 o la reivindicación 2, en el que al menos uno de dichos restos de detección se selecciona entre el grupo constituido por un resto fluorescente, un resto radiactivo y una enzima.
15. El método de la reivindicación 1, en el que dicha muestra biológica está sustancialmente libre de ácidos 20 nucleicos antes de dicha etapa de detección.
16. El método de la reivindicación 1, que comprende además la etapa de permeabilización del tejido antes de la etapa (c) .
17. El método de la reivindicación 16, en el que dicha permeabilización del tejido comprende incubar dicha muestra biológica en solución salina tamponada por fosfato con Triton-X 100 al 0, 2 %.
18. El método de la reivindicación 1 o la reivindicación 2, en el que dicha muestra biológica tiene al menos 20 años de antigüedad. 30
19. Un método de detección inmunohistoquímica para determinar simultáneamente la concentración o la cantidad de al menos tres dianas en una muestra biológica que comprende las etapas de:
(a) realizar recuperación de antígenos en la muestra biológica usando el método de la reivindicación 1; 35 (b) realizar reducción de autofluorescencia en la muestra biológica usando el método de la reivindicación 1;
(c) poner en contacto a la muestra biológica con (1) un primer anticuerpo específico para una primera diana, (2) un primer reactivo de marcado en donde dicho primer reactivo de marcado comprende un resto de unión al anticuerpo para dicho primer anticuerpo y un primer resto de detección, (3) un segundo anticuerpo específico para una segunda diana, (4) un segundo reactivo de marcado que comprende un resto de unión al anticuerpo para dicho segundo anticuerpo y un segundo resto de detección, (5) un tercer anticuerpo específico para una tercera diana, y (6) un tercer reactivo de marcado que comprende un resto de unión al anticuerpo para dicho tercer anticuerpo y un tercer resto de detección;
(d) detectar dichos primer, segundo y tercer reactivos de marcado en dicha muestra biológica usando el método de la reivindicación 1; 45 (e) comparar la cantidad de reactivos de marcado detectados en la etapa (d) con una muestra de control,
en el que dicha muestra biológica es una sección de tejido humano incluida en parafina y en el que si se ha de determinar la concentración de las dianas, la concentración de dichas primera, segunda y tercera dianas en dicha muestra de control es conocida de modo que la concentración de dicha diana en dicha muestra biológica se 50 determina de este modo.
20. Un método de detección inmunohistoquímica de acuerdo con la reivindicación 19, que comprende además determinar una diferencia en la cantidad de dichas al menos tres dianas en un tejido de muestra con respecto a la distribución de las respectivas dianas en un tejido normal en donde la etapa (e) comprende:
(i) detectar las cantidades de las dianas correspondientes en dicho tejido normal usando el método de la reivindicación 1; y
(ii) comparar las cantidades en dicha muestra biológica con dicho tejido normal para determinar una diferencia
de dichas dianas en la muestra biológica con respecto al tejido normal. 60
21. El método de la reivindicación 19 o la reivindicación 20, en el que al menos una de dichas dianas es un antígeno nuclear.
22. El método de la reivindicación 1 o la reivindicación 2, que comprende además poner en contacto a dicha muestra 65 biológica con un anticuerpo específico para una cuarta diana y un cuarto reactivo de marcado.
23. El método de la reivindicación 22, que comprende además poner en contacto a dicha muestra biológica con un anticuerpo específico para una quinta diana y un quinto reactivo de marcado.
24. El método de la reivindicación 23, que comprende además poner en contacto a dicha muestra biológica con un 5 anticuerpo específico para una sexta diana y un sexto reactivo de marcado.
25. El método de la reivindicación 24, que comprende además poner en contacto a dicha muestra biológica con un anticuerpo específico para una séptima diana y un séptimo reactivo de marcado.
26. Un método de detección inmunohistoquímica para determinar la cantidad de al menos tres dianas en una muestra biológica de acuerdo con la reivindicación 19, en el que dicha muestra de control es una micromatriz.
27. Un método para el diagnóstico o la monitorización del avance de una enfermedad que comprende:
(a) proporcionar una muestra biológica de un paciente, en donde dicha muestra biológica es una sección de tejido humano incluida en parafina;
(b) realizar recuperación de antígenos en la muestra biológica usando el método de la reivindicación 1;
(c) realizar reducción de autofluorescencia en la muestra biológica usando el método de la reivindicación 1;
(d) poner en contacto a la muestra biológica con (1) un primer anticuerpo específico para una primera diana, (2)
un primer reactivo de marcado en donde dicho primer reactivo de marcado comprende un resto de unión al anticuerpo para dicho primer anticuerpo y un primer resto de detección, (3) un segundo anticuerpo específico para una segunda diana, (4) un segundo reactivo de marcado que comprende un resto de unión al anticuerpo para dicho segundo anticuerpo y un segundo resto de detección, (5) un tercer anticuerpo específico para una tercera diana, y (6) un tercer reactivo de marcado que comprende un resto de unión al anticuerpo para dicho tercer anticuerpo y un tercer resto de detección;
(e) detectar simultáneamente una primera cantidad de cada una de al menos tres dianas en dicha muestra biológica usando el método de la reivindicación 1 en un primer momento puntual:
(f) detectar simultáneamente una segunda cantidad de cada una de dichas al menos tres dianas en dicha muestra biológica usando el método de la reivindicación 1 en un segundo momento puntual;
(g) determinar una relación de las primeras cantidades y las segundas cantidades de dichas al menos tres dianas en dicha muestra biológica y relacionar las relaciones con un intervalo predeterminado como indicativo de un estado de dicha enfermedad.
28. El método de la reivindicación 27, en el que dicha enfermedad es enfermedad de Alzheimer, cáncer o una 35 enfermedad inflamatoria.
29. El método de la reivindicación 28, en el que dicho cáncer es un tumor sólido o en el que dicho cáncer es leucemia o linfoma.
30. El método de la reivindicación 28, en el que dicho trastorno inflamatorio es artritis reumatoide o un trastorno inflamatorio del intestino.
31. El método de una cualquiera de las reivindicaciones 1, 2, 19, 20 o 27, en el que dicha diana se selecciona entre el grupo constituido por receptor de andrógenos, Ki67, Ciclina D1, P-PKC zeta, x-metilacil-CoA racemasa (AMACR) ,
receptor del factor de crecimiento epidérmico (EGFR) , PI3 quinasa (PI3K) , factor nuclear Kappa B (NFkB) , receptor 2 del VEGF (P-KDR) , factor de crecimiento endotelial vascular (VEGF) , CD34, pAKT y Caspasa 3a.
32. El método de la reivindicación 27, en el que dicha diana es un antígeno nuclear.
NÚCLEO
SIN MEZCLAR
Sin clasificar
Patentes similares o relacionadas:
Dispositivos modulares para puntos de atención y usos de los mismos, del 29 de Julio de 2020, de Labrador Diagnostics LLC: Un sistema para la detección automatizada de un analito a partir de una muestra de fluido corporal, que comprende: un dispositivo de fluidos que comprende: […]
Anticuerpos del OPGL, del 15 de Julio de 2020, de AMGEN FREMONT INC.: Un anticuerpo, que comprende una cadena pesada y una cadena ligera, donde: a) la cadena pesada comprende: 1) una secuencia de aminoácidos recogida […]
Detección de interacciones proteína a proteína, del 15 de Julio de 2020, de THE GOVERNING COUNCIL OF THE UNIVERSITY OF TORONTO: Un método para medir cuantitativamente la fuerza y la afinidad de una interacción entre una primera proteína de membrana o parte de la misma y una […]
ANTICUERPO MONOCLONAL O UNA PORCIÓN DE UNIÓN A ANTÍGENO DEL MISMO QUE SE UNE A LA PROTEÍNA L DEL VIRUS PARAINFLUENZA HUMANO (PIV); MÉTODO Y KIT PARA DETECTAR AL VIRUS PIV, del 2 de Julio de 2020, de PONTIFICIA UNIVERSIDAD CATÓLICA DE CHILE: La invención presenta la generación de anticuerpos monoclonales, o fragmentos de los mismos, que reconocen la proteína L del virus parainfluenza humano (PIV), donde dichos […]
ANTICUERPOS MONOCLONALES ESPECÍFICOS PARA EL ANTÍGENO PB2 DEL VIRUS DE LA INFLUENZA HUMANA (FLU), SECUENCIAS NUCLEOTÍDICAS; MÉTODO Y KIT DE DIAGNÓSTICO DE INFECCIÓN PRODUCIDA POR FLU, del 2 de Julio de 2020, de PONTIFICIA UNIVERSIDAD CATÓLICA DE CHILE: La invención presenta la generación de anticuerpos monoclonales, o fragmentos de los mismos, que reconocen la proteína PB2 del virus de la influenza humana (Flu), […]
Dispositivo para la detección de analitos, del 1 de Julio de 2020, de TECHLAB, INC.: Un dispositivo para detectar por lo menos una sustancia de interés en una muestra líquida, comprendiendo el dispositivo: (a) una unidad que […]
Un ensayo de la respuesta inmunológica mediada por células, del 17 de Junio de 2020, de Cellestis Limited: Un método para medir una actividad de respuesta inmunológica mediada por células, comprendiendo dicho método: (a) proporcionar una composición de incubación […]
Método de deducción de un valor de positividad de biomarcador en porcentaje para células seleccionadas presentes en un campo de visión, del 10 de Junio de 2020, de NOVARTIS AG: Método de deducción de un valor para el % de positividad de biomarcador (PBP) para todas las células u, opcionalmente, uno o más subconjuntos de las […]