Regulación de la actividad de las proteinas por acetilación reversible.
Un método para identificar un agente que aumente la actividad desacetilasa de un polipéptido SIRT3,
donde el método comprende los pasos de:
(a) poner en contacto en una mezcla de ensayo que contenga NAD+ un polipéptido S 5 IRT3 y un polipéptido acetil- CoA sintetasa 2 (AceCS2) con un agente con potencial terapéutico; y (b) determinar el efecto, si lo hubiera del agente con potencial terapéutico sobre el nivel de AceCS2 acetilado en la mezcla de ensayo;.
donde una disminución en un primer nivel de AceCS2 acetilado en la mezcla de ensayo en comparación con un segundo nivel de AceCS2 acetilado en una mezcla de ensayo, que no ha sido tratada con el agente con potencial terapéutico, es indicativa de un agente que aumenta la actividad desacetilasa del polipéptido SIRT3.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2007/013804.
Solicitante: THE J. DAVID GLADSTONE INSTITUTES.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 1650 OWENS STREET SAN FRANCISCO, CA 94158 ESTADOS UNIDOS DE AMERICA.
Inventor/es: VERDIN,ERIC, SCHWER,Bjoern.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C12N9/00 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › Enzimas, p. ej. ligasas (6.); Proenzimas; Composiciones que las contienen (preparaciones para la limpieza de los dientes que contienen enzimas A61K 8/66, A61Q 11/00; preparaciones de uso médico que contienen enzimas A61K 38/43; composiciones detergentes que contienen enzimas C11D ); Procesos para preparar, activar, inhibir, separar o purificar enzimas.
- G01N33/50 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › Análisis químico de material biológico, p. ej. de sangre o de orina; Ensayos mediante métodos en los que interviene la formación de uniones bioespecíficas con grupos coordinadores; Ensayos inmunológicos (procedimientos de medida o ensayos diferentes de los procedimientos inmunológicos en los que intervienen enzimas o microorganismos, composiciones o papeles reactivos a este efecto, procedimientos para preparar estas composiciones, procedimientos de control sensibles a las condiciones del medio en los procedimientos microbiológicos o enzimáticos C12Q).
- G01N33/573 G01N 33/00 […] › para enzimas o isoenzimas.
PDF original: ES-2380248_T3.pdf
Fragmento de la descripción:
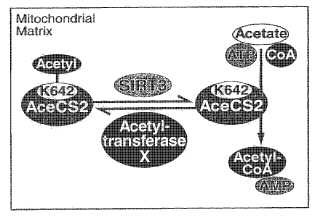
Regulación de la actividad de las proteínas por acetilación reversible Campo de la invención Esta invención da a conocer la primera proteína celular acetilada sustrato de SIRT3, Acetil-CoA sintetasa 2 (AceCS2) , que es una proteína de matriz mitocondrial. La sirtuina mitocondrial SIRT3 interactúa con AceCS2 y controla directamente la actividad de esta enzima metabólica mediante acetilación reversible de lisina. Los moduladores del estado de acetilación o la actividad de AceCS2 son útiles para el tratamiento de patologías, como diabetes tipo II, hipercolesterolemia, hiperlipidemia y obesidad.
Antecedentes de la invención La acetilación reversible de lisina es una modificación post traduccional de la proteína altamente regulada, que es controlada por desacetilasas y acetiltransferasas de proteínas (Han y Martinage, 1992, Int J Biochem 24:19-28; Yang, 2004, Bioessays 26:1076-87) . Mientras originalmente se vinculaba a la transcripción y la dinámica de la cromatina, la acetilación reversible de lisina está emergiendo como un regulador de las funciones celulares como motilidad celular, formación de sinapsis inmunitarias, muerte celular programada y trafico de proteínas (Hubbert et al., 2002, Nature 417:455-458; Kawaguchi et al., 2003, Cell 115:727-38; Serrador et al., 2004, Immunity 20:417-28; Cohen et al., 2004, Science 305:390-2; Cohen et al., 2004, Mol Cell 13:627-38) . Si bien la importancia de la acetilación reversible de lisina de las proteínas nucleares histona y no histona está bien establecida, el rol de la modificación de la proteína mediante acetilación reversible de lisina en la mitocondria es desconocido. Sin embargo, la importancia de la modificación post traduccional de las proteínas mitocondriales como fosforilación y ADPribosilación se está volviendo cada vez más clara y es probable que la acetilación reversible de las proteínas mitocondriales también desempeñe un papel importante en la regulación de las funciones mitocondriales. La desacetilasa dependiente de NAD+ nicotinamida (NAM) adenina dinucleótido, regulador de información silencioso 2 (Sir2) , es un mediador importante de la longevidad en respuesta a las señales de restricción calóricas (CR) en Saccharomyces cerevisiae, Caenorhabditis elegans y Drosophila melanogaster (Kaeberlein et al., 1999, Genes Dev 13:2570-80; Tissenbaum y Guarente, 2001, Nature 410:227-30; Lin et al., 2000, Science 289:2126-8; Rogina y Helfand, 2004, Proc Natl Acad Sci USA 101:15998-6003; Lin et al., 2004, Genes Dev 18:12-6; Lin et al., 2002, Nature 418:344-8; Anderson et al., 2003, Nature 423:181-5) . Se conocen siete homólogos de Sir2 en mamíferos (SIRT1-7) (Fr y e, 1999, Biochem Biophys Res Commun 260:273-9; Fr y e, 2000 Biochem Biophys Res Commun 273:793-8; Blander y Guarente, 2004, Annu Rev Biochem 73:417-35; North and Verdin, 2004, Genome Biol 5:224) . El descubrimiento reciente de que SIRT3, SIRT4 y SIRT5 se encuentran en la mitocondria (Shi et al., 2005, J Biol Chem 280:13560-7; Michishita et al., 2005, Mol Biol Cell 16:4623-35; Onyango et al., 2002, Proc Natl Acad Sci USA 99, 13653-8; Schwer et al., 2002, J Cell Biol 158:647-57) sugieren la existencia de proteínas sustrato de las sirtuinas mitocondriales.
La presente invención da a conocer la identificación de la primera proteína celular acetilada sustrato de SIRT3, la Acetil-CoA sintetasa 2 (AceCS2) , que es una proteína de matriz mitocondrial. AceCS cataliza la unión de acetato con CoA para producir acetil-CoA, una molécula esencial utilizada en varias rutas metabólicas que incluyen la síntesis de ácidos grasos y colesterol y el ciclo del ácido tricarboxílico (TCA) (por una reseña, véase, Bremer y Osmundsen, 1984, en Fatty Acid Metabolism and Its Regulation (Numa, S. ed) , 113-154, Elsevier Science Publisher, Amsterdam) . AceCS de diversos microorganismos y organismos superiores indica una súper familia (Toh, 1990, Protein Sequences Data Anal 3:517-521; Toh, 1991, Protein Sequences Data Anal 4:111-117) , que incluye las acil-CoA sintetasas de cadena larga de mamífero, ACS1-ACS5 (Fujino y Yamamoto, 1992, J Biochem 111:197-203; Fujino et al., J Biol Chem 271:16748-16752; Kang et al., 1997, Proc Natl. Acad Sci USA 94:2880-2884; Suzuki et al., 1990, J Biol Chem 265:8681-8685; Oikawa et al., 1998, J Biochem 124:679-685) . Todas las enzimas de esta súper familia tienen un motivo de secuencia común Ser-Gly- (residuo hidrófilo pequeño) 2-Gly- (cualquier residuo) -Pro-Lys-Gly (SEC. ID Nº : 1) y catalizan reacciones de dos pasos comunes: la adenilación de sustratos y la subsiguiente formación de tioéster (Toh, 1990, Protein Sequences Data Anal 3:517-521; Toh, 1991, Protein Sequences Data Anal 4:111-117) .
Recientemente se clonaron y caracterizaron ADNc de AceCS bovina y murina. Se describieron dos AceCS murinas funcionalmente diferentes: una AceCS cardíaca y una AceCS hepática. La enzima de tipo hepático, denominada AceCS1, es una enzima citosólica, en tanto la enzima cardíaca, denominada AceCS2, se localiza en la matriz mitocondrial (Fujino et al., 2001, J Biol Chem 276:11420-11426) . Basándose en el descubrimiento de que el ARNm de AceCS2 es inducido después del ayuno, se sugirió que AceCS2 proporciona acetil-CoA que se utiliza fundamentalmente para la oxidación en afecciones cetogénicas, como la inanición y la diabetes (Fujino et al., 2001, J Biol Chem 276:11420-11426) . Esta sugerencia es respaldada por el descubrimiento de que el nivel de ARNm de AceCS2 en ratas Zucker diabéticas está aumentado (Fujino et al., 2001, J Biol Chem 276:11420-11426) . Si bien Fujino et al. describieron la inducción de AceCS2 bajo determinadas circunstancias, no investigaron la función precisa y la regulación de AceCS2 (Fujino et al., 2001, J Biol Chem 276:11420-11426) . Para comprender y tratar mejor las patologías, como las afecciones cetogénicas, caracterizadas por niveles elevados de acetato, un sustrato de AceCS2, es importante elucidar esos mecanismos reguladores. La presente invención proporciona uno de dichos mecanismos reguladores mediante la identificación de acetil-CoA sintetasa 2 (AceCS2) con una enzima mitocondrial y como un sustrato celular acetilado de la sirtuina mitocondrial SIRT3. AceCS2 es acetilada reversiblemente en la lisina 642 (Lys 642) en el sitio activo de la enzima. SIRT3 interactúa con AceCS2 y desacetila Lys 642 tanto in vitro como in vivo. La desacetilación de AceCS2 por SIRT3 activa la actividad de acetil-CoA sintetasa de AceCS2.
Sería ventajoso identificar agentes que activaran un nivel o una actividad desacetilasa de SIRT3 o agentes que modularan un nivel, un estado de acetilación, o una actividad de AceCS2. Dichos agentes tendrían utilidad terapéutica en el tratamiento de patologías caracterizadas por niveles elevados de acetato y otras enfermedades o trastornos que son causados, al menos parcialmente, por dichos niveles elevados de acetato. Por consiguiente, la presente invención proporciona métodos para la identificación de dichos agentes, composiciones que los contienen y métodos que usan dichos agentes para el tratamiento de diabetes tipo II, hipercolesterolemia, hiperlipidemia y obesidad.
Breve resumen de la invención La presente invención da a conocer una sirtuina de mamífero, SIRT3, que controla directamente la actividad de una enzima metabólica, la acetil-CoA sintetasa 2 (AceCS2) , mediante acetilación reversible de lisina. Más adelante se describen métodos, composiciones y juegos de reactivos para identificar agentes que aumentan un nivel de o una actividad desacetilasa de un polipéptido SIRT3. La invención también describe métodos, composiciones y juegos de reactivos para identificar agentes que modulan un nivel, un estado de acetilación, o una actividad de un polipéptido acetil-CoA sintetasa 2 (AceCS2) . También se describe en este documento el uso de dichos agentes en métodos, composiciones y juegos de reactivos para reducir niveles de acetato en un individuo, y para el tratamiento de un trastorno caracterizado por niveles de acetato elevados, como diabetes tipo II, hipercolesterolemia, hiperlipidemia u obesidad.
La presente invención proporciona un método para identificar un agente que aumente la actividad desacetilasa de un polipéptido SIRT3, donde el método comprende los pasos de (a) poner en contacto una célula que expresa un polipéptido SIRT3 y un polipéptido AceCS2 con un agente con potencial terapéutico in vitro; y (b) determinar el efecto, si lo hubiera, del agente con potencial terapéutico sobre el nivel de AceCS2 acetilado en la célula; donde una disminución en un primer nivel de AceCS2 acetilado en la célula en comparación con un segundo nivel de AceCS2 acetilado en una célula que no ha sido tratada con el agente con potencial terapéutico,... [Seguir leyendo]
Reivindicaciones:
1. Un método para identificar un agente que aumente la actividad desacetilasa de un polipéptido SIRT3, donde el método comprende los pasos de:
(a) poner en contacto en una mezcla de ensayo que contenga NAD+ un polipéptido SIRT3 y un polipéptido acetil-CoA sintetasa 2 (AceCS2) con un agente con potencial terapéutico; y
(b) determinar el efecto, si lo hubiera del agente con potencial terapéutico sobre el nivel de AceCS2 acetilado en la mezcla de ensayo;. donde una disminución en un primer nivel de AceCS2 acetilado en la mezcla de ensayo en comparación con un segundo nivel de AceCS2 acetilado en una mezcla de ensayo, que no ha sido tratada con el agente con potencial terapéutico, es indicativa de un agente que aumenta la actividad desacetilasa del polipéptido SIRT3.
2. El método de acuerdo con la reivindicación 1, donde el polipéptido AceCS2 acetilado comprende un grupo acetilo marcado con 14C y el paso (b) se realiza midiendo la liberación del grupo acetilo marcado con 14C.
3. Un método para identificar un agente que module el estado de acetilación o la actividad de un polipéptido acetil-CoA sintetasa 2 (AceCS2) , donde el método comprende los pasos de:
(a) poner en contacto un polipéptido AceCS2 en una mezcla de ensayo con un agente con potencial terapéutico; y
(b) determinar el efecto, si lo hubiera, del agente con potencial terapéutico sobre el estado de acetilación o la actividad del polipéptido AceCS2 en la mezcla de ensayo;.
4. Un método para identificar un agente que aumente la actividad desacetilasa de un polipéptido SIRT3, donde el método comprende los pasos de: (a) poner en contacto una célula que expresa un polipéptido SIRT3 y un polipéptido acetil-CoA sintetasa 2 (AceCS2) con un agente con potencial terapéutico in vitro; y (b) determinar el efecto, si lo hubiera, del agente con potencial terapéutico sobre el nivel de AceCS2 acetilado en la célula;. donde una disminución en un primer nivel de AceCS2 acetilado en la célula en comparación con un segundo nivel de AceCS2 acetilado en una célula que no ha sido tratada con el agente con potencial terapéutico, es indicativa de un agente que aumenta la actividad desacetilasa del polipéptido SIRT3.
5. El método de la reivindicación 4, donde el paso (b) comprende un ensayo inmunológico usando un anticuerpo específico para AceCS2 acetilado.
6. El método de la reivindicación 4, donde la célula es una célula de mamífero como una célula cardíaca, una célula muscular o una célula cerebral.
7. El método de la reivindicación 6, donde la célula de mamífero es una célula humana.
8. El método de la reivindicación 1 o la reivindicación 4, que comprende además el paso de:
(c) identificar una estructura o secuencia del agente con potencial terapéutico.
9. Un método para identificar un agente que module el estado de acetilación o la actividad de un polipéptido acetil-CoA sintetasa 2 (AceCS2) , donde el método comprende los pasos de:
(a) poner en contacto una célula que expresa un polipéptido AceCS2 con un agente con potencial terapéutico in vitro; y
(b) determinar el efecto, si lo hubiera, del agente con potencial terapéutico sobre el estado de acetilación, o la actividad del polipéptido AceCS2 en la célula;.
10. El método de acuerdo con cualquiera de las reivindicaciones, 1, 2 y 4 a 8 donde
(i) el polipéptido AceCS2 comprende la secuencia establecida en SEC. ID Nº : 7, 11 o 12; o
(ii) el polipéptido SIRT3 comprende la secuencia de aminoácidos que tiene al menos aproximadamente 85% de identidad de secuencia con la secuencia de aminoácidos establecida en GenBank Nº de registro AAD40851; o
(iii) el polipéptido SIRT3 y el polipéptido AceCS2 se purifican.
11. El método de acuerdo con la reivindicación 3 o la reivindicación 9, donde:
(i) el polipéptido AceCS2 comprende la secuencia establecida en SEC. ID Nº : 7, 11 o 12; o
(ii) el polipéptido AceCS2 se purifica.
12. El método de acuerdo con la reivindicación 3 o la reivindicación 9, donde el paso (b) comprende determinar el efecto, si lo hubiera, del agente con potencial terapéutico sobre el estado de acetilación del polipéptido AceCS2.
13. El método de acuerdo con la reivindicación 1 o la reivindicación 12, donde el paso (b) comprende un ensayo inmunológico usando un anticuerpo específico para AceCS2 acetilado.
14. El método de acuerdo con la reivindicación 12, donde el polipéptido AceCS2 acetilado comprende un grupo acetilo marcado con 14C y el paso (b) se realiza midiendo la liberación del grupo acetilo marcado con 14C.
15. El método de acuerdo con la reivindicación 3 o la reivindicación 9, donde el paso (b) comprende determinar el 5 efecto, si lo hubiera, del agente con potencial terapéutico sobre la actividad del polipéptido AceCS2.
16. El método de la reivindicación 15, donde (i) la actividad del polipéptido AceCS2 es la conversión enzimática de acetato, ATP y coenzima-A en acetil-CoA y AMP; o 10 (ii) la actividad del polipéptido AceCS2 es unirse a un polipéptido SIRT3.
Patentes similares o relacionadas:
Cultivo de tejido tridimensional heterogéneamente diferenciado, del 22 de Julio de 2020, de IMBA-INSTITUT FÜR MOLEKULARE BIOTECHNOLOGIE GMBH: Un cultivo de tejido neuronal tridimensional artificial cultivado in vitro que comprende una población heterogénea de células humanas o células de primate no humanas […]
Gangliósidos para estandarizar y aumentar la sensibilidad de las células a las neurotoxinas botulínicas en los sistemas de prueba in vitro, del 15 de Julio de 2020, de MERZ PHARMA GMBH & CO. KGAA: Un método para determinar la actividad biológica de un polipéptido de neurotoxina, que comprende las etapas de: a) cultivar neuronas de diferentes […]
Procedimiento para evaluación de la función hepática y el flujo sanguíneo portal, del 15 de Julio de 2020, de The Regents of the University of Colorado, a body corporate: Procedimiento in vitro para la estimación del flujo sanguíneo portal en un individuo a partir de una única muestra de sangre o suero, comprendiendo el procedimiento: […]
ANTICUERPO MONOCLONAL O UNA PORCIÓN DE UNIÓN A ANTÍGENO DEL MISMO QUE SE UNE A LA PROTEÍNA L DEL VIRUS PARAINFLUENZA HUMANO (PIV); MÉTODO Y KIT PARA DETECTAR AL VIRUS PIV, del 2 de Julio de 2020, de PONTIFICIA UNIVERSIDAD CATÓLICA DE CHILE: La invención presenta la generación de anticuerpos monoclonales, o fragmentos de los mismos, que reconocen la proteína L del virus parainfluenza humano (PIV), donde dichos […]
ANTICUERPOS MONOCLONALES ESPECÍFICOS PARA EL ANTÍGENO PB2 DEL VIRUS DE LA INFLUENZA HUMANA (FLU), SECUENCIAS NUCLEOTÍDICAS; MÉTODO Y KIT DE DIAGNÓSTICO DE INFECCIÓN PRODUCIDA POR FLU, del 2 de Julio de 2020, de PONTIFICIA UNIVERSIDAD CATÓLICA DE CHILE: La invención presenta la generación de anticuerpos monoclonales, o fragmentos de los mismos, que reconocen la proteína PB2 del virus de la influenza humana (Flu), […]
Diagnóstico y terapia de cáncer que implica células madre cancerosas, del 24 de Junio de 2020, de BioNTech SE: Un anticuerpo que tiene la capacidad de unirse a Claudina 6 (CLDN6) para usar en un método de tratamiento o prevención del cáncer que comprende inhibir y/o eliminar […]
Nueva inmunoterapia contra diversos tumores como el cáncer gastrointestinal y gástrico, del 24 de Junio de 2020, de IMMATICS BIOTECHNOLOGIES GMBH: Péptido seleccionado del grupo siguiente: a) péptido consistente en la secuencia conforme a la SEQ ID N.º 86, b) el péptido conforme a a), en la […]
Reactivos SIRP-alfa de alta afinidad, del 24 de Junio de 2020, de THE BOARD OF TRUSTEES OF THE LELAND STANFORD JUNIOR UNIVERSITY: Un polipéptido SIRPα de alta afinidad que comprende al menos una y no más de 15 modificaciones de aminoácidos dentro del dominio d1 de una secuencia SIRPα de tipo […]