Producción de anticuerpos monoclonales mediante transformación con VEB de células B.
Un procedimiento para producir linfocitos B de memoria inmortalizados,
que comprende la etapa de transformarlinfocitos B de memoria usando virus de Epstein Barr (VEB) en presencia de un activador de células B policlonales,en el que el activador de células B policlonales es un agonista de un receptor de reconocimiento de patrones que seexpresa en células B de memoria.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/IB2004/001071.
Solicitante: INSTITUTE FOR RESEARCH IN BIOMEDICINE .
Nacionalidad solicitante: Suiza.
Dirección: VIA VELA 6 6500 BELLINZONA SUIZA.
Inventor/es: LANZAVECCHIA,ANTONIO.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K39/395 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Anticuerpos (aglutininas A61K 38/36 ); Inmunoglobulinas; Inmunosuero, p. ej. suero antilinfocitario.
- A61P31/14 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 31/00 Antiinfecciosos, es decir antibióticos, antisépticos, quimioterápicos. › para virus ARN.
- C07K16/00 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › Inmunoglobulinas, p. ej. anticuerpos mono o policlonales.
- C07K16/10 C07K […] › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › de virus ARN.
- C07K16/12 C07K 16/00 […] › contra materiales bacterianos.
- C07K16/20 C07K 16/00 […] › de protozoos.
- G01N33/49 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › de sangre.
PDF original: ES-2389930_T3.pdf
Fragmento de la descripción:
Producción de anticuerpos monoclonales mediante transformación con VEB de células B.
Campo técnico
La presente invención se refiere a un procedimiento para preparar células B de memoria inmortalizadas y a un procedimiento para preparar células B de memoria inmortalizadas capaces de producir un anticuerpo monoclonal con una especificidad de antígeno deseada. La invención es particularmente útil para preparar anticuerpos monoclonales humanos. En una realización, la invención se refiere a un procedimiento para preparar células B de memoria humanas inmortalizadas capaces de producir anticuerpos específicos para un agente infeccioso, más particularmente donde el agente infeccioso es el virus del síndrome respiratorio agudo severo (SRAS) . A continuación se describe realizaciones adicionales.
Técnica antecedente
El éxito en generar anticuerpos monoclonales murinos depende de la fusión eficaz y selectiva de blastocitos B estimulados con antígeno con una línea celular de mieloma murino seguida de la selección de híbridos estables productores de anticuerpos (Kohler y Milstein 1975) . El documento FR2817875 describe una versión modificada de este protocolo donde antes de la inmortalización, se induce a los linfocitos B a diferenciarse mediante un sistema activador no específico y una citoquina. Los blastocitos B pueden obtenerse del bazo o ganglios linfáticos. Sin embargo, la dificultad en la obtención de blastocitos B estimulados con antígeno y la ausencia de compañeros de fusión adecuados ha impedido este enfoque en el sistema humano.
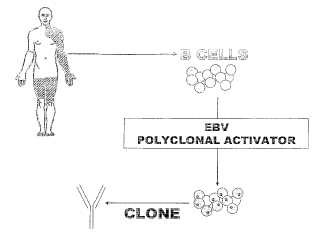
Como enfoque alternativo a crear anticuerpos humanos, se ha usado el virus de Epstein Barr (VEB) para inmortalizar células B humanas (y de primate) productoras de anticuerpos específicos. El procedimiento de VEB se ha descrito en varias publicaciones desde 1977 (Rosen y col. 1977; Steinitz y col. 1977; Steinitz y col. 1980; Kozbor y Roder 1981; Lundgren y col. 1983; Rosen y col. 1983; Steinitz y col. 1984; Lanzavecchia 1985) . Las células B se inmortalizan por infección con VEB y se seleccionan los clones en cultivo que secretan anticuerpos específicos. El procedimiento no requiere refuerzo antigénico, ya que VEB inmortaliza también células B humanas en reposo. Sin embargo, el procedimiento basado en VEB tiene varias limitaciones, concretamente la baja eficacia de la inmortalización, la baja eficacia de clonación de las células B inmortalizadas con VEB, la baja tasa de crecimiento y, en algunos casos, la baja producción de anticuerpos. El documento US4997764 describe un procedimiento para mejorar la tasa de crecimiento de las células inmortalizadas con VEB que comprende transfectar células B infectadas con VEB con ADN c-myc activado. Esto confiere a las células la capacidad de crecer en medios semisólidos y de crecer en huéspedes tales como ratas y ratones. El documento WO95/13089 describe el uso de GM-CSF e IL-3 para estimular la liberación de anticuerpos por células B. Bornkamm y col. (documento US5798230) han superado el problema de la baja producción de anticuerpos inactivando EBNA2. Sin embargo, esto no resuelve el problema de la baja eficacia de inmortalización. Para sortear estos problemas algunos autores han realizado un enriquecimiento de las células B específicas de antígeno antes de la inmortalización con VEB usando, por ejemplo, antígenos solubles biotinilados (Casali y col. 1986) . Otros propusieron la fusión de células inmortalizadas con VEB con mielomas de ratón o heteromielomas humanos-de ratón para explotar le mayor tasa de crecimiento y secreción de Ig de los híbridos (Kozbor y col. 1982; Bron y col. 1984; Thompson y col. 1986) . Se han hecho reivindicaciones de que la eficacia de clonación podría aumentarse por factores de crecimiento derivados de células tales como tiorredoxina en una publicación (Ifversen y col. 1993) , pero estos resultados ni se han confirmado ni se han utilizado, incluso por los mismos autores. En conclusión, aunque el procedimiento de VEB tiene, en principio, algunas ventajas, se ha abandonado a causa de la baja eficacia de inmortalización y clonación.
Otra razón por la cual el procedimiento de VEB se ha quedado obsoleto es que han llegado a estar disponibles enfoques alternativos para crear anticuerpos monoclonales humanos o tipo humano a través de ingeniería genética. Éstos incluyen la humanización de anticuerpos murinos, el aislamiento de anticuerpos a partir de bibliotecas de diferente complejidad y la producción de hibridomas usando el procedimiento clásico en ratones transgénicos para el loci de Ig humana (el "xeno-ratón") . La bibliografía sobre estos enfoques alternativos no se revisa aquí ya que no es directamente relevante para la presente invención. Sin embargo, merece la pena considerar algunas limitaciones de estos procedimientos. La humanización de anticuerpos monoclonales murinos es un procedimiento laborioso e incompleto. Las bibliotecas de anticuerpos aleatorios representan un repertorio no sesgado y por lo tanto pueden usarse para seleccionar especificidades de anticuerpos contra antígenos altamente conservados, pero conducen a anticuerpos de baja afinidad. Las bibliotecas seleccionadas a partir de células sensibilizadas con antígeno se enriquecen para una especificidad particular, pero no conservar el par VH-VL original y generalmente conducen a anticuerpos que tienen menor afinidad por el antígeno que aquellos presentes en el repertorio original de anticuerpos. El impacto de esta tecnología ha sido limitado. En contraste, el xeno-ratón puede inmunizarse de forma eficaz contra un antígeno de elección (especialmente si éste es un antígeno humano) , pero este sistema comparte con la tecnología clásica del hibridoma murino la limitación de que los anticuerpos se seleccionan en una especia diferente a la humana. Por lo tanto, estos procedimientos no son adecuados para producir anticuerpos con las características de los producidos en el transcurso de una respuesta inmune humana fisiológica. Esto es aplicable a la respuesta de anticuerpos contra patógenos humanos incluyendo VIH, las cuatro especies de Plasmodium que cusan la malaria en seres humanos (P. falciparum, P. vivax, P. malariae y P. ovale) , los virus de la hepatitis B y C
humana, el virus del sarampión, virus del Ébola etc. (para una lista exhaustiva véase Fields y col. 1996) . También es aplicable a respuestas de anticuerpos contra alérgenos ambientales generados en pacientes alérgicos, contra antígenos tumorales generados en pacientes que albergan tumores y contra auto-antígenos en pacientes con enfermedades autoinmunes.
Por lo tanto, existe la necesidad de un procedimiento de producción eficaz de anticuerpos monoclonales humanos que se hayan seleccionado en el transcurso de la respuesta inmune natural.
Divulgación de la invención
Aunque la presente invención se ilustra mediante realizaciones en las que se producen anticuerpos monoclonales humanos, las técnicas descritas en este documento no están limitadas de tal modo. La presente invención puede usarse para cualquier especie para la que se desee producir anticuerpos monoclonales de forma eficaz.
La invención se basa en el descubrimiento de que un activador de células B policlonales (tal como secuencias CpG) potencia la eficacia de la inmortalización por VEB y de la clonación de células inmortalizadas por VEB. Esta eficacia aumentada representa un gran salto que hace que la técnica de VEB sea adecuada para el rápido aislamiento de grandes cantidades de anticuerpos monoclonales humanos a partir del repertorio de memoria sin necesidad de inmunización específica o iniciación. Los anticuerpos se seleccionan del entorno inmunocompetente fisiológico estimulado por contacto natural con un patógeno o antígeno. El procedimiento, por lo tanto, es particularmente útil para producir anticuerpos contra determinantes antigénicos que se reconocen específicamente por el sistema inmune humano. Éstos incluyen anticuerpos neutralizantes contra patógenos humanos y anticuerpos contra alérgenos, anticuerpos tumorales, auto-antígenos y alo-antígenos que son parte del repertorio de memoria de un individuo dado. Por lo tanto, no hay necesidad de crear modelos de enfermedad o de inmunización con antígenos purificados. Los anticuerpos producidos también son completamente humanos (incluyendo modificaciones nativas post-traduccionales cuando se expresan en células B) y exploran toda la diversidad generada en el transcurso de una respuesta inmune humana (maduración de afinidad) . Por tanto, la invención proporciona, inter alia, un procedimiento... [Seguir leyendo]
Reivindicaciones:
1. Un procedimiento para producir linfocitos B de memoria inmortalizados, que comprende la etapa de transformar linfocitos B de memoria usando virus de Epstein Barr (VEB) en presencia de un activador de células B policlonales, en el que el activador de células B policlonales es un agonista de un receptor de reconocimiento de patrones que se expresa en células B de memoria.
2. Un procedimiento para producir un clon de un linfocito B de memoria humano inmortalizado capaz de producir un anticuerpo monoclonal humano con una especificidad de antígeno deseada, que comprende las etapas de: (i) transformar una población de células que comprende o que consta de linfocitos B de memoria humanos con virus de Epstein Barr (VEB) en presencia de un activador de células B policlonales, en el que el activador de células B policlonales es un agonista de un receptor de reconocimiento de patrones que se expresa en células B de memoria;
(ii) explorar el sobrenadante de cultivo para la especificidad de antígeno; y (iii) aislar un clon de linfocito B de memoria humano inmortalizado capaz de producir un anticuerpo monoclonal humano que tenga la especificidad de antígeno deseada.
3. Un procedimiento de acuerdo con la reivindicación 1 o reivindicación 2, en el que el activador de células B policlonales es un agonista de un receptor tipo Toll.
4. Un procedimiento de acuerdo con cualquier reivindicación precedente, en el que el activador de células B policlonales es un agonista del receptor tipo Toll-7 (TLR-7) , receptor tipo Toll-9 (TLR-9) y/o receptor tipo Toll-10 (TLR-10) .
5. Un procedimiento de acuerdo con cualquier reivindicación precedente, en el que el activador de células B policlonales se selecciona entre el grupo que consiste en: oligodesoxinucleótidos CpG; R-848 y otros compuestos de imidazoquinolina que estimulan los TLR; imiquimod; loxoribina; 7-tia-8-oxoguanosina; 7-desazaguanosina; y anticuerpos monoclonales que imitan los efectos de estos activadores.
6. Un procedimiento de acuerdo con cualquier reivindicación precedente, en el que el activador de células B policlonales es CpG 2006.
7. Un procedimiento de acuerdo con cualquier reivindicación precedente, en el que se añade un estimulador adicional del crecimiento y/o diferenciación celular durante la etapa de transformación.
8. Un procedimiento de acuerdo con la reivindicación 7, en el que dicho estimulador adicional es una citoquina.
9. Un procedimiento de acuerdo con la reivindicación 8, en el que dicha citoquina es IL-2 o IL-15.
10. Un procedimiento de acuerdo con la reivindicación 2, en el que la clonación se realiza usando dilución limitante.
11. Un procedimiento de acuerdo con una cualquiera de las reivindicaciones 1-9, en el que se selecciona una subpoblación de linfocitos B de memoria humanos con una especificidad de antígeno específica antes de la etapa de transformación.
12. Un procedimiento de acuerdo con cualquier reivindicación precedente, en el que dicho linfocito B de memoria produce un anticuerpo dirigido contra patógenos humanos tales como el virus del SRAS, el virus de la inmunodeficiencia humana; el virus de la hepatitis A; el virus de la hepatitis B; el virus de la hepatitis C; el virus del herpes simple tipo 1 o tipo 2; el virus del sarampión; el virus de las paperas; el virus de la rubéola; el virus de la rabia; el virus del Ébola; el virus de la influenza; el virus del papiloma; el virus vaccinia; el virus de varicela-zóster; virus de la viruela; virus de la polio; el rinovirus; el virus sincitial respiratorio; P. falciparum; P. vivax; P. malariae; P. ovale; Cor y nebacterium diphtheriae; Clostridium tetani; Clostridium botulinum; Bordetella pertussis; Haemophilus influenzae; Neisseria meningitidis, serogrupo A, B, C, W135 y/o Y; Streptococcus pneumoniae; Streptococcus agalactiae; Streptococcus pyogenes; Staphylococcus aureus; Bacillus antracis; Moraxella catarrhalis; Chlaymdia trachomatis; Chlamydia pneumoniae; Yersinia pestis; Francisella tularensis; especies de Salmonella; Vibrio cholerae;
E. coli tóxica; un retrovirus endógeno humano; otros patógenos microbianos; otras toxinas microbianas, alérgenos, antígenos tumorales, autoantígenos y aloantígenos, agentes químicos o toxinas.
13. Un procedimiento para producir un anticuerpo monoclonal humano que comprende preparar un linfocito B de memoria humano inmortalizado por un procedimiento de acuerdo con una cualquiera de las reivindicaciones 2-12, cultivar dicho linfocito B de memoria humano inmortalizado y aislar el anticuerpo monoclonal humano.
14. Un procedimiento para producir un anticuerpo monoclonal humano que comprende las etapas de: (i) preparar un linfocito B de memoria humano inmortalizado por un procedimiento de acuerdo con una cualquiera de las reivindicaciones 2 a 12; (ii) obtener el ácido nucleico del linfocito B de memoria inmortalizado; (iii) insertar el ácido nucleico en un huésped de expresión para permitir la expresión del anticuerpo en este huésped.
15. El procedimiento de la reivindicación 13 o la reivindicación 14, que comprende adicionalmente la etapa de mezclar el anticuerpo monoclonal aislado con un vehículo farmacéuticamente aceptable.
16. Un procedimiento de acuerdo con una cualquiera de las reivindicaciones 1-12, en el que los linfocitos B de memoria no se fusionan con otras células.
17. El procedimiento de una cualquiera de las reivindicaciones 1-12, en el que el linfocito B de memoria es un linfocito B de memoria humano.
18. Un procedimiento para preparar una célula recombinante, que comprende las etapas de: (i) preparar un clon de célula B inmortalizada por el procedimiento de una cualquiera de las reivindicaciones 1 a 12; (ii) obtener el ácido nucleico del clon de célula B que codifica un anticuerpo de interés; y (iii) insertar el ácido nucleico en un huésped de expresión para permitir la expresión del anticuerpo de interés en ese huésped.
19. Un procedimiento para preparar una célula recombinante, que comprende las etapas de: (i) preparar un clon de célula B inmortalizada por el procedimiento de una cualquiera de las reivindicaciones 1 a 12; (ii) secuenciar el ácido nucleico del clon de célula B que codifica un anticuerpo de interés; y (iii) usar la información se secuencia de la etapa (ii) para preparar el ácido nucleico para insertarlo en un huésped de expresión para permitir la expresión del anticuerpo de interés en ese huésped.
20. El procedimiento de la reivindicación 18 o reivindicación 19, en el que el huésped de expresión es una célula de levadura, una célula vegetal o una célula animal.
21. Un procedimiento para preparar una molécula de ácido nucleico que codifica un anticuerpo de interés, que comprende las etapas de: (i) preparar un clon de célula B inmortalizada por el procedimiento de una cualquiera de las reivindicaciones 1 a 12; (ii) obtener del clon de célula B el ácido nucleico que codifica el anticuerpo de interés.
22. Un procedimiento para obtener una secuencia de ácido nucleico que codifica un anticuerpo de interés, que comprende las etapas de: (i) preparar un clon de célula B inmortalizada por el procedimiento de una cualquiera de las reivindicaciones 1 a 12; (ii) secuenciar el ácido nucleico del clon de célula B que codifica el anticuerpo de interés.
23. Un procedimiento para preparar un anticuerpo para uso farmacéutico, que comprende las etapas de: (i) preparar una célula B inmortalizada que produce un anticuerpo de interés por el procedimiento de una cualquiera de las reivindicaciones 2 a 12; (ii) obtener y/o secuenciar el ácido nucleico que codifica el anticuerpo de interés a partir de la célula B seleccionada; (iii) insertar el ácido nucleico en o usar el ácido nucleico para preparar un huésped de expresión que pueda expresar el anticuerpo de interés; (iv) cultivar o subcultivar el huésped de expresión en condiciones en que se exprese el anticuerpo de interés; y, opcionalmente, (v) purificar el anticuerpo de interés.
24. El procedimiento de acuerdo con una cualquiera de las reivindicaciones 18, 19 ó 23, en el que el ácido nucleico se manipula entre las etapas (ii) y (iii) para introducir sitios de restricción, para cambiar el uso de codones, y/o para añadir u optimizar secuencias reguladoras de la transcripción y/o la traducción.
25. El procedimiento de acuerdo con una cualquiera de las reivindicaciones 13, 14 ó 23, en el que el anticuerpo está dirigido contra el virus sincitial respiratorio (VSR) .
Patentes similares o relacionadas:
Formulaciones estabilizadas que contienen anticuerpos anti-receptor de interleucina 4 (IL-4R), del 29 de Julio de 2020, de REGENERON PHARMACEUTICALS, INC.: Una jeringuilla precargada que contiene una formulación farmacéutica líquida estable, en la que la formulación farmacéutica líquida comprende: […]
Anticuerpos anti-PD-L1 y usos de los mismos, del 22 de Julio de 2020, de MERCK PATENT GMBH: Un anticuerpo anti-PD-L1 aislado o su fragmento de union a antigeno que comprende una secuencia de region variable de cadena pesada y de cadena ligera, en donde: […]
Composición para el tratamiento de enfermedades isquémicas o trastornos inflamatorios neurogénicos, que contienen el secretoma de células progenitoras neurales como ingrediente activo, del 22 de Julio de 2020, de S-BIOMEDICS: Una composición para uso en el tratamiento de enfermedad cerebrovascular isquémica, cardiopatía isquémica, infarto de miocardio, enfermedad de Alzheimer, enfermedad […]
Utilización de anticuerpos optimizados en ADCC para tratar a los pacientes con bajo nivel de respuesta, del 22 de Julio de 2020, de LABORATOIRE FRANCAIS DU FRACTIONNEMENT ET DES BIOTECHNOLOGIES: Utilización de una composición de anticuerpo monoclonal quimérico, humanizado o humano de isotipo IgG1 anti- Rhesus del glóbulo rojo humano cuya […]
Composiciones farmacéuticas que contienen una leucocidina E mutada, del 22 de Julio de 2020, de NEW YORK UNIVERSITY: Una composición que comprende: una proteína Leucocidina E (LukE) aislada que comprende la secuencia de aminoácidos de la SEQ ID NO: 4, o un polipéptido […]
Método para producir inmunoconjugados de anticuerpo-SN-38 con un enlazador CL2A, del 22 de Julio de 2020, de IMMUNOMEDICS, INC.: Un método para producir un compuesto, CL2A-SN-38, que presenta la estructura, **(Ver fórmula)** que comprende realizar un esquema de reacción como el que se muestra: **(Ver […]
Composición de anticuerpos monoclonales dirigidos contra BDCA-2, del 22 de Julio de 2020, de LABORATOIRE FRANCAIS DU FRACTIONNEMENT ET DES BIOTECHNOLOGIES: Composición de anticuerpos monoclonales dirigidos contra la proteína BDCA-2, presentando dichos anticuerpos un porcentaje de fucosilación inferior al 60% […]
PTPRS y proteoglicanos en enfermedad autoinmune, del 15 de Julio de 2020, de LA JOLLA INSTITUTE FOR ALLERGY AND IMMUNOLOGY: Una proteína recombinante no enzimática que comprende una secuencia de aminoácidos de un dominio extracelular de PTPRS, donde la proteína comprende tanto el dominio 1 (Ig1) […]