Proceso para la purificación de alfa-1-antitripsina recombinante que implica un paso de cromatografía de intercambio aniónico.
Método para obtener alfa-1-antitripsina recombinante (AATr) altamente purificada,
con una pureza de laAATr superior al 99% p/p de proteína total, a partir de una composición que incluye AATr y al menos unaimpureza procedente del cultivo celular utilizado para general la AATr, comprendiendo el método:
i) cargar una composición que comprende AATr y al menos una impureza en una columna que contieneun material de intercambio aniónico;
ii) lavar el material de intercambio aniónico utilizando un tampón A que comprende entre 1 y 80 mM deiones fosfato y entre 0,1 y 50 mM de N-acetilcisteína (NAC);
iii) eluir la AATr del material de intercambio aniónico mediante el uso de un gradiente que comienza conuna composición tampón que incluye un 100% (v/v) de tampón A y termina con una composicióntampón que incluye un 100% (v/v) de tampón B en de 5 a 100 volúmenes de columna (CV),comprendiendo el tampón B entre 50 y 1.000 mM de iones fosfato y entre 0,1 y 50 mM de NAC,generando así un eluyente que comprende fracciones que contienen la AATr purificada; y
iv) agrupar las fracciones que contienen la AATr purificada
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2007/002839.
Solicitante: BAXTER INTERNATIONAL INC..
Nacionalidad solicitante: Estados Unidos de América.
Dirección: ONE BAXTER PARKWAY DEERFIELD, ILLINOIS 60015 ESTADOS UNIDOS DE AMERICA.
Inventor/es: MITTERER, ARTUR, HASSLACHER, MEINHARD, FIEDLER, CHRISTIAN.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07K14/81 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Inhibidores de proteasa.
- C12N15/81 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › para levaduras.
PDF original: ES-2395667_T3.pdf
Fragmento de la descripción:
Proceso para la purificación de alfa-1-antitripsina recombinante que implica un paso de cromatografía de intercambio aniónico.
CAMPO .
ANTECEDENTES DE LA INVENCIÓN
La presente invención se refiere a un método para obtener alfa-1-antitripsina recombinante (AATr) altamente purificada mediante el empleo de una cromatografía de intercambio aniónico, donde una composición que comprende AATr y al menos una impureza procedente del cultivo celular utilizado para generar la AATr se carga en una columna que contiene un material de intercambio aniónico, llevándose a cabo la cromatografía de intercambio aniónico con tampones que contienen iones fosfato y N-acetilcisteína (NAC) .
La cromatografía por desplazamiento se desarrolló a mediados del siglo XX principalmente para la separación de iones metálicos inorgánicos o elementos de tierras raras, sustancias orgánicas y posteriormente también biomoléculas pequeñas, como antibióticos, aminoácidos y péptidos. A comienzos de los 80' se empezó a aplicar este tipo de cromatografía en la separación de proteínas. Diversas publicaciones resumen la teoría y ejemplos prácticos, por ejemplo Katti y col., 1992 (Katti A.M., Guichon G.A. Fundamentals in Nonlinear Chromatography: Prediction of experimental Profiles, en "Advances in Chromatography" (J.C. Gidding, E.Grushka, P.R. Brown, eds.) , Vol. 31, pp. 1 - 118, 1992) , Shukla y col., 2000 (Shukla A.A., Cramer S.M. Bioseparation by Displacement Chromatography, en "Handbook of Bioseparations" (Ajuha S. ed.) Vol. 2, pp. 379 - 415, Academic Press 2000) o Karlsson y col., 2000 (Karlsson E., Rydén L., Brewer J. Ion Exchange Chromatography, en "Protein Purification" (Janson J-Ch., Rydén L. eds.) segunda edición, pp. 154 - 206, Wiley - Liss 1998) .
En la cromatografía existen diferentes modos de elución, incluyendo la elución isocrática, elución por gradiente y desplazamiento. En la cromatografía por desplazamiento, la columna se eluye con una sustancia, el desplazador (normalmente de bajo peso molecular) de alta afinidad por el adsorbente (resina) , mientras que otras sustancias (por ejemplo productos e impurezas) se mueven a la misma velocidad a través de la columna por delante del desplazador formando zonas rectangulares sucesivas en filas. Un modo alternativo de cromatografía por desplazamiento se denomina también cromatografía por desplazamiento de muestras (Veeraragavan K., Bernier A., Braendli E. 1991, Sample displacement mode chromatography: purification of proteins by use of a high-performance anion-exchange column, J. Chromatogr. Vol. 541: 207 - 220) ) .
En todas las versiones de cromatografía son comunes los efectos no lineales. Éstos se observan como tiempos de retención dependientes de la concentración y picos asimétricos (por ejemplo de cola o frontales) . También se pueden producir picos asimétricos por diversas otras causas, esto es, grandes volúmenes de columna extra. En muchas aplicaciones, los efectos no lineales son desventajosos, ya que reducen la resolución de los picos y alteran la evaluación cuantitativa. Sin embargo, en la cromatografía preparativa se emplea una sobrecarga considerable para aumentar el flujo de material, lo que conduce a importantes efectos no lineales. G. Guiochon, S. Golshan Shirazi y A. M. Katti han publicado un texto exhaustivo sobre la cromatografía no lineal: Fundamentals of Preparative and Non-linear Chromatography, Academic Press, Inc. Boston (1994) .
La alfa-1-antitripsina (AAT) se utiliza en pacientes que sufren de deficiencia genética de alfa-1-antitripsina, que puede provocar una enfermedad pulmonar grave (conocida como enfisema hereditario) . Actualmente, la única farmacoterapia disponible es una AAT derivada de plasma que se administra semanalmente por infusión y que requiere grandes dosis para hacer llegar cantidades terapéuticas de proteína a los pulmones, donde más se necesita. Se ha desarrollado una AAT recombinante (AATr) que se produce en la levadura de panadería Saccharomyces cerevisiae sin adición de ninguna materia prima de origen humano o animal en el proceso de fermentación, durante la purificación y en la formulación final. La AATr está prevista para ser suministrada a los pulmones de los pacientes utilizando un nebulizador. Para evitar reacciones inmunogénicas, en particular contra cantidades residuales de las proteínas de la célula huésped de levadura, es necesario un producto de AATr de alta pureza, en especial en combinación con grandes dosis.
Por consiguiente, existe una gran necesidad de un método fiable para obtener AATr altamente purificada. La presente invención satisface éstas y otras necesidades.
SUMARIO DE LA INVENCIÓN
Así, un objeto de la presente invención es proporcionar un nuevo método para obtener AATr altamente purificada mediante cromatografía de intercambio aniónico.
Una realización de la invención proporciona métodos para obtener alfa-1-antitripsina recombinante (AATr) altamente purificada a partir de una composición que comprende AATr y al menos una impureza procedente del cultivo de células utilizado para generar la AATr. Los métodos incluyen:
i) cargar una composición que comprende AATr y al menos una impureza en una columna que contiene un material de intercambio aniónico;
ii) lavar el material de intercambio aniónico utilizando un tampón A que comprende entre aproximadamente 1 y aproximadamente 80 mM de iones fosfato y entre aproximadamente 0, 1 y aproximadamente 50 mM de Nacetilcisteína (NAC) ;
iii) eluir la AATr del material de intercambio aniónico mediante el uso de un gradiente que comienza con una composición tampón que incluye un 100% (v/v) de tampón A y termina con una composición tampón que incluye un 100% (v/v) de tampón B, en aproximadamente 5 a aproximadamente 100 volúmenes de columna (CV) , comprendiendo el tampón B entre aproximadamente 50 y aproximadamente 1.000 mM de iones fosfato y entre aproximadamente 0, 1 y aproximadamente 50 mM de NAC, generando así un eluyente que comprende fracciones que contienen la AATr purificada; y
iv) agrupar las fracciones que contienen la AATr purificada.
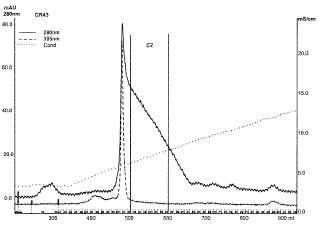
En algunas realizaciones, la o las impurezas son impurezas procedentes de las células utilizadas para generar la AATr. En algunas realizaciones, la o las impurezas son proteínas celulares de levadura. En algunas realizaciones, la o las impurezas se seleccionan de entre proteínas de choque térmico de 12 kDa, YOL09wp, dihidroliponamidadeshidrogenasa, ribosa-5-fosfato-isomerasa, fragmentos de AATr, cistationina-gamma-liasa, glucoquinasa, Oacetilhomoserina-sulfhidrilasa, AATr-dímero, argininosuccinato-liasa, 2-hidroxiácido-deshidrogenasa, hexoquinasa A. En algunas realizaciones, el material de intercambio aniónico se selecciona de entre el grupo consistente en Q Sepharose HP, Cellufine Q, SourceQ, Fractogel EMD DEAE y Toyopearl QAE. En algunas realizaciones, el tampón A tiene un pH entre aproximadamente 6 y aproximadamente 9 y el tampón B tiene un pH entre aproximadamente 6 y aproximadamente 9. En algunas realizaciones, el tampón A y el tampón B tienen el mismo pH. En algunas realizaciones, el paso (i) incluye la carga de aproximadamente 2 a 50 mg/AATr por ml de material de intercambio aniónico en la columna. En algunas realizaciones, el paso (iii) incluye la elución de la AATr del material de intercambio aniónico utilizando un gradiente desde una composición tampón que incluye un 100% (v/v) de tampón A hasta una composición tampón que incluye un 100% (v/v) de tampón B dentro de aproximadamente 30 CV. En algunas realizaciones, el punto de partida para el agrupamiento del paso (iv) está determinado por la absorción UV del eluyente a una longitud de onda de 340 nm a 430 nm y el punto final para el agrupamiento está determinado por la absorción UV del eluyente a 280 nm. En algunas realizaciones, según el método de acuerdo con la reivindicación 10, el agrupamiento de las fracciones de AATr comienza cuando la absorción UV a 395 nm del pico agudo que precede directamente al pico principal de la AATr ha disminuido a menos del 10% de la absorbancia máxima, finalizando el agrupamiento de fracciones de AATr cuando la absorción UV a 280 nm ha disminuido al 40% de la absorción UV controlada al comienzo del agrupamiento.
En algunas realizaciones,
el paso (i) incluye cargar aproximadamente de 10 a 30 mg / AATr por ml de resina en una columna que tiene un diámetro de aproximadamente 80 a 120 cm y que comprende una Q Sepharose HP de 34 μm de media con una altura de lecho de 24 ± 2 cm y un empaquetamiento de > 5.000 placas/metro;
el paso (ii) incluye lavar el material de intercambio aniónico con un tampón A que comprende 30 mM de fosfato de sodio y 3 mM de N-acetilcisteína (NAC) y tiene... [Seguir leyendo]
Reivindicaciones:
1. Método para obtener alfa-1-antitripsina recombinante (AATr) altamente purificada, con una pureza de la AATr superior al 99% p/p de proteína total, a partir de una composición que incluye AATr y al menos una impureza procedente del cultivo celular utilizado para general la AATr, comprendiendo el método:
i) cargar una composición que comprende AATr y al menos una impureza en una columna que contiene un material de intercambio aniónico;
ii) lavar el material de intercambio aniónico utilizando un tampón A que comprende entre 1 y 80 mM de iones fosfato y entre 0, 1 y 50 mM de N-acetilcisteína (NAC) ;
iii) eluir la AATr del material de intercambio aniónico mediante el uso de un gradiente que comienza con una composición tampón que incluye un 100% (v/v) de tampón A y termina con una composición tampón que incluye un 100% (v/v) de tampón B en de 5 a 100 volúmenes de columna (CV) , comprendiendo el tampón B entre 50 y 1.000 mM de iones fosfato y entre 0, 1 y 50 mM de NAC, generando así un eluyente que comprende fracciones que contienen la AATr purificada; y
iv) agrupar las fracciones que contienen la AATr purificada.
2. Método según la reivindicación 1, caracterizado porque la o las impurezas consisten en impurezas procedentes de las células utilizadas para generar la AATr.
3. Método según la reivindicación 1, caracterizado porque la o las impurezas consisten en proteínas celulares de levadura.
4. Método según la reivindicación 1, caracterizado porque la o las impurezas se seleccionan de entre el grupo consistente en proteínas de choque térmico de 12 kDa, YOL09wp, dihidroliponamida-deshidrogenasa, ribosa-5-fosfato-isomerasa, fragmentos de AATr, cistationina-gamma-liasa, glucoquinasa, Oacetilhomoserina-sulfhidrilasa, AATr-dímero, argininosuccinato-liasa, 2-hidroxiácido-deshidrogenasa, hexoquinasa A.
5. Método según la reivindicación 1, caracterizado porque el material de intercambio aniónico se selecciona de entre el grupo consistente en Q Sepharose HP, Cellufine Q, SourceQ, Fractogel EMD DEAE y Toyopearl QAE.
6. Método según la reivindicación 1, caracterizado porque el tampón A tiene un pH de 6 a 9 y el tampón B tiene un pH d 6 a 9.
7. Método según la reivindicación 1, caracterizado porque el tampón A y el tampón B tienen el mismo pH.
8. Método según la reivindicación 1, caracterizado porque el paso (i) incluye la carga de aproximadamente 2 a 50 mg/AATr por ml de material de intercambio aniónico en la columna.
9. Método según la reivindicación 1, caracterizado porque el paso (iii) incluye la elución de la AATr del material de intercambio aniónico utilizando un gradiente de desde una composición tampón que incluye un 100% (v/v) de tampón A hasta una composición tampón que incluye un 100% (v/v) de tampón B en aproximadamente 30 CV.
10. Método según la reivindicación 1, caracterizado porque el punto de partida para el agrupamiento del paso
(iv) está determinado por la absorción UV del eluyente a una longitud de onda de 340 nm a 430 nm y el punto final para el agrupamiento está determinado por la absorción UV del eluyente a 280 nm.
11. Método según la reivindicación 10, caracterizado porque el agrupamiento de las fracciones de AATr comienza cuando la absorción UV a 395 nm del pico agudo que precede directamente al pico principal de la AATr ha disminuido a menos del 10% de la absorbancia máxima y el agrupamiento de las fracciones de AATr finaliza cuando la absorción UV a 280 nm ha disminuido al 40% de la absorción UV controlada al comienzo del agrupamiento.
12. Método según la reivindicación 1, donde
el paso (i) incluye la carga de aproximadamente 10 a 30 mg / AATr por ml de resina en una columna que tiene un diámetro de aproximadamente 80 a 120 cm y que comprende una Q Sepharose HP
de 34 μm de media con una altura de lecho de 24 ± 2 cm y un empaquetamiento de > 5.000 placas/metro;
el paso (ii) incluye el lavado del material de intercambio aniónico con un tampón A que comprende 30 mM de fosfato de sodio y 3 mM de N-acetilcisteína (NAC) y tiene un pH de 7, 7; y
el paso (iii) incluye la elución de la AATr del material de intercambio aniónico utilizando un gradiente lineal que comienza con una composición tampón que incluye un 100% (v/v) de tampón A y 5 termina con una composición tampón que incluye un 50% (v/v) de tampón A y un 50% (v/v) de tampón B,
comprendiendo el tampón B 150 mM de fosfato de sodio y 3 mM de NAC a un pH 7, 7; y
el paso (iv) incluye el agrupamiento de las fracciones que contienen la AATr purificada,
comenzando el agrupamiento de la AATr cuando la absorción UV a 395 nm del pico agudo que precede directamente al pico principal de la AATr ha disminuido a menos del 10% de la absorbancia máxima y el
agrupamiento de fracciones de AATr finaliza cuando la absorción UV a 280 nm ha disminuido al 40% de la absorción UV controlada al comienzo del agrupamiento.
Patentes similares o relacionadas:
Sistema de expresión génica inducible por D-aminoácido para Rhodosporidium y Rhodotorula, del 6 de Mayo de 2020, de TEMASEK LIFE SCIENCES LABORATORY LIMITED: Un sistema de expresión génica inducible por D-aminoácido operable en una célula fúngica transgénica que comprende una construcción de ácido nucleico que comprende un […]
Secuencias de expresión, del 12 de Febrero de 2020, de LONZA LTD.: Un ácido nucleico aislado que codifica un líder unido de forma operable a una secuencia de ácidos nucleicos que codifica una proteína de interés (PDI), en donde el ácido nucleico […]
Cartucho de expresión para la trasformación de una célula eucariótica, método para transformar una célula eucariótica, organismo genéticamente modificado, y procedimiento para la producción de biocombustibles y/o compuestos bioquímicos y biocombustibles producidos de ese modo, del 13 de Noviembre de 2019, de Biocelere Agroindustrial Ltda: Un casete de expresión para transformar una célula eucariótica caracterizado porque comprende una combinación de los siguientes casetes de expresión: […]
Promotor regulable, del 8 de Noviembre de 2019, de LONZA LTD.: Un método para producir una proteína de interés (PDI) mediante el cultivo de una línea de células eucariotas recombinantes que comprenden una construcción […]
Métodos y composiciones para producir escualeno empleando levaduras, del 2 de Octubre de 2019, de Cibus Europe B.V: Una composición que comprende una levadura transformada genéticamente, en donde dicha levadura transformada genéticamente expresa una o más enzimas modificadas […]
Célula de levadura que consume acetato, del 25 de Septiembre de 2019, de DSM IP ASSETS B.V.: Una célula de levadura que está modificada genéticamente, que comprende: a) una alteración de una o más aldehído deshidrogenadas (E.C:1.2.1.4) nativas de la […]
Transformante y procedimiento para la producción del mismo, y procedimiento para la producción de ácido láctico, del 28 de Agosto de 2019, de JMTC Enzyme Corporation: Transformante de Schizosaccharomyces pombe que comprende 3 copias de un gen de lactato deshidrogenasa humano, en el que las 3 copias del gen de lactato deshidrogenasa humano […]
Anticuerpo de PD-1, fragmento de unión a antígeno del mismo y aplicación médica del mismo, del 21 de Agosto de 2019, de Shanghai Hengrui Pharmaceutical Co. Ltd: Un anticuerpo de PD-1, o un fragmento de unión a antígeno del mismo, que comprende: una región variable de cadena ligera que comprende […]