POLÍMEROS HIDRÓFILOS COMO SISTEMAS DE LIBERACIÓN DE COMPUESTOS BIOACTIVOS EN MALLAS DE APLICACIÓN QUIRÚRGICA.
Polímeros hidrófilos como sistemas de liberación de compuestos bioactivos en mallas de aplicación quirúrgica.
La presente invención se refiere a una prótesis de malla que comprende una malla médica impregnada con un copolímero acrílico bioactivo, caracterizada porque la cantidad de copolímero acrílico bioactivo está entre el 5 y el 40% p/p respecto al total y el copolímero acrílico bioactivo comprende: entre un 30 y un 95 % p/p de uno o varios monómeros con grupos hidroxilo; entre un 5 y un 55 % p/p de uno o varios monómeros con grupos sulfónicos; y entre 0,01 % y un 50% p/p de un agente bioactivo, y al uso de dicha prótesis de malla intervenciones quirúrgicas para la reparación de procesos herniarios.
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P200930975.
Solicitante: CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS (CSIC).
Nacionalidad solicitante: España.
Inventor/es: SAN ROMAN DEL BARRIO,JULIO, FERNANDEZ GUTIERREZ,MARIA DEL MAR, BELLON CANEIRO,JUAN M.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61F2/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61F FILTROS IMPLANTABLES EN LOS VASOS SANGUINEOS; PROTESIS; DISPOSITIVOS QUE MANTIENEN LA LUZ O QUE EVITAN EL COLAPSO DE ESTRUCTURAS TUBULARES, p. ej. STENTS; DISPOSITIVOS DE ORTOPEDIA, CURA O PARA LA CONTRACEPCION; FOMENTACION; TRATAMIENTO O PROTECCION DE OJOS Y OIDOS; VENDAJES, APOSITOS O COMPRESAS ABSORBENTES; BOTIQUINES DE PRIMEROS AUXILIOS (prótesis dentales A61C). › Filtros implantables en los vasos sanguíneos; Prótesis, es decir, elementos de sustitución o de reemplazo para partes del cuerpo; Dispositivos para unirlas al cuerpo; Dispositivos para proporcionar permeabilidad o para evitar que colapsen las estructuras tubulares del cuerpo, p. ej. stents (como artículos cosméticos, ver las subclases apropiadas, p. ej. pelucas o postizos, A41G 3/00, A41G 5/00, uñas artificiales A45D 31/00; prótesis dentales A61C 13/00; materiales para prótesis A61L 27/00; riñones artificiales A61M 1/14; corazones artificiales A61M 60/00).
- A61L27/34 A61 […] › A61L PROCEDIMIENTOS O APARATOS PARA ESTERILIZAR MATERIALES U OBJECTOS EN GENERAL; DESINFECCION, ESTERILIZACION O DESODORIZACION DEL AIRE; ASPECTOS QUIMICOS DE VENDAS, APOSITOS, COMPRESAS ABSORBENTES O ARTICULOS QUIRURGICOS; MATERIALES PARA VENDAS, APOSITOS, COMPRESAS ABSORBENTES O ARTICULOS QUIRURGICOS (conservación de cuerpos o desinfección caracterizada por los agentes empleados A01N; conservación, p. ej. esterilización de alimentos o productos alimenticios A23; preparaciones de uso medico, dental o para el aseo A61K). › A61L 27/00 Materiales para prótesis o para revestimiento de prótesis (prótesis dentales A61C 13/00; forma o estructura de las prótesis A61F 2/00; empleo de preparaciones para la fabricación de dientes artificiales A61K 6/80; riñones artificiales A61M 1/14). › Materiales macromoleculares.
- A61L27/44 A61L 27/00 […] › que tienen una matriz macromolecular.
- A61L27/54 A61L 27/00 […] › Materiales biológicamente activos, p. ej. sustancias terapéuticas.
- A61L27/58 A61L 27/00 […] › Materiales al menos parcialmente reabsorbibles por el organismo.
PDF original: ES-2359321_A1.pdf
Fragmento de la descripción:
Polímeros hidrófilos como sistemas de liberación de compuestos bioactivos en mallas de aplicación quirúrgica.
La presente invención se refiere al desarrollo de sistemas de liberación de agentes bioactivo, preferiblemente antibióticos, en base a polímeros hidrófilos para ser utilizados como recubrimientos de prótesis en forma de malla polimérica con especial interés en aplicaciones quirúrgicas abdominales. Por lo tanto la presente solicitud se engloba dentro del campo de la medicina.
Estado de la técnica anterior
La reparación de procesos hemiarios es una de las intervenciones quirúrgicas más frecuentes en cirugía general por detrás de la de cataratas en EEUU. Cuando se intervienen grandes defectos de la pared abdominal: hernias incisionales, (generalmente secundarias a laparotomías previas), eliminación de tumores, etc. La colocación de un biomaterial de sustitución y/o refuerzo está hoy en día casi plenamente consensuado por parte de todos los cirujanos. La introducción por primera vez de una malla de polipropileno por Uscher en 1962 fue considerado uno de los mejores avances conseguidos en esta cirugía [Uscher, Hernia repair with marlex mesh. Arch Surg., 1962. 84: p. 325-8).]. Los efectos positivos derivados del uso de mallas abdominales ha estimulado la búsqueda de mallas óptimas con alta biocompatibilidad y baja adhesión celular. Existen en el mercado gran cantidad de mallas hechas de materiales sintéticos reabsorbibles, no reabsorbibles o de material orgánico derivado de humanos o de cerdo. Esta amplia variedad de sistemas implica importantes diferencias en la interacción de la malla con los microorganismos después de su implantación. Una de las más devastadoras consecuencias del uso de un material prostético es la aparición de una infección. En la reparación de grandes hernias donde el paciente se somete a varias intervenciones quirúrgicas, la incidencia de infección puede alcanzar un 10%. Los microorganismos implicados en dichas infecciones corresponden a bacterias de la piel del paciente, concretamente a Staphylococcus aureus (Sa) y Staphylococcus epidermidis (Se). La infección puede alterar la integración del biomaterial en el tejido y por tanto el proceso de curación del paciente que puede sufrir otra hernia y por tanto otra operación. La adhesión de una bacteria a la superficie de un biomaterial es el paso determinante en la patogénesis de la infección. Algunos microorganismos son capaces de formar una biopelícula o biofilm sobre la malla que los protege del sistema inmunitario y de la acción de lo antibióticos. La bacteria se envuelve y se protege, con lo que consigue una adhesión fuerte e irreversible a la superficie del implante sobreviviendo sobre la misma.
Una vez que la malla ha sido infectada no existe tratamiento posible y la única solución es extraer la prótesis. En la estrategia de prevención de infección es una buena técnica quirúrgica (menos traumática), minimizar la contaminación durante la cirugía, antibióticos perioperatorios sistémicos. La administración de antibióticos sistémicos profilácticos en monodosis es una medida estándar y ha demostrado ser una medida eficaz en la cirugía de diversos implantes, entre ellos los ortopédicos y las prótesis mamarias (Pittet B, Montandon D, Pittet D. Infection in breast implants. Lancet Infect Dis. 2005 Feb; 5(2):94-106. Review.) pero no en la hernioplastia con malla primaria lo que podría justificar el uso de la malla como modelo de infección local con recubrimiento liberador de antibiótico además de su simplicidad. La mejor forma de tratar la infección de un implante es prevenir la colonización de los microorganismos en las fases iniciales, evitando la formación de biofilm, que hace que persistan en el biomaterial a pesar de los tratamientos. Es necesario prevenir la adhesión inicial de la bacteria y un método es modificar la superficie del implante, recubriéndolo de polímeros que liberen antibiótico e impidan esa colonización. Hasta la fecha esta aproximación no ha sido desarrollada ni experimental ni comercialmente.
En cuanto a los polímeros formadores de recubrimientos los sistemas acrílicos hidrófilos han sido ampliamente utilizados, concretamente sistemas en base al ácido 2-acrilamido-2-metilpropano sulfónico (AMPS) y/o metacrilato de 2-hidroxietilo (HEMA). El AMPS es un monómero aniónico, portador de un grupo sulfónico (ácido fuerte) ionizado en prácticamente todo el rango de pHs [Tong Z., L.X., Swelling equilibria and volume phase transition in hydrogels with strongly dissociating electrolytes. Macromolecules, 1994. 27].
Por otra parte, tanto los polímeros como los copolímeros de HEMA tienen amplias aplicaciones en cirugía y medicina, entre las que cabe destacar: lentes de contacto [Rostoke M.V., L.L., Hema copolymers having high oxygen permeability., N.P.D. Corp, Editor. 1977: EEUU.], cicatrizantes, recubrimientos hemocompatibles, sistemas de liberación de fármacos, prótesis quirúrgicas, membranas de diálisis, córneas artificiales ... etc. [López G.P., R.B.D., Rapoza R.J., Horbett T.A., Plasma deposition of ultrathin films of poly(hydroxyethylmethacrylate): Surface Analysis and protein adsorption measurements. Macromolecules, 1993. 26(13): p. 3247-3253]. Esto se debe a su capacidad para formar hidrogeles biocompatibles con una excelente tolerancia y buena estabilidad [Montheard J.P., C.M., Chappard D., 2-hydroxyethyl methacrylate (HEMA): chemical properties and applications in the biomedical fields. Macromol Sci Macromol Rev, 1992. 32: p. 1-34],
Descripción de la invención
A la vista del estado de la técnica descrito, un primer objeto o aspecto, de la presente invención es proporcionar una prótesis de malla que comprende una malla médica impregnada con un copolímero acrílico bioactivo, caracterizada porque la cantidad de copolímero acrílico bioactivo está entre el 5 y el 40% p/p (peso/peso) respecto al total y el copolímero acrílico bioactivo comprende: entre un 30 y un 95% p/p de uno o varios monómeros con grupos hidroxilo; entre un 5 y un 55% p/p de uno o varios monómeros con grupos sulfónicos; y entre 0,01% y un 50% p/p de un agente bioactivo.
Estas prótesis tienen la ventaja de que los polímeros son reabsorbidos en pocos días evitando así los posibles efectos secundarios, pero a la vez permitiendo la aplicación y la dosificación de forma controlada y localizada de compuestos bioactivos. Por ejemplo en el caso de que el agente bioactivo sea un antibiótico, estos se liberan de una manera adecuada para evitar las infecciones post implante en las críticas primeras 48 h. Además los recubrimientos de las prótesis de malla de la invención demuestran una solubilidad óptima y liberan el principio activo de una manera adecuada. Si estos recubrimientos tuvieran una solubilidad extremada se disolverían en unos pocos minutos/horas, o por el contrario si fueran muy insolubles, no dejarían liberar al principio activo.
Adicionalmente, un segundo aspecto de la presente invención es un proceso para la manufacturación de estas prótesis de malla del primer aspecto que comprende al menos las siguientes etapas:
Este procedimiento es conocido en el estado de la técnica como "casting" (F. Lecomte J. Siepmann, M. Walther, R.J. MacRae, R. Bodmeier, Blends of enteric and GIT-insoluble polymers used for film coating: physicochemical characterization and drug releasepatterns. Journal Control release 89, 2003, 457-471) y siendo una de sus ventajas principales la sencillez de llevarlo a cabo. Una etapa importante del proceso es que la deposición de la etapa (ii) sea lo más homogénea posible, por lo ésta se puede realizar mediante deposición de la disolución gota a gota hasta el recubrimiento total o por simple inmersión en la solución etanólica. El etanol es importante por su prácticamente nula toxicidad, y sus características que hacen que durante el secado se disminuyan la formación de grumos en comparación con otros disolventes.
Como se puede absorber el copolímero acrílico bioactivo de diferentes maneras conocidas para los expertos en la materia un tercer aspecto es el uso de un copolímero acrílico bioactivo que comprende entre un 30 y un... [Seguir leyendo]
Reivindicaciones:
1. Una prótesis de malla que comprende una malla médica impregnada con un copolímero acrílico bioactivo, caracterizada porque la cantidad de copolímero acrílico bioactivo está entre el 5 y el 40% p/p respecto al total y el copolímero acrílico bioactivo comprende: entre un 30 y un 95% p/p de uno o varios monómeros con grupos hidroxilo; entre un 5 y un 55% p/p de uno o varios monómeros con grupos sulfónicos; y entre 0,01% y un 50% p/p de un agente bioactivo.
2. La prótesis de malla según la reivindicación anterior, caracterizada porque el monómero con grupos hidroxilo comprende al menos un acrilato de hidroxialquilo o un metacrilato de hidroxialquilo de fórmula general (I):

donde:
n es de 0 a 4;
m es de 0 a 1;
R1 es un hidrógeno o un radical metilo.
3. La prótesis de malla según la reivindicación anterior, caracterizada porque el monómero con grupos hidroxilo comprende metacrilato de 2-hidroxietilo.
4. La prótesis de malla según cualquiera de las tres reivindicaciones anteriores, caracterizada porque el monómero con grupos sulfónicos comprende monómeros con la fórmula general (II):
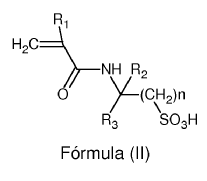
donde:
R1 es un hidrógeno o radical metilo;
R2 y R3 son iguales o diferentes entre sí y representan un hidrógeno o un radical alquilo (C1-C3);
n es un valor de 1 a 6.
5. La prótesis de malla según la reivindicación anterior, caracterizada porque el monómero con grupos sulfónicos comprende 2-acrilamido-2-metilpropano sulfónico.
6. La prótesis de malla según la reivindicación anterior, caracterizada porque comprende monómeros de metacrilato de 2-hidroxietilo y monómeros de 2-acrilamido-2-metilpropano sulfónico.
7. La prótesis de malla según cualquiera de las reivindicaciones anteriores, caracterizada porque el agente bioactivo se selecciona entre un antibiótico, un antitrombogénico, un antiangiogénico, un proangiogénico y cualquiera de sus mezclas.
8. La prótesis de malla según la reivindicación anterior, caracterizada porque el bioactivo es un antibiótico.
9. La prótesis de malla según la reivindicación anterior, caracterizada porque el antibiótico es una quinolona, un glucopéptido, una tetraciclina, una oxazolidinona, un macrólido, una liposamida, un estreptogramin sulfonamidas, polipeptidos, penicilinas, ansamicinas o cualquiera de sus mezclas.
10. La prótesis de malla según la reivindicación anterior, caracterizada porque el bioactivo es un glucopéptido.
11. La prótesis de malla según la reivindicación anterior, caracterizada porque el glucopéptido es vancomicina, eritromicin, neomicin, estreptomicin, daptomicin, rifamicin, puromicin, lincomicin o cualquiera de sus combinaciones.
12. La prótesis de malla según cualquiera de las reivindicaciones anteriores, caracterizada porque la cantidad de copolímero acrílico bioactivo está entre el 15 y el 30% p/p.
13. La prótesis de malla según cualquiera de las reivindicaciones anteriores, caracterizada porque el copolímero acrílico bioactivo comprende entre un 45 y un 75% p/p de uno o varios monómeros con grupos hidroxilo.
14. La prótesis de malla según cualquiera de las reivindicaciones anteriores, caracterizada porque el copolímero acrílico bioactivo comprende entre un 10 y un 35% p/p de uno o varios monómeros con grupos sulfónicos.
15. La prótesis de malla según cualquiera de las reivindicaciones anteriores, caracterizada porque el copolímero acrílico bioactivo comprende entre un 5 y un 30% p/p de agente bioactivo.
16. La prótesis de malla según cualquiera de las reivindicaciones anteriores, caracterizada porque el copolímero acrílico bioactivo comprende polietilenglicol, preferiblemente entre un 10 y un 30% p/p.
17. La prótesis de malla según cualquiera de las reivindicaciones anteriores, caracterizada porque la malla médica está compuesta por polipropileno monofilamento de bajo peso molecular, polipropileno monofilamento de alto peso molecular, polipropileno doble filamento de alto peso molecular, polipropileno poro grande multifilamento, poliéster de alto peso molecular multifilamento, politetrafuoroetileno o cualquiera de sus combinaciones.
18. Procedimiento para la obtención de la prótesis de malla como se definen en cualquiera de las reivindicaciones 1 a 17, caracterizado porque:
19. El procedimiento según la reivindicación anterior, caracterizado porque en la etapa (i) se disuelve el copolímero acrílico bioactivo en una proporción entre el 1 y el 5% p/v en etanol.
20. El procedimiento según cualquiera de las dos reivindicaciones anteriores, caracterizado porque en la etapa (ii) se deposita entre 5 y 20 ml_ de disolución por gramo de malla.
21. El procedimiento según cualquiera de las tres reivindicaciones anteriores, caracterizado porque en la etapa (iii) se evapora el disolvente a temperatura ambiente.
22. El procedimiento según cualquiera de las reivindicaciones 18 a 20, caracterizado porque el proceso de obtención del copolímero acrílico bioactivo comprende:
23. El procedimiento según cualquiera de las dos reivindicaciones anteriores, caracterizado porque en la etapa (i') la concentración de agente bioactivo en la solución de acuosa está entre 5 mg/mL y 40 mg/mL.
24. El procedimiento según cualquiera de las dos reivindicaciones anteriores, caracterizado porque en la etapa (i') la concentración de polietilenglicol en la solución de acuosa está entre 5 mg/mL y 40 mg/mL.
25. El procedimiento según cualquiera de las reivindicaciones 18 a 24, caracterizado porque el procedimiento para la obtención del copolímero acrílico comprende las siguientes etapas:
26. El procedimiento según la reivindicación anterior, caracterizado porque el iniciador de polimerización radical es el azobis-isobutironitrilo (AIBN), y está en una proporción entre 0,25 y 2% p/p.
27. El procedimiento según cualquiera de las dos reivindicaciones anteriores, caracterizado porque en (ii'') la mezcla de reacción se desoxigena con una corriente de nitrógeno.
28. El procedimiento según cualquiera de las tres reivindicaciones anteriores, caracterizado porque en la etapa (iii'') el tratamiento térmico se efectúa a una temperatura de entre 60 y 80ºC.
29. El uso de un copolímero acrílico bioactivo que comprende entre un 30 y un 95% p/p de uno o varios monómeros con grupos hidroxilo; entre un 5 y un 55% p/p de uno o varios monómeros con grupos sulfónicos; y entre 0,01% y un 50% p/p de un agente bioactivo para la impregnación de mallas médicas.
Patentes similares o relacionadas:
Películas de proteína de múltiples capas, métodos de preparación y dispositivos de suministro de fármacos e implantes biomédicos que emplean las películas, del 15 de Julio de 2020, de AddBIO AB: Un implante biomédico que comprende un sustrato de implante y una película de proteína de múltiples capas en al menos una porción de la superficie del sustrato de implante, […]
Dispositivo médico que tiene un revestimiento que comprende ACCS, del 15 de Julio de 2020, de Noveome Biotherapeutics, Inc: Un dispositivo médico implantable que tiene un revestimiento en su superficie, útil para la implantación quirúrgica en el cuerpo de un sujeto, […]
Composición de fármaco y revestimiento asociado, del 1 de Julio de 2020, de W.L. GORE & ASSOCIATES, INC.: Un producto sanitario para administrar un agente terapéutico a un tejido, y el producto tiene una capa de revestimiento aplicada en una superficie del producto, y la capa […]
Matriz de soporte de injerto para reparación de cartílago y procedimiento de obtención de la misma, del 1 de Julio de 2020, de ETH ZURICH: Un procedimiento de proporción de una matriz de soporte de injerto para reparación de cartílagos, particularmente en un paciente humano, que comprende las etapas de: […]
Métodos y dispositivos para trasplante celular, del 10 de Junio de 2020, de Sernova Corporation: Un dispositivo para implantar células en un cuerpo huésped, que comprende: un andamio poroso que comprende al menos una cámara que tiene un extremo proximal y un extremo […]
Procedimientos de preparación de un hidrogel esterilizado de modo terminal que proviene de matriz extracelular, del 22 de Abril de 2020, de UNIVERSITY OF PITTSBURGH OF THE COMMONWEALTH SYSTEM OF HIGHER EDUCATION: Un procedimiento de preparación de un material digerido de matriz extracelular esterilizado de modo terminal capaz de gelificar, que comprende: (i) solubilizar la matriz […]
Composiciones y métodos para el tratamiento de huecos óseos y fracturas abiertas, del 22 de Abril de 2020, de Polypid Ltd: Una composición farmacéutica que comprende partículas de relleno óseo recubiertas y no recubiertas en una proporción entre aproximadamente 1:3 […]
Formulación de FGF-18 en hidrogeles de alginato/colágeno, del 15 de Abril de 2020, de Ares Trading SA: Un sistema de gelificación de dos componentes, en donde dicho sistema de gelificación se forma a partir de: a. un primer componente (solución 1) […]