Microarn que regulan la proliferación y diferenciación de células musculares.
Una cantidad eficaz de miR-1, un inhibidor de miR-1, miR-133 y un inhibidor de miR-133 para su uso en un procedimiento para tratar una lesión muscular en un sujeto,
preferentemente un mamífero, en la que miR-133 y un inhibidor de miR-1 se administran en combinación al sitio de lesión muscular en un primer momento de tiempo y miR-1 y un inhibidor de miR-133 se administran en combinación al sitio de lesión muscular en un segundo momento de tiempo.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2006/047255.
Solicitante: THE UNIVERSITY OF NORTH CAROLINA AT CHAPEL HILL.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 308 BYNUM HALL CAMPUS BOX 4105 CHAPEL HILL, NC 27599-4105 ESTADOS UNIDOS DE AMERICA.
Inventor/es: WANG,Da-zhi, CHEN,Jianfu.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61P21/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Medicamentos para el tratamiento de trastornos del sistema muscular o neuromuscular.
- C12N15/113 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Acidos nucleicos no codificantes que modulan la expresión de genes, p.ej. oligonucleótidos antisentido.
PDF original: ES-2387250_T3.pdf
Fragmento de la descripción:
MicroARN que regulan la proliferación y diferenciación de células musculares.
CAMPO TÉCNICO
La materia presentemente desvelada se refiere, en general, a procedimientos y composiciones para modular la expresión génica en un miocito. Más particularmente, la materia presentemente desvelada se refiere a procedimientos de uso de microARN (miARN) para modular el nivel de expresión de un gen en un miocito, y a composiciones que comprenden miARN.
ANTECEDENTES
El entendimiento de los mecanismos moleculares que regulan la proliferación y diferenciación celular es un tema central de la biología del desarrollo. Los microARN (miARN) son una clase recientemente descubierta de ARN reguladores de ѝ 22 nucleótidos que regulan postranscripcionalmente la expresión génica1, 2. Un aumento de pruebas ha indicado la posible función de miARN en una variedad de procesos biológicos3-8 .
ZHAO Y Y COL.: “Serum response factor regulates a mucle-specific microRNA that targets Hand2 during cardiogenesis” NATURE, NATURE PUBLISHING GROUP, LONDON, GB LNKD-DOI: 10.1038/NATURE03817, vol. 436, nº 7048, 1 de julio de 2005, páginas 214 – 220, describe la función de miR-1 en células musculares y corazones. Se muestra que miR-1-1 se expresa específicamente en células precursoras de músculo cardíaco y esquelético y que los genes de miR-1 son dianas transcripcionales directas de reguladores de diferenciación de músculo que incluyen efector de la respuesta a suero, MyoD y Mif2. Se sugiere que los genes de miR-1 valoran los efectos de proteínas reguladoras cardíacas críticas para controlar el equilibrio entre la diferenciación y la proliferación durante la cardiogénesis. Sin embargo, no se ha descrito una combinación con miR
133.
Sin embargo, queda una necesidad que se sentía desde hace tiempo y continua en la materia para la caracterización de la función o funciones de miARN en procesos biológicos. La materia presentemente desvelada trata esta y otras necesidades en la materia.
RESUMEN
Este resumen enumera varias realizaciones de la materia presentemente desvelada, y en muchos casos enumera variaciones y permutaciones de estas realizaciones. Este resumen es simplemente a modo de ejemplo de las numerosas y variadas realizaciones. La mención de una o más características representativas de una realización dada es asimismo a modo de ejemplo. Una realización dada puede normalmente existir con o sin la (s) característica (s) mencionada (s) ; asimismo, aquellas características pueden aplicarse a otras realizaciones de la materia presentemente desvelada, si se enumeran en este resumen o no. Para evitar repetición excesiva, este resumen no enumera o sugiere todas las posibles combinaciones de tales características.
En una realización de la materia presentemente desvelada se proporcionan agentes para su uso en un procedimiento para tratar una lesión muscular en un sujeto. Específicamente, miARN-133 y un inhibidor de miARN-1 se administran en combinación al sitio de lesión muscular en un primer momento de tiempo y un miARN-1 y un inhibidor de miARN-133 se administran en combinación al sitio de lesión muscular en un segundo momento de tiempo para así tratar la lesión muscular. En algunas realizaciones, la lesión muscular resulta de un traumatismo muscular mecánico, un trastorno degenerativo muscular, una lesión cardíaca o una combinación de los mismos. En algunas realizaciones, el sujeto es un mamífero.
En otra realización de la materia presentemente desvelada se proporciona un procedimiento in vitro para modular la diferenciación, proliferación de miocitos, o ambas. En algunas realizaciones, el procedimiento comprende poner en contacto un miocito con miARN (y un inhibidor de miR-133 o con miR133 y un inhibidor de miR1 o un vector que codifica dichos miARN elegidos como diana para un gen en el miocito que pueden modular la diferenciación, proliferación de miocitos, o ambas. En algunas realizaciones, la modulación es inhibidora y en algunas realizaciones el miARN inhibe la traducción del gen.
En todavía otra realización se proporciona una cantidad eficaz de un inhibidor de miR-1 y miR-133 o de miR1 y un inhibidor de miR-133 para tratar una lesión muscular.
En algunas realizaciones de los procedimientos desvelados en este documento, el miARN empleado comprende una secuencia de nucleótidos seleccionada del grupo que consiste en SEQ ID Nº: 1 y 2 y secuencias al menos el 70 % idénticas a cualquiera de SEQ ID Nº: 1 y 2. El miARN se selecciona de miR-1 y miR-133. Además, en algunas realizaciones, el miARN es elegido como diana para una región sin traducir de 3' del gen.
Además, en algunas realizaciones de los procedimientos, el gen elegido como diana por miARN se selecciona del grupo que consiste en un gen de diferenciación de miocitos (por ejemplo, un gen que codifica un polipéptido de histona desacetilasa 4 (HDAC4) o una proteína de receptor de la hormona tiroidea 240 (TRAP240) ) , un gen de proliferación de miocitos (por ejemplo, un gen que codifica un polipéptido de factor de respuesta a suero (SRF) ) y una proteína relacionada con la hormona (por ejemplo, un gen que codifica hormona tiroidea asociada a la proteína 1 (Thrap1) ) .
También se proporcionan vectores que codifican dichos miARN. En algunas realizaciones, el vector comprende un promotor operativamente ligado a una molécula de ácido nucleico que codifica la molécula de miARN; y una secuencia de terminación de la transcripción. Además, en algunas realizaciones, el vector se incorpora en un kit que comprende además al menos un reactivo para introducir el vector en un miocito. El kit, en algunas realizaciones, comprende además instrucciones para introducir el vector en un miocito.
Por consiguiente, es un objeto de la materia presentemente desvelada proporcionar agentes para su uso en un procedimiento para manipular la expresión génica en un miocito usando un enfoque mediado por miARN. Este objeto se logra por completo o en parte por la materia presentemente desvelada.
Un objeto de la materia presentemente desvelada que se ha establecido anteriormente, otros objetos y ventajas serán evidentes para aquellos expertos en la materia después de un estudio de la siguiente descripción de la materia presentemente desvelada y ejemplos no limitantes. Los datos con referencia a otros miARN sólo se proporcionan para motivos comparativos.
BREVE DESCRIPCIÓN DE LOS DIBUJOS
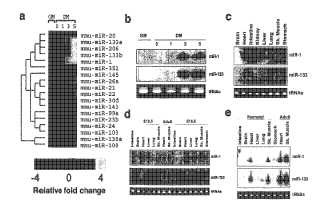
Las Figuras 1a-1e representan datos para la expresión de miR-1 y miR-133 en músculo cardíaco y esquelético durante el desarrollo.
La Figura 1a muestra datos de la expresión de matrices de miARN de mioblastos C2C12 cultivados en medio de crecimiento (MC) o en medio de diferenciación (MD) durante 0, 1, 3 y 5 días, respectivamente. Los datos logarítmicos normalizados (base 2) se agruparon jerárquicamente por gen y se representan como un mapa de calor. El intervalo de señal fue de -4 veces a + 4 veces. Amarillo denota alta expresión y azul denota baja expresión, con respecto a la mediana, y sólo se muestran los nodos de miARN que están regulados por incremento en el medio de diferenciación.
La Figura 1b representa un análisis de transferencia Northern de la expresión de miR-1 y miR-133 usando ARN total aislado de mioblastos C2C12 cultivados en MC o en MD durante 0, 1, 3 y 5 días, respectivamente. Los ARNt se usaron como control de carga.
La Figura 1c representa un análisis de transferencia Northern de la expresión de miR-1 y miR-133 en tejidos de ratón adulto.
La Figura 1d representa un análisis de transferencia Northern de la expresión de miR-1 y miR-133 en tejidos de ratón del día embrionario 13, 5 (E13, 5) y 16, 5 (E16, 5) .
La Figura 1e representa un análisis de transferencia Northern de la expresión de miR-1 y miR-133 en tejidos de ratón neonato. La misma cantidad de ARN totales de músculo cardíaco y esquelético adulto se cargaron en transferencias para servir de una comparación con ARN embrionario y neonato (Figuras 1d y 1e) .
Las Figuras 2a-2j representan datos que muestran la regulación de la proliferación y diferenciación de mioblastos por miR-1 y miR-133. Los mioblastos C2C12 cultivados en medio de crecimiento (MC) se electroporaron con dúplex de miARN bicatenario para miR-1, miR-133 y GFP como control.
Reivindicaciones:
1. Una cantidad eficaz de miR-1, un inhibidor de miR-1, miR-133 y un inhibidor de miR-133 para su uso en un procedimiento para tratar una lesión muscular en un sujeto, preferentemente un mamífero, en la que miR-133 y un inhibidor de miR-1 se administran en combinación al sitio de lesión muscular en un primer momento de tiempo y miR-1 y un inhibidor de miR-133 se administran en combinación al sitio de lesión muscular en un segundo momento de tiempo.
2. La cantidad eficaz de miR-1, un inhibidor de miR-1, miR-133 y un inhibidor de miR-133 para su uso según la reivindicación 1, en la que la lesión muscular resulta de un traumatismo muscular mecánico, un trastorno degenerativo muscular, una lesión cardíaca, o una combinación de los mismos.
3. La cantidad eficaz de miR-1, un inhibidor de miR-1, miR-133 y un inhibidor de miR-133 para su uso según la reivindicación 1, en la que miR-1 comprende una secuencia de nucleótidos de SEQ ID Nº: 1 o una secuencia al menos el 70 % idéntica a SEQ ID Nº: 1.
4. La cantidad eficaz de miR-1, un inhibidor de miR-1, miR-133 y un inhibidor de miR-133 para su uso según la reivindicación 1, en la que miR-133 comprende una secuencia de nucleótidos de SEQ ID Nº: 2 o una secuencia al menos el 70 % idéntica a SEQ ID Nº: 2.
5. La cantidad eficaz de miR-1, un inhibidor de miR-1, miR-133 y un inhibidor de miR-133 para su uso según la reivindicación 1, en la que el inhibidor de miR-1 es un polinucleótido modificado que comprende una secuencia de nucleótidos que es al menos el 70 % complementaria a miR-1.
6.
2. O-metil-miR-1 (SEQ ID Nº: 62) .
7. La cantidad eficaz de miR-1, un inhibidor de miR-1, miR-133 y un inhibidor de miR-133 para su uso según la reivindicación 1, en la que el inhibidor de miR-133 es un polinucleótido modificado que comprende una secuencia de nucleótidos que es al menos el 70 % complementaria a miR-133.
8.
2. O-metil-miR-133 (SEQ ID Nº: 63) .
9. La cantidad eficaz de miR-1, un inhibidor de miR-1, miR-133 y un inhibidor de miR-133 para su uso según la reivindicación 1, en la que miR-1 y/o miR-133 están codificados por un vector.
10. La cantidad eficaz de miR-1, un inhibidor de miR-1, miR-133 y un inhibidor de miR-133 para su uso según la reivindicación 1, en la que el vector comprende:
(a) un promotor operativamente ligado a una molécula de ácido nucleico que codifica miR-1 y/o miR-133; y
(b) una secuencia de terminación de la transcripción.
11. Una cantidad eficaz de un inhibidor de miR-1 y miR-133 para su uso en un procedimiento para tratar una lesión muscular en un sujeto, preferentemente un mamífero, en la que dicho miR-133 y dicho inhibidor de miR-1 aumentan la proliferación de miocitos cuando se administran en combinación a un sitio de lesión muscular.
12. Una cantidad eficaz de miR-1 y un inhibidor de miR-133 para su uso en un procedimiento para tratar una lesión muscular en un sujeto, preferentemente un mamífero, en la que dicho miR-1 y dicho inhibidor de miR-133 aumentan la diferenciación de miocitos cuando se administran en combinación a un sitio de lesión muscular.
13. Un procedimiento in vitro para aumentar la diferenciación de miocitos que comprende poner en contacto un miocito con miR-1 y un inhibidor de miR-133.
14. El procedimiento in vitro según la reivindicación 13, en el que miR-1 comprende una secuencia de nucleótidos de SEQ ID Nº: 1 o una secuencia al menos el 70 % idéntica a SEQ ID Nº: 1.
15. Un procedimiento in vitro para aumentar la proliferación de miocitos que comprende poner en contacto un miocito con miR-133 y un inhibidor de miR-1.
16. El procedimiento in vitro según la reivindicación 15, en el que miR-133 comprende una secuencia de nucleótidos de SEQ ID Nº: 2 o una secuencia al menos el 70 % idéntica a SEQ ID Nº: 2.
17. El procedimiento in vitro según la reivindicación 13 o la reivindicación 15, en el que miR-1 o miR-133 están codificados por un vector.
Patentes similares o relacionadas:
 Composición y método para la reparación y regeneración del músculo, del 29 de Julio de 2020, de THOMAS JEFFERSON UNIVERSITY: Un agonista de receptor gamma de ácido retinoico (RARγ) para uso en la reparación o regeneración del músculo en un sujeto, en el que el uso comprende […]
Composición y método para la reparación y regeneración del músculo, del 29 de Julio de 2020, de THOMAS JEFFERSON UNIVERSITY: Un agonista de receptor gamma de ácido retinoico (RARγ) para uso en la reparación o regeneración del músculo en un sujeto, en el que el uso comprende […]
Antagonistas del receptor p2x7 derivados de N-[2-(4-fenoxipiperidin-1-il)-2-(1,3-tiazol-5-il)etil]benzamida y N-[2-(4-benciloxipiperidin-1-il)-2-(1,3-tiazol-5-il)etil]benzamida sustituidas, del 15 de Julio de 2020, de AXXAM S.P.A: Un compuesto de la siguiente fórmula (I) o una sal farmacéuticamente aceptable del mismo: **(Ver fórmula)** incluyendo cualquier forma estereoquímicamente […]
Preparaciones de hidrogel térmico reversible para su uso en el tratamiento de trastornos del urotelio, del 15 de Julio de 2020, de UroGen Pharma Ltd: Una composición de hidrogel termorreversible mucoadhesiva biocompatible que incorpora toxina botulínica y que comprende al menos un agente de gelificación […]
Ácido nucleico antisentido, del 24 de Junio de 2020, de NIPPON SHINYAKU CO., LTD.: Un oligómero antisentido de 14 a 32 bases de longitud, que comprende dos unidades de oligómeros conectadas seleccionadas del grupo que consiste […]
Compuestos de diaminopirimidilo sustituidos, composiciones de los mismos y procedimientos de tratamiento con ellos, del 17 de Junio de 2020, de SIGNAL PHARMACEUTICALS LLC: Un compuesto de fórmula (I): **(Ver fórmula)** o una sal, un tautómero, un isotopólogo o un estereoisómero farmacéuticamente aceptable […]
Tratamiento de glucogenosis de tipo II, del 20 de Mayo de 2020, de DUKE UNIVERSITY: α-Glucosidasa ácida (GAA) humana recombinante producida en un cultivo de células de ovario de hámster chino para uso en un método de tratamiento de glucogenosis […]
Análogos de ácido siálico, del 20 de Mayo de 2020, de Ultragenyx Pharmaceutical Inc: Un compuesto que tiene la fórmula estructural (Ia): **(Ver fórmula)** o una sal o solvato farmacéuticamente aceptable del mismo; en la que: R2, R4 y R6 son independientemente […]
Compuestos y composiciones para inhibir la actividad de SHP2, del 29 de Abril de 2020, de NOVARTIS AG: Un compuesto de formula I: **(Ver fórmula)** en que: Y1 se selecciona de N y CR7; en el que R7 se selecciona de hidrogeno, halo y amino; Y2 se selecciona […]