Método para la síntesis de dienogest a partir de 3-metiléter de estrona.
Un método para la síntesis de dienogest a partir de 3-metoxi-estra-1,
3,5-trien-17-ona, que comprende las etapas de:
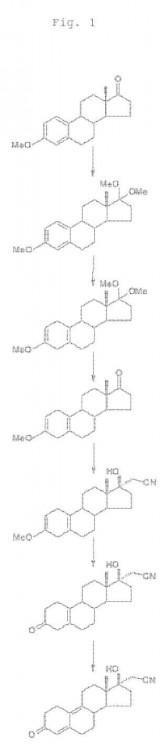
- a) hacer reaccionar 3-metoxi-estra-1,3,5-trien-17-ona con alcohol en presencia de un ácido en un solvente orgánico para formar 3-metoxi-17,17-5 dialcoxi-estra-1,3,5-trieno;
- b) someter el producto de la etapa a) a una reducción parcial mediante la reacción con un metal alcalino en amoniaco líquido para formar 3-metoxi-17,17-dialcoxi-estra-2,5(10)-dieno;
- c) tratar el producto de la etapa b) con un ácido suave para formar 3-metoxi-estra-2,5(10)-dien-17-ona;
- d) hacer reaccionar el producto de la etapa c) con cianometil-litio para formar 3-metoxi-17α-cianometil-17ß- hidroxi-estra-2,5(10)-dieno;
- e) tratar el producto de la etapa d) con ácido oxálico para formar 17α -cianometil-17ß-hidroxi-estra-5(10)-en-3- ona;
- f) tratar el producto de la etapa e) con tribromuro de piridinio en piridina y aislar dienogest como el producto.
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E09075237.
Solicitante: HEYL Chemisch-Pharmazeutische Fabrik GmbH und Co. KG.
Nacionalidad solicitante: Alemania.
Dirección: Goerzallee 253 14167 Berlin ALEMANIA.
Inventor/es: WERNER, MICHAEL, Döhler,Thomas, Walther,Dirk-Detlef.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07J1/00 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07J ESTEROIDES (seco-steroides C07C). › Esteroides normales que contienen carbono, hidrógeno, halógeno u oxígeno no sustituidos en posición 17 beta por un átomo de carbono, p. ej. estrano, androstano.
- C07J41/00 C07J […] › Esteroides normales que contienen uno o más átomos de nitrógeno que no pertenecen a un heterociclo.
PDF original: ES-2378604_T3.pdf
Fragmento de la descripción:
Método para la síntesis de dienogest a partir de 3-metiléter de estrona"
La presente invención se refiere a la síntesis de 17a-cianometil-17º-hidroxi-estra-4, 9-dien-3-ona (fórmula I, en lo que sigue "dienogest") , a partir de 3-metoxi-estra-1, 3, 5-trien-17-ona (EME, fórmula II) .
OH
Fórmula II: 3-metoxi-estra-1, 3, 5-trien-17-ona, metiléter de estrona, EME [0002] El dienogest se utiliza principalmente como anticonceptivo en combinación con etinilestradiol.
[0003] DD132497, DD275247, W02007/066158 y EP1935898 describen métodos de síntesis para obtener dienogest. [0004] Las rutas de síntesis conocidas en el arte tienen desventajas, tales como un alto número de etapas de síntesis, comprenden reacciones de difícil realización en escala aumentada, tal como la oxidación de Oppenauer, o el uso de reactivos indeseables, tales como cianuro, oxidantes de cromo o cerio.
[0005] Es el objetivo de la presente invención, proporcionar una forma novedosa y económica para obtener dienogest con alta pureza, a partir del material de partida barato y fácilmente disponible, 3-metiléter de estrona (EME, la fórmula II) .
Este objetivo se logra mediante el método de la presente invención. [0007] De acuerdo con una realización de la presente invención, se obtiene dienogest a partir de EME mediante una 25 síntesis que comprende las etapas de: a) hacer reaccionar EME con alcohol en presencia de un ácido en un solvente orgánico para formar 3-metoxi17, 17-dialcoxi-estra-1, 3, 5-trieno; b) someter el producto de la etapa a) a una reducción parcial mediante la reacción con un metal alcalino en amoniaco líquido para formar 3 - metoxi-17, 17-dialcoxi-estra-2, 5 (10) -dieno;
c) tratar el producto de la etapa b) con un ácido suave para formar 3-metoxi-estra-2, 5 (10) -dien-17-ona; d) hacer reaccionar el producto de la etapa c) con cianometil-litio; e) tratar el producto de la etapa d) con ácido oxálico; f) tratar el producto de la etapa e) con tribromuro de piridinio en piridina y aislar dienogest como el producto.
De acuerdo con una realización de la presente invención, el alcohol de la etapa a) es un alcohol alquílico no ramificado, que comprende preferentemente uno a tres átomos de carbono, preferentemente etanol o metanol, lo más preferentemente metanol. La reacción puede comprender la formación de un ortoformiato de metilo.
De acuerdo con otra realización de la presente invención, la reducción parcial del anillo A esteroide de la etapa b) se lleva a cabo a una temperatura entre - 80 º C y temperatura ambiente, preferentemente entre - 70 y - 35 grados centígrados, más preferentemente entre - 50 y - 60 grados, lo más preferentemente a -55 grados centígrados. Los metales preferidos son sodio o litio, el más preferido es litio.
De acuerdo con otra realización de la presente invención, la reducción parcial del anillo A esteroide de la etapa b) se lleva a cabo en un solvente no prótico polar, por ejemplo éteres alifáticos, alicíclicos, y un solvente prótico, preferentemente alcoholes, especialmente preferentemente isopropanol . El alcohol se agrega a la solución del metal alcalino, y la reacción se termina apagando con el mismo u otro alcohol.
De acuerdo con aún otra realización de la presente invención, la etapa b) comprende las etapas de proporcionar amoníaco líquido en un recipiente bajo enfriamiento, agregar litio y esperar hasta la aparición de un color azul; luego agregar el componente esteroide formado en la etapa a) en un solvente orgánico, preferentemente usando una mezcla de tetrahidrofurano (THF) e isopropanol (i-PrOH) como solvente. Alternativamente, de acuerdo con aún otra realización, dicho componente esteroide y el amoníaco pueden proporcionarse, en un solvente orgánico, bajo enfriamiento y el litio puede agregarse subsecuentemente.
De acuerdo con aún otra realización de la presente invención, el producto intermedio resultante de la reacción de reducción de Birch de la etapa b) se apaga con alcohol para proporcionar 3, 17, 17-trialcoxi-estra-2, 5 (10) -dien17-ona.
De acuerdo con aún otra realización de la presente invención, el ácido suave utilizado en la etapa c) es un ácido mineral diluido o un ácido orgánico débil. Se prefiere ácido acético diluido con agua.
De acuerdo con aún otra realización de la presente invención, se emplea n-butil-litio en la formación del cianometil-litio de la etapa d) . En general, el cianometil-litio puede ser generado in situ mediante la desprotonación de acetonitrilo utilizando una base fuerte tal como alquil-litio, donde el alquilo puede ser C1-C6, hexametildisililazida de litio (LiHMDS) o amidas de litio, por ejemplo diisopropilamida de litio (LDA) o 2, 2, 6, 6-tetrametilpiperidida de litio (LiTMP) . Se prefiere la LDA.
De acuerdo con aún otra realización, la reacción de cianometilación de la etapa d) se realiza a una temperatura entre 0 grados y - 80 grados, preferentemente entre - 20 grados y - 60 grados y lo más preferentemente a - 40 grados centígrados. Se prefiere una realización en la cual se agrega una solución del esteroide en un éter alifático o alicíclico, preferentemente THF, a una solución de cianometil-litio. Alternativamente, puede agregarse una solución de cianometil-litio a una solución del esteroide. De acuerdo con una realización, se utilizan 1 a 4 equivalentes de cianometil-litio, preferentemente 3 equivalentes. La reacción puede terminarse apagando con agua o alcohol.
De acuerdo con aún otra realización de la presente invención, la reacción de la etapa f) se puede llevar a cabo en un solvente alcalino, preferentemente piridina, a una temperatura menor, preferentemente entre 0 º C y 5 º C, agregando la solución del reactivo oxidante a la solución del esteroide. Típicamente, el tiempo de reacción se encuentra entre 15 minutos y 6 horas, preferentemente 30 minutos. El proceso se caracteriza por la deshidrohalogenación del bromuro intermedio formado in situ seguido por la elaboración final con ácido, preferentemente utilizando ácido sulfúrico.
De acuerdo con aún otra realización de la presente invención, el método para proporcionar dienogest puede comprender las etapas de aislación y purificación del producto intermedio. Estas etapas de aislación y purificación pueden emplearse después de cualquiera de las reacciones individuales de formación del cetal, la reducción del anillo A del esteroide para formar el 2, 5 (10) dieno, la reconstitución de la 17-ona mediante tratamiento con un ácido suave, la cianometilación, la reconstitución del 3-carbonilo y / o el tratamiento con el complejo de bromopiridina.
De acuerdo con aún otra realización de la presente invención, el producto dienogest crudo del método proporcionado por ésta se somete a una etapa de purificación adicional mediante al menos un procedimiento del grupo formado por recristalización y cromatografía.
De acuerdo con aún otra realización de la presente invención, la mezcla de solventes empleada en la etapa de cromatografía, que puede agregarse para obtener el producto final purificado, hace uso de una fase líquida que comprende varios, preferentemente tres y por lo menos dos, componentes en diferentes proporciones. Uno de los componentes es un solvente no polar, por ejemplo un hidrocarburo aromático, alifático o cicloalifático. También pueden emplearse hidrocarburos hetero-sustituidos, tales como hidrocarburos halogenados. Solventes no polares preferidos son tolueno o ciclohexano, especialmente diclorometano. Componentes polares preferidos de la mezcla son alcoholes, tales como metanol y etanol, ésteres y cetonas, preferentemente acetato de etilo, acetona, como asi también acetales, por ejemplo dimetilacetal de la acetona, dimetilacetal del formaldehído. En particular se prefiere 2propanol.
La relación entre componentes polares y no polares puede variar entre 50:50 y 1:99, preferentemente entre 65:98 y 85:96, y con especial preferencia 5:95.
De acuerdo con aún otra realización de la presente invención, pueden emplearse otros materiales de partida que no sean el 3 metil éter de estrona. La posición 3 puede ser funcionalizada mediante alquilo ramificado o no ramificado, bencilo, o puede ser esterificada, por ejemplo, mediante acetato.
De acuerdo con una realización preferida de la presente invención, la reacción de cianometilación de la etapa d) puede realizarse a temperatura ambiente o elevada durante entre... [Seguir leyendo]
Reivindicaciones:
1. Un método para la síntesis de dienogest a partir de 3-metoxi-estra-1, 3, 5-trien-17-ona, que comprende las etapas de: a) hacer reaccionar 3-metoxi-estra-1, 3, 5-trien-17-ona con alcohol en presencia de un ácido en un solvente 5 orgánico para formar 3-metoxi-17, 17-dialcoxi-estra-1, 3, 5-trieno; b) someter el producto de la etapa a) a una reducción parcial mediante la reacción con un metal alcalino en amoniaco líquido para formar 3-metoxi-17, 17-dialcoxi-estra-2, 5 (10) -dieno; c) tratar el producto de la etapa b) con un ácido suave para formar 3-metoxi-estra-2, 5 (10) -dien-17-ona; d) hacer reaccionar el producto de la etapa c) con cianometil-litio para formar 3-metoxi-17a-cianometil-1710 hidroxi-estra-2, 5 (10) -dieno; e) tratar el producto de la etapa d) con ácido oxálico para formar 17a -cianometil-17 º-hidroxi-estra-5 (10) -en-3ºna;
f) tratar el producto de la etapa e) con tribromuro de piridinio en piridina y aislar dienogest como el producto.
3. El método de acuerdo con al menos una de las reivindicaciones 1 y 2, que comprende someter el producto dienogest a una etapa de purificación adicional mediante al menos una etapa del grupo formado por recristalización y cromatografía. 5. El método de acuerdo con al menos una de las reivindicaciones anteriores, donde el metal alcalino de la etapa b) es litio. 15 2. El método según la reivindicación 1, que comprende aislar y purificar el producto intermedio después de una o más etapas del grupo formado por la etapa a) , la etapa b) , la etapa c) , la etapa d) y la etapa e) .
20 4. El método de acuerdo con al menos una de las reivindicaciones anteriores, donde el alcohol de la etapa a) es metanol, proporcionando como producto de la etapa a) 3, 17, 17-trimetoxi-estra-1, 3, 5-trieno.
Patentes similares o relacionadas:
Derivados de ácidos biliares como agonistas FXR/TGR5, del 1 de Julio de 2020, de ENANTA PHARMACEUTICALS, INC: Un compuesto representado por la Formula I, o una sal o ester aceptable farmaceuticamente de este: **(Ver fórmula)** en donde: Ra es hidrogeno o -C1-C8 alquilo […]
Composiciones y métodos para el tratamiento de trastornos del SNC, del 26 de Febrero de 2020, de Sage Therapeutics, Inc: Compuesto de fórmula (II): **(Ver fórmula)** o una sal farmacéuticamente aceptable de los mismos. en la que: el anillo A es arilo […]
Derivados de colano para su uso en el tratamiento y/o prevención de enfermedades mediadas por FXR y TGR5/GPBAR1, del 4 de Diciembre de 2019, de Bar Pharmaceuticals S.r.l: Un compuesto seleccionado del grupo que consiste en:**Fórmula**
Materiales de hidrogel que incorporan un compuesto de elución de ceragenina, del 22 de Octubre de 2019, de BRIGHAM YOUNG UNIVERSITY: Un dispositivo médico que comprende un material de hidrogel de elución de ceragenina, el dispositivo médico comprendiendo un polímero de […]
Formas de sales polimórficas y amorfas de dilactato de escualamina, del 15 de Octubre de 2019, de Enterin, Inc: Forma amorfa de la sal de dilactato de 38-(N-[3-aminopropil]-1,4-butanodiamina)-7a,24R-dihidroxi-5a-colestano-24- sulfato, donde un patrón de difracción del […]
3alfa-etinil, 3beta-hidroxi-5alfa-pregnan-20-oxima para usar en el tratamiento de trastornos del SNC, del 2 de Octubre de 2019, de Umecrine Cognition AB: 3α-etinil, 3β-hidroxi, 5α-pregnan-20-oxima o una de sus sales farmacéuticamente aceptables. Una formulación farmacéutica que comprende un compuesto como […]
Compuestos anfifílicos con propiedades neuroprotectoras, del 2 de Octubre de 2019, de Ustav Organicke Chemie a Biochemie AV CR, v.v.i: Compuesto anfifílico, seleccionado de: 3-sulfato de piridinio(3R,5R,8S,9S,10 S,13S,14S)-10,13-dimetilhexadecahidro-1H-ciclopenta[a]fenantren-3- […]
 Inhibidores de SHIP y uso de los mismos, del 31 de Julio de 2019, de THE RESEARCH FOUNDATION OF THE STATE UNIVERSITY OF NEW YORK: Una composición farmacéutica que comprende:
un compuesto inhibidor de SHIP de fórmula (I), o una sal farmacéuticamente aceptable del […]
Inhibidores de SHIP y uso de los mismos, del 31 de Julio de 2019, de THE RESEARCH FOUNDATION OF THE STATE UNIVERSITY OF NEW YORK: Una composición farmacéutica que comprende:
un compuesto inhibidor de SHIP de fórmula (I), o una sal farmacéuticamente aceptable del […]