Método para aumentar la producción de compuestos isoprenoides.
Método para producir un isoprenoide o precursor de isoprenoide a través de la ruta del mevalonato en Escherichia coli,
comprendiendo el método:
(i) cultivar en un medio adecuado una célula de E. coli modificada genéticamente para producir hidroximetilglutaril-CoA (HMG-CoA) sintasa (HMGS) heteróloga y HMG-CoA reductasa (HMGR) heteróloga, y en el que la célula de E. coli modificada genéticamente se modifica genéticamente adicionalmente para producir una o más enzimas heterólogas adicionales de la ruta del mevalonato seleccionadas entre:
(a) una acetoacetil-CoA tiolasa;
(b) una mevalonato quinasa;
(c) una fosfomevalonato quinasa; y
(d) una mevalonato pirofosfato descarboxilasa; en el que en ausencia de dicha HMGR heteróloga, los niveles de HMG-CoA producidos en la célula son tóxicos para la célula, y en el que el nivel de actividad relativo de la HMGR producida en la célula de E. coli modificada genéticamente es superior al nivel de actividad relativo de la HMGS producida en la célula de E. coli modificada genéticamente, de manera que el nivel de HMG-CoA presente en la célula no es tóxico para dicha célula y/o no inhibe sustancialmente el crecimiento celular; y
(ii) recuperar el isoprenoide o precursor de isoprenoide producido.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2005/017874.
Solicitante: THE REGENTS OF THE UNIVERSITY OF CALIFORNIA.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 12TH FLOOR 1111 FRANKLIN STREET OAKLAND, CA 94607-5200 ESTADOS UNIDOS DE AMERICA.
Inventor/es: KEASLING,Jay D, NEWMAN,Jack D, PITERA,Douglas J.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07H21/04 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07H AZUCARES; SUS DERIVADOS; NUCLEOSIDOS; NUCLEOTIDOS; ACIDOS NUCLEICOS (derivados de ácidos aldónicos o sacáricos C07C, C07D; ácidos aldónicos, ácidos sacáricos C07C 59/105, C07C 59/285; cianohidrinas C07C 255/16; glicales C07D; compuestos de constitución indeterminada C07G; polisacáridos, sus derivados C08B; ADN o ARN concerniente a la ingeniería genética, vectores, p. ej. plásmidos o su aislamiento, preparación o purificación C12N 15/00; industria del azúcar C13). › C07H 21/00 Compuestos que contienen al menos dos unidades mononucleótido que tienen cada una grupos fosfato o polifosfato distintos unidos a los radicales sacárido de los grupos nucleósido, p. ej. ácidos nucleicos. › con desoxirribosilo como radical sacárido.
- C12N1/21 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 1/00 Microorganismos, p.ej. protozoos; Composiciones que los contienen (preparaciones de uso médico que contienen material de protozoos, bacterias o virus A61K 35/66, de algas A61K 36/02, de hongos A61K 36/06; preparación de composiciones de uso médico que contienen antígenos o anticuerpos bacterianos, p. ej. vacunas bacterianas, A61K 39/00 ); Procesos de cultivo o conservación de microorganismos, o de composiciones que los contienen; Procesos de preparación o aislamiento de una composición que contiene un microorganismo; Sus medios de cultivo. › modificados por la introducción de material genético extraño.
- C12N15/74 C12N […] › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Vectores o sistemas de expresión especialmente adaptados a huéspedes procariotas distintos a E. coli, p. ej. Lactobacillus, Micromonospora.
- C12N9/04 C12N […] › C12N 9/00 Enzimas, p. ej. ligasas (6.); Proenzimas; Composiciones que las contienen (preparaciones para la limpieza de los dientes que contienen enzimas A61K 8/66, A61Q 11/00; preparaciones de uso médico que contienen enzimas A61K 38/43; composiciones detergentes que contienen enzimas C11D ); Procesos para preparar, activar, inhibir, separar o purificar enzimas. › actúan sobre grupos CHOH como dadores, p. ej. glucosa oxidasa de glucosa, deshidrogenasa láctica (1.1).
- C12N9/12 C12N 9/00 […] › transfieren grupos que contienen fósforo, p. ej. Quinasas (2.7).
- C12N9/90 C12N 9/00 […] › Isomerasas (5.).
- C12P21/02 C12 […] › C12P PROCESOS DE FERMENTACION O PROCESOS QUE UTILIZAN ENZIMAS PARA LA SINTESIS DE UN COMPUESTO QUIMICO DADO O DE UNA COMPOSICION DADA, O PARA LA SEPARACION DE ISOMEROS OPTICOS A PARTIR DE UNA MEZCLA RACEMICA. › C12P 21/00 Preparación de péptidos o de proteínas (proteína monocelular C12N 1/00). › que tienen una secuencia conocida de varios aminoácidos, p. ej. glutation.
- C12P23/00 C12P […] › Preparación de compuestos que contienen un ciclo ciclohexeno con una cadena lateral insaturada de al menos diez átomos de carbono unidos por enlaces dobles conjugados, p. ej. carotenos (que contienen heterociclos C12P 17/00).
PDF original: ES-2379368_T3.pdf
Fragmento de la descripción:
Método para aumentar la producción de compuestos isoprenoides
CAMPO DE LA INVENCIÓN
La presente invención pertenece al campo de la producción de compuestos isoprenoides, y en particular, a células huésped que son modificadas genéticamente para producir compuestos isoprenoides.
ANTECEDENTES DE LA INVENCIÓN
Los isoprenoides constituyen un grupo extremadamente amplio y diverso de productos naturales que tienen un origen biosintético común, es decir, un único precursor metabólico, isopentenil difosfato (IPP) . Se han descrito por lo menos 20.000 isoprenoide. Por definición, los isoprenoides están formados de las denominadas unidades de isopreno (C5) . El número de átomos de C presentes en los isoprenoides es normalmente divisible por cinco (C5, C10, C15, C20, C25, C30 y C40) , aunque se han descrito isoprenoides irregulares y politerpenos. Los compuestos isoprenoides también se refieren como "terpenos" o "terpenoides". Los miembros importantes de los isoprenoides incluyen carotenoides, sesquiterpenoides, diterpenoides, y hemiterpenos. Los carotenoides incluyen, por ejemplo, licopeno, 1-caroteno, y similares, muchos de los cuales actúan como antioxidantes. Los sesquiterpenoides incluyen, por ejemplo, artemisinina, un compuesto que tiene material contra la malaria. Los diterpenoides incluyen, por ejemplo, taxol, un agente quimioterapéutico contra el cáncer.
Los isoprenoides comprenden la familia más numerosa y estructuralmente diversa de productos naturales. En esta familia, los terpenoides aislados de plantas y otras fuentes naturales se utilizan como compuestos de aromas y fragancias comerciales, así como fármacos contra la malaria y el cáncer. Una mayoría de los compuestos terpenoides que se utilizan actualmente son productos naturales o sus derivados. Los organismos de origen (por ejemplo, árboles, invertebrados marinos) de muchos de estos productos naturales no son susceptibles de un cultivo a gran escala necesario para producir cantidades comercialmente viables ni de manipulación genética para una mayor producción o derivatización de estos compuestos. Por lo tanto, los productos naturales deben producirse semisintéticamente a partir de análogos o sintéticamente utilizando síntesis química convencional. Además, muchos productos naturales presentan estructuras complejas y, como resultado, son actualmente caros o imposibles de sintetizar. Dichos productos naturales deben extraerse de sus fuentes nativas, tales como árboles, esponjas, corales y microbios marinos; o producirse sintéticamente o semisintéticamente a partir de precursores abundantes. La extracción de un producto natural a partir de una fuente nativa está limitada por la disponibilidad de la fuente nativa; y la producción sintética o semisintética de productos naturales puede sufrir un rendimiento bajo y/o un coste elevado. Dichos problemas de producción y disponibilidad limitada de la fuente natural pueden limitar el desarrollo comercial y clínico de dichos productos.
La biosíntesis de productos naturales de isoprenoides en microbios modificados podría aprovechar el potencial comercial y terapéutico sin explotar de estos recursos naturales y producir productos de química fina y farmacéuticos menos caros y más ampliamente disponibles. Un obstáculo en cuestión para la biosíntesis de terpenoides a nivel elevado es la producción de precursores de terpenos. Los estudios previos han demostrado que, cuando se expresa en E. coli, la ruta de mevalonato proporciona la producción de isopentenil pirofosfato (IPP) , que se puede isomerizar y polimerizar en isoprenoides y terpenos de valor comercial. La redirección óptima de metabolismo microbiano hacia la producción de isoprenoides requiere que la ruta biosintética introducida se modifique correctamente para canalizar eficientemente el carbono al IPP y no permitir la formación de intermedios que pueden ser tóxicos. De hecho, se ha observado que la expresión de enzimas que producen mevalonato puede inhibir el crecimiento celular y limitar la productividad de cultivos microbianos. Se sugirió que la inhibición del crecimiento descrita previamente tras la expresión de la ruta de mevalonato en ausencia de una IPP isomerasa, FPP sintasa, y terpeno sintasa conducía a la acumulación de niveles tóxicos de IPP.
Existe la necesidad en la técnica por células huésped mejoradas productoras de isoprenoides o precursores de isoprenoides que proporcionen un crecimiento robusto de células huésped y una producción a nivel elevado de compuestos isoprenoides, así como precursores de poliprenil difosfato de dichos compuestos. La presente invención se refiere a esta necesidad y proporciona ventajas relacionadas.
Literatura [0006] Publicación de patente de Estados Unidos No. 2004/005678; Publicación de patente de Estados Unidos No. 2003/0148479; Martin et al. (2003) Nat. Biotech. 21 (7) :796-802; Polakowski et al. (1998) Appl. Microbiol. Biotechnol.
49: 67-71; Wilding et al. (2000) J Bacteriol 182 (15) : 4319-27; Publicación de patente de Estados Unidos No. 2004/0194162; Donald et al. (1997) Appl. Env. Microbiol. 63:3341-3344; Jackson et al (2003) Organ. Lett. 5:16291632; Publicación de patente de Estados Unidos No. 2004/0072323; Publicación de patente de Estados Unidos No. 2004/0029239; Publicación de patente de Estados Unidos No. 2004/0110259; Publicación de patente de Estados Unidos No. 2004/0063182; Patente de Estados Unidos No. 5, 460, 949; Publicación de patente de Estados Unidos No. 2004/0077039; Patente de Estados Unidos No. 6, 531, 303; Patente de Estados Unidos No. 6, 689, 593; Hamano et al. (2001) Biosci. Biotechnol. Biochem. 65:1627-1635; T. Kuzuyama. (2004) Biosci. Biotechnol. Biochem. 68 (4) : 931-934; T. Kazuhiko. (2004) Biotechnology Letters. 26: 1487-1491; Brock et al (2004) Eur J. Biochem. 271: 32273241; Choi, et al (1999) Appl. Environ. Microbio. 65 4363-4368; Parke et al., (2004) Appl. Environ. Microbio. 70: 2974-2983; Subrahmanyam et al (1998) J. Bact. 180: 4596-4602; Murli et al. (2003) J. Ind. Microbiol. Biotechnol. 30: 500-509; Publicación de patente de Estados Unidos No. 2003/0148416; Publicación de Patente Internacional No. WO 2005/033287.
DESCRIPCIÓN RESUMIDA DE LA INVENCIÓN
La presente invención proporciona un método para producir un isoprenoide o precursor de isoprenoide a través de un mecanismo de mevalonato en Escherichia coli, comprendiendo el método:
(i) cultivar en un medio adecuado una célula de E. coli modificada genéticamente para producir hidroximetilglutaril-CoA (HMG-CoA) sintasa (HMGS) heteróloga y HMG-CoA reductasa (HMGR) heteróloga, y donde la célula de E. coli modificada genéticamente se modifica adicionalmente genéticamente para producir una o más enzimas de la ruta del mevalonato heterólogas adicionales seleccionadas entre:
(a) una acetoacetil-CoA tiolasa;
(b) una mevalonato quinasa;
(c) una fosfomevalonato quinasa; y
(d) una mevalonato pirofosfato descarboxilasa;
en el que en ausencia de dicha HMGR heteróloga, los niveles de HMG-CoA producidos en la célula son tóxicos para la célula, y en el que el nivel de actividad relativa de la HMGR producida en la célula de E. coli modificada genéticamente es superior al nivel de actividad relativa de la HMGS producida en la célula de E. coli modificada genéticamente, de manera que el nivel de HMG-CoA presente en la célula no es tóxica para dicha célula y/o no inhibe sustancialmente el crecimiento celular; y (ii) recuperar el isoprenoide o precursor de isoprenoide producido.
La presente invención proporciona además una célula huésped modificada genéticamente que produce un isoprenoide o precursor de isoprenoide, en la que la célula huésped modificada genéticamente es una célula huésped procariota que no produce normalmente isopentenil pirofosfato a través de un mecanismo de mevalonato, en la que la célula huésped modificada genéticamente se modifica genéticamente para producir hidroximetilglutaril-CoA (HMG-CoA) sintasa (HMGS) heteróloga y HMG-CoA reductasa (HMGR) heteróloga, en el que la célula huésped modificada se modifica adicionalmente genéticamente para producir una o más enzimas de la ruta del mevalonato heterólogas adicionales seleccionadas entre:
(a) una acetoacetil-CoA tiolasa;
(b) una mevalonato quinasa;
(c) una fosfomevalonato quinasa; y
(d) una mevalonato pirofosfato descarboxilasa;
en la que en ausencia de dicha HMGR heteróloga, los niveles de HMG-CoA producidos en la célula son tóxicos para la célula, y en el que el nivel de actividad relativa de la HMGR producida en la célula huésped modificada genéticamente... [Seguir leyendo]
Reivindicaciones:
1. Método para producir un isoprenoide o precursor de isoprenoide a través de la ruta del mevalonato en Escherichia coli, comprendiendo el método:
(i) cultivar en un medio adecuado una célula de E. coli modificada genéticamente para producir hidroximetilglutaril-CoA (HMG-CoA) sintasa (HMGS) heteróloga y HMG-CoA reductasa (HMGR) heteróloga, y en el que la célula de E. coli modificada genéticamente se modifica genéticamente adicionalmente para producir una o más enzimas heterólogas adicionales de la ruta del mevalonato seleccionadas entre:
(a) una acetoacetil-CoA tiolasa;
(b) una mevalonato quinasa;
(c) una fosfomevalonato quinasa; y
(d) una mevalonato pirofosfato descarboxilasa; en el que en ausencia de dicha HMGR heteróloga, los niveles de HMG-CoA producidos en la célula son tóxicos para la célula, y en el que el nivel de actividad relativo de la HMGR producida en la célula de E. coli modificada genéticamente es superior al nivel de actividad relativo de la HMGS producida en la célula de E. coli modificada genéticamente, de manera que el nivel de HMG-CoA presente en la célula no es tóxico para dicha célula y/o no inhibe sustancialmente el crecimiento celular; y
(ii) recuperar el isoprenoide o precursor de isoprenoide producido.
2. Método según la reivindicación 1, en el que la acetoacetil-CoA tiolasa es heteróloga a la célula de E. coli modificada genéticamente.
3. Método según la reivindicación 1, en el que la célula de E. coli modificada genéticamente comprende una o más copias de un ácido nucleico heterólogo que comprende una secuencia de nucleótidos que codifica la HMGR.
4. Método según la reivindicación 1, en el que la célula de E. coli modificada genéticamente comprende un ácido nucleico heterólogo que comprende una secuencia de nucleótidos que codifica la HMGS.
5. Método según la reivindicación 4, en el que dicha célula de E. coli modificada comprende un plásmido con un número de copias bajo que comprende una secuencia de polinucleótidos que codifica HMGS.
6. Método según la reivindicación 1, en el que la célula de E. coli modificada genéticamente comprende un ácido nucleico heterólogo que ha sustituido el gen de HMGS heterólogo, y en el que dicho ácido nucleico heterólogo tiene un nivel de actividad inferior al del gen de HMGS endógeno.
7. Método según la reivindicación 1, en el que la célula de E. coli modificada genéticamente comprende un constructo de expresión que comprende una versión modificada de las secuencias de nucleótidos establecidas en SEQ ID NO: 1 en que el sitio de unión a ribosoma en dirección 5' con respecto a HMGS ha sido alterado, de manera que se reduce la traducción en comparación con una E. coli en que la SEQ ID NO: 1 no está alterada.
8. Método según la reivindicación 1, en el que la E. coli modificada comprende vectores que codifican HMGR y HMGS, en el que las regiones codificantes de HMGR y HMGS están bajo el control de diferentes promotores.
9. Célula huésped modificada genéticamente que produce un isoprenoide o precursor de isoprenoide, en la que la célula huésped modificada genéticamente es una célula huésped procariota que no produce normalmente isopentenil pirofosfato a través de la ruta del mevalonato, en la que la célula huésped modificada genéticamente está modificada genéticamente para producir hidroximetilglutaril-CoA (HMG-CoA) sintasa (HMGS) heteróloga y HMG-CoA reductasa (HMGR) heteróloga, en la que la célula huésped modificada genéticamente está modificada adicionalmente genéticamente para producir una o más enzimas heterólogas adicionales de la ruta del mevalonato seleccionadas entre:
(a) una acetoacetil-CoA tiolasa;
(b) una mevalonato quinasa;
(c) una fosfomevalonato quinasa; y
(d) una mevalonato pirofosfato descarboxilasa; en la que en ausencia de dicha HMGR heteróloga, los niveles de HMG-CoA producidos en la célula son tóxicos para la célula, y en la que el nivel de actividad relativo de la HMGR producida en la célula huésped modificada genéticamente es superior al nivel de actividad relativo de la HMGS producida en la célula huésped modificada genéticamente, de manera que el nivel de HMG-CoA presente en la célula no es tóxico para dicha célula y/o no inhibe sustancialmente el crecimiento celular
10. Célula huésped modificada genéticamente según la reivindicación 9, en la que la célula huésped es una cepa de Escherichia coli.
11. Célula huésped modificada genéticamente según la reivindicación 9, en la que la acetoacetil-CoA tiolasa es heteróloga a la célula huésped modificada genéticamente.
12. Célula huésped modificada genéticamente según la reivindicación 9, en la que la célula huésped modificada genéticamente comprende una o más copias de un ácido nucleico heterólogo que comprende una secuencia de nucleótidos que codifica la HMGR.
13. Célula huésped modificada genéticamente según la reivindicación 9, en la que dicha célula huésped modificada comprende un plásmido con un número bajo de copias que comprende una secuencia de polinucleótidos que codifica HMGS.
14. Célula huésped modificada genéticamente según la reivindicación 9, en la que dicha célula huésped modificada comprende un ácido nucleico heterólogo que ha sustituido el gen de HMGS heterólogo, y en la que dicho ácido nucleico heterólogo tiene un nivel de actividad inferior al del gen de HMGS endógeno 15. Célula huésped modificada genéticamente según la reivindicación 9, en la que dicha célula huésped modificada comprende un constructo de expresión que comprende una versión modificada de las secuencias de nucleótidos establecidas en SEQ ID NO: 1 en que el sitio de unión a ribosoma en dirección 5' con respecto a HMGS ha sido alterado, de manera que se reduce la traducción en comparación con una E. coli en que la SEQ ID NO: 1 no está alterada.
16. Célula huésped modificada genéticamente según la reivindicación 9, en la que dicha célula huésped modificada comprende vectores que codifican HMGR y HMGS, en la que las regiones codificantes de HMGR y HMGS están bajo el control de diferentes promotores.
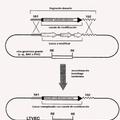
FIG.10
Patentes similares o relacionadas:
Sistema de expresión bacteriano cistrónico doble, del 25 de Marzo de 2020, de LUPIN LIMITED: Un procedimiento para la producción de un anticuerpo o un fragmento del mismo que comprende las etapas de: (i) transformar una célula hospedadora bacteriana […]
Partículas de transducción no replicativas y sistemas indicadores basados en partículas de transducción, del 15 de Enero de 2020, de Geneweave Biosciences Inc: Un sistema de empaquetamiento de células bacterianas para empaquetar una molécula de ácido nucleico indicadora en una partícula de transducción no replicativa (NRTP) para su introducción […]
Método de construcción de biblioteca de péptidos y vectores relacionados, del 1 de Enero de 2020, de Hunan Zonsen Peplib Biotech Co., Ltd: Método integrado de construcción de una biblioteca de péptidos completa que contiene todos los péptidos posibles para el tamaño específico, comprendiendo el método: (i) […]
 Producción recombinante de péptidos, del 25 de Septiembre de 2019, de BASF SE: Proteina precursora que comprende una secuencia repetitiva escindible de elementos de peptido (Pep) deseados y elementos de peptido auxiliar […]
Producción recombinante de péptidos, del 25 de Septiembre de 2019, de BASF SE: Proteina precursora que comprende una secuencia repetitiva escindible de elementos de peptido (Pep) deseados y elementos de peptido auxiliar […]
Transporte de proteínas basado en bacterias, del 14 de Agosto de 2019, de Universität Basel: Un vector que comprende, en la dirección 5' a 3': un promotor; una primera secuencia de ADN que codifica una señal de transporte procedente […]
Sistema de expresión y secreción, del 26 de Junio de 2019, de F. HOFFMANN-LA ROCHE AG: Una molécula de ácido nucleico que codifica un primer polipéptido y un segundo polipéptido, enlazada de forma funcional a una secuencia señal que codifica […]
 Producción de anticuerpos híbridos que contienen regiones variables humanas y regiones constantes de roedor, del 26 de Junio de 2019, de REGENERON PHARMACEUTICALS, INC.: Un procedimiento para modificar genéticamente un locus génico endógeno de la región variable de cadena pesada de inmunoglobulina en una célula madre embrionaria (ES) de […]
Producción de anticuerpos híbridos que contienen regiones variables humanas y regiones constantes de roedor, del 26 de Junio de 2019, de REGENERON PHARMACEUTICALS, INC.: Un procedimiento para modificar genéticamente un locus génico endógeno de la región variable de cadena pesada de inmunoglobulina en una célula madre embrionaria (ES) de […]
Síntesis microbiana de aldehídos y alcoholes correspondientes, del 17 de Junio de 2019, de Easel Biotechnologies, LLC: Un método para producir un alcohol, que comprende: cultivar una pluralidad de células microbianas en un medio de fermentación, en donde las […]