Inmunoensayos que muestran reactividad cruzada reducida con metabolitos de analito de fármacos hidrófobos.
Un inmunoensayo para evaluar la cantidad de un analito de interés en una muestra de ensayo,
en el que el analito es un fármaco hidrófobo que se metaboliza para formar uno o más metabolitos de reacción cruzada, comprendiendo el inmunoensayo las etapas de:
(a) poner en contacto la muestra de ensayo con uno o más reactivos de pretratamiento para formar una primera mezcla, en la que dichos uno o más reactivos de pretratamiento lisan cualquiera de las células y solubilizan cualquier analito presente en la muestra de ensayo;
(b) poner en contacto la primera mezcla con un anticuerpo específico para el analito para formar una segunda mezcla que comprende un complejo del anticuerpo con analito o metabolito;
(c) lavar la segunda mezcla para retirar cualquier analito y cualquier metabolito que no haya formado complejo con el anticuerpo y para formar una tercera mezcla en la que la concentración de analito disminuye dentro de un orden de magnitud, es decir, un punto decimal de la constante de disociación de equilibrio (KD)
del anticuerpo para el analito;
(d) poner en contacto la tercera muestra con un compañero de unión específico del anticuerpo marcado con un marcador detectable ("indicador") para formar una cuarta mezcla que comprende un complejo del anticuerpo con el indicador ("complejo anticuerpo-indicador");
(e) lavar la cuarta mezcla para retirar cualquier indicador que no haya formado complejo con el anticuerpo; y
(f) detectar el complejo anticuerpo-indicador como una medida de la cantidad de analito presente en la muestra, en el que el inmunoensayo tiene menos de un 10% de reactividad cruzada con uno cualquiera o más metabolitos de reacción cruzada presentes en la muestra.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2008/064688.
Solicitante: ABBOTT LABORATORIES.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 100 ABBOTT PARK ROAD ABBOTT PARK, ILLINOIS 60064 ESTADOS UNIDOS DE AMERICA.
Inventor/es: BRATE, ELAINE, M., SPRING, THOMAS, G., FINLEY,David M, HOLETS-MCCORMACK,Shelley R, PACENTI,David P, PIKTEL,Ryan E, SHIELDS,Michelle, WANG,Philip P.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- G01N33/543 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › con un soporte insoluble para la inmovilización de compuestos inmunoquímicos.
- G01N33/94 G01N 33/00 […] › en los que intervienen narcóticos.
PDF original: ES-2377167_T3.pdf
Fragmento de la descripción:
Inmunoensayos que muestran reactividad cruzada reducida con metabolitos de analito de fármacos hidrófobos
5 Campo técnico
La presente divulgación se refiere a inmunoensayos que muestran reactividad cruzada reducida con metabolitos de analito. Entre otras cosas, la divulgación se refiere a inmunoensayos de diagnóstico para determinar la concentración o nivel, en una muestra de ensayo, de un fármaco hidrófobo que metaboliza in vivo o in vitro para formar metabolitos de reacción cruzada, en los que se reduce la reactividad cruzada con estos metabolitos del analito del fármaco. En particular, la divulgación se refiere a estos inmunoensayos en los que el fármaco hidrófobo es un inmunosupresor.
Antecedentes
Los fármacos inmunosupresores tales como sirolimus (también conocido como rapamicina) , tacrolimus (también conocido como FK506) , y ciclosporina ("CsA") son eficaces para el tratamiento del rechazo de órganos o tejidos después de una cirugía de trasplante, de enfermedad de injerto contra hospedador y de enfermedades autoinmunes en humanos. Durante la terapia con fármacos inmunosupresores, es un aspecto importante del cuidado clínico controlar los niveles de concentración en sangre de los inmunosupresores porque niveles insuficientes de fármaco conducen al rechazo del injerto (órgano o tejido) y niveles excesivos conducen a efectos secundarios indeseados y toxicidad. Por ejemplo, el tacrolimus exhibe algo de toxicidad similar a la de la CsA, que incluye nefrotoxicidad, complicaciones del tracto intestinal y neurotoxicidad. (Véase, Murthy, J.N., et al., Clinical Biochemistr y , 31 (8) :613617 (1998) ) . Por lo tanto, se miden los niveles en sangre de inmunosupresores de tal manera que las dosis puedan ajustarse para mantener el nivel de fármaco a la concentración apropiada. Los ensayos de diagnóstico para la determinación de los niveles en sangre de inmunosupresores han encontrado de esta manera un uso clínico amplio.
Tacrolimus es el nombre genérico para un inmunosupresor macrólido producido por la bacteria Streptomyces tsukabaensis, en el suelo (véase, lnamura, N., et al., Transplantation, 45 (1) :206-209 (1988) ) . El Tacrolimus se ha usado por vía intravenosa y por vía oral para la prevención de rechazo de órganos, particularmente en pacientes que reciben trasplantes de hígado, riñón o médula ósea.
La ciclosporina es un fármaco inmunosupresor a partir de hongos del suelo (Tolypocladium inflatum) . Aunque principalmente se usaban para prevenir el rechazo de órganos después de un trasplante, la CsA también se ha usado para tratar otras enfermedades tales como anemia aplásica, o para prevenir la enfermedad de injerto contra hospedador. El modo de acción de la CsA es bloquear la activación de los linfocitos T impidiendo la transcripción del gen de IL-2.
El tacrolimus tiene una potencia in vivo 50-100 veces mayor que la ciclosporina CsA (véase, Murthy, J.N., et al., supra (1998) ) . El efecto inmunosupresor del tacrolimus es similar al de la CsA y se cree que es a través de la inhibición selectiva de la generación de linfocitos T citotóxicos. Id.
Otros fármacos inmunosupresores incluyen sirolimus, everolimus, temsorolimus, zotarolimus y ácido micofenólico.
45 La diana principal de sirolimus, everolimus (RAD-001) , temsorolimus y zotarolimus es mTOR (diana de la rapamicina en mamíferos) , una proteína específica reguladora del ciclo celular, cuya inhibición conduce a la supresión de la proliferación linfocitos T dirigida por citocinas. El everolimus se usa como un inmunosupresor para prevenir el rechazo de órganos transplantados y como fármaco supresor del cáncer. La contra-indicación en el uso de everolimus es un cierto aumento en los niveles de colesterol y, por lo tanto, un incremento en el riesgo cardiovascular.
El micofenolato de mofetilo (MMF) es un éster derivado del ácido micofenólico (AMF) y está aprobado como un fármaco inmunosupresor en pacientes de trasplantes renales. El profármaco MMF se transforma rápidamente in vivo en el inmunosupresor activo AMF, que inhibe la inosina monofosfato deshidrogenasa 2. Por lo tanto, el MMD elimina 55 la síntesis de novo de nucleótidos de guanosina, especialmente en linfocitos T y B, y detiene su proliferación.
Una diversidad de diferentes inmunoensayos de diagnóstico están disponibles en el mercado para controlar las concentraciones sanguíneas de fármacos inmunosupresores. Aunque los inmunoensayos están disponibles en varios formatos, todos usan la unión de un anticuerpo o proteína de unión (por ejemplo FKBP) al fármaco inmunosupresor. Un inmunoensayo de la técnica anterior que se usa comúnmente es un ensayo que implica la unión de un primer anticuerpo al fármaco inmunosupresor y la unión de un inmunosupresor marcado (por ejemplo, sirolimus o tacrolimus acridinilado) a los sitios de unión de anticuerpo libres restantes, seguido de la cuantificación a través de la detección del marcador de acridinio.
65 Varios de estos inmunoensayos usan disolventes orgánicos para extraer el tacrolimus de las muestras de sangre entera. El disolvente orgánico aumenta la constante de disociación de equilibrio (KD) y/o disminuye la actividad funcional del anticuerpo que se usa en los ensayos. La actividad reducida del anticuerpo conduce a una menor sensibilidad del ensayo y potencialmente reduce la precisión y solidez. De esta manera, la eficacia de estos inmunoensayos se ve afectada por el disolvente particular para la extracción y la desnaturalización para el inmunosupresor que se usa.
Igualmente, la generación in vivo de metabolitos para el fármaco inmunosupresor puede repercutir en los resultados del ensayo. La bibliografía actual sugiere que la generación de metabolitos M17 de CsA (también conocidos como AM1) y M1 (también conocidos como AM9) pueden enmascarar la concentración de fármaco precursor activo (CsA) . Se sabe que el tacrolimus y el sirolimus forman metabolitos in vivo. Los metabolitos principales de primera generación de tacrolimus son tacrolimus 13-O-desmetilado ("M-l") , tacrolimus 31-O-desmetilado ("M-ll") , y tacrolimus 15-O-desmetilado ("M-lll") .
El inmunoensayo para la determinación de AMF en suero (por ejemplo, después del tratamiento con MMF) produce resultados que son mayores que los obtenidos con los métodos de HPLC. Se cree que esto es debido a la reactividad cruzada de los metabolitos de AMF con los anticuerpos monoclonales. El AMF se metaboliza principalmente a un derivado de glucurónido (MPAG) , que se cree que es inactivo. Recientemente, se han identificado otros dos metabolitos de AMF, incluyendo el acil glucurónido de AMF.
No hace falta decir que la dosificación adecuada del fármaco inmunosupresor es crítica para pacientes de trasplante de órganos y necesita medirse de manera exacta y reproducible en presencia de metabolitos.
El documento EP 0 487 289 A, en nombre de Syntex INC, describe un inmunoensayo para medir la cantidad de ciclosporina en una muestra, poniendo en contacto dicha muestra con ciclosporina conjugada con un marcador y con anticuerpos capaces de unirse al conjugado de ciclosporina-marcador y midiendo la cantidad de conjugado de ciclosporina-marcador unido a los anticuerpos.
En Emeruwa A.C. et al., Canadian Journal of Microbiology, vol. 16, nº 10, 1970, páginas 917-921, se desvela un ensayo de anticuerpo fluorescente, para identificar cepas de C. Botulinum, en el que se prepararon conjugados de inmunoglobulina-isotiocianato de fluoresceína y se diluyeron para eliminar la tinción no específica y la reactividad cruzada con serotipos relacionados. Rajkowski K.M et al., Advances in Steroid Analysis '90, Proc. of the 4th Symposium on the Analysis on Steroids, Pecs, Hungar y , April 24-26, 1990, S. Gorog ed., proporciona una demostración de que los efectos de las interferencias de la reactividad cruzada en un inmunoensayo pueden incrementarse mediante la dilución las muestras biológicas, en contra de la práctica de dilución de las muestras biológicas para reducir el problema de las interferencias por los reactivos cruzados.
Por lo tanto, en la técnica existe la necesidad de nuevos inmunoensayos que proporcionen medidas exactas de analitos de los fármacos, por ejemplo, inmunosupresores en presencia de sus metabolitos de reacción cruzada. Es un objetivo de la divulgación proporcionar dichos inmunoensayos. Es un objetivo adicional proporcionar inmunoensayos que, de manera óptima, eviten los problemas que acompañan a la modificación de la composición del reactivo de extracción al generar... [Seguir leyendo]
Reivindicaciones:
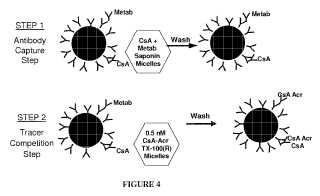
1. Un inmunoensayo para evaluar la cantidad de un analito de interés en una muestra de ensayo, en el que el analito es un fármaco hidrófobo que se metaboliza para formar uno o más metabolitos de reacción cruzada, comprendiendo 5 el inmunoensayo las etapas de:
(a) poner en contacto la muestra de ensayo con uno o más reactivos de pretratamiento para formar una primera mezcla, en la que dichos uno o más reactivos de pretratamiento lisan cualquiera de las células y solubilizan cualquier analito presente en la muestra de ensayo;
(b) poner en contacto la primera mezcla con un anticuerpo específico para el analito para formar una segunda mezcla que comprende un complejo del anticuerpo con analito o metabolito;
(c) lavar la segunda mezcla para retirar cualquier analito y cualquier metabolito que no haya formado complejo con el anticuerpo y para formar una tercera mezcla en la que la concentración de analito disminuye dentro de un orden de magnitud, es decir, un punto decimal de la constante de disociación de equilibrio (KD)
del anticuerpo para el analito;
(d) poner en contacto la tercera muestra con un compañero de unión específico del anticuerpo marcado con un marcador detectable ("indicador") para formar una cuarta mezcla que comprende un complejo del anticuerpo con el indicador ("complejo anticuerpo-indicador") ;
(e) lavar la cuarta mezcla para retirar cualquier indicador que no haya formado complejo con el anticuerpo; y
(f) detectar el complejo anticuerpo-indicador como una medida de la cantidad de analito presente en la muestra, en el que el inmunoensayo tiene menos de un 10% de reactividad cruzada con uno cualquiera o más metabolitos de reacción cruzada presentes en la muestra.
2. El inmunoensayo de la reivindicación 1, en el que el inmunoensayo tiene menos de un 5% de reactividad cruzada 25 con uno cualquiera o más metabolitos de reacción cruzada presentes en la muestra.
3. El inmunoensayo de la reivindicación 1, en el que el anticuerpo especifico para el analito se inmoviliza en una fase sólida.
4. El inmunoensayo de la reivindicación 1, en el que dichos uno o más de los reactivos de pretratamiento precipita en la etapa (a) cualquier proteína de unión a analito presente en la muestra.
5. El inmunoensayo de la reivindicación 4, que además comprende retirar cualquier proteína de unión a analito de la primera mezcla. 35
6. El inmunoensayo de la reivindicación 1, en el que la cantidad de anticuerpo en la etapa (b) está entre el 0, 1 % y el 10% de la cantidad de analito en la muestra de ensayo.
7. El inmunoensayo de la reivindicación 1, en el que las concentraciones de analito y metabolito disminuyen en la 40 tercera mezcla en la etapa (c) de 10 veces a 500 veces comparado con la muestra de ensayo.
8. El inmunoensayo de la reivindicación 1, en el que en la etapa (d) la cantidad de analito presente en un complejo con anticuerpo varía de 1, 0 a 10, 0 nM, y el indicador está presente en una cantidad de entre 0, 1 y 1, 0 nM.
45 9. El inmunoensayo de la reivindicación 1, en el que la muestra de ensayo es sangre entera.
10. El inmunoensayo de la reivindicación 1, en el que el fármaco hidrófobo es un inmunosupresor seleccionado entre el grupo que consiste en tacrolimus, sirolimus y ciclosporina.
50 11. El inmunoensayo de la reivindicación 10, en el que (a) el inmunosupresor es tacrolimus y el metabolito se selecciona entre el grupo que consiste en M-I, M-II, M-Ill y combinaciones de los mismos;
(b) el inmunosupresor es ciclosporina y el metabolito se selecciona entre el grupo que consiste en M1, M8, 55 M9, M13, M17, M18, M21 y combinaciones de los mismos; o (c) el inmunosupresor es sirolimus y el metabolito se selecciona entre el grupo que consiste en 11-hidroxisirolimus.
4. O-desmetil-sirolimus, 7-O-desmetil-sirolimus.
4. O-desmetil-hidroxi-sirolimus y combinaciones de los mismos.
60 12. El inmunoensayo de cualquiera de las reivindicaciones 1 a 10, en el que dichos uno o más reactivos de pretratamiento comprenden saponina, metanol, etilenglicol, y sulfato de cinc.
13. El inmunoensayo de cualquiera de las reivindicaciones 1 a 10, en el que la segunda mezcla además comprende un diluyente de ensayo. 65
14. El inmunoensayo de la reivindicación 13, en el que el diluyente de ensayo además comprende un tampón, sal, detergente, disolvente o combinaciones de los mismos.
15. El inmunoensayo de cualquiera de las reivindicaciones 1 a 10, en el que la cuarta mezcla en la etapa (d) además 5 comprende un detergente.
16. El inmunoensayo de la reivindicación 15, en el que el detergente es Triton® X-100 reducido.
17. El inmunoensayo de cualquiera de las reivindicaciones 1 a 10, en el que el analito es ciclosporina y el indicador 10 comprende ciclosporina marcada con acridinio.
18. El inmunoensayo de cualquiera de las reivindicaciones 1 a 10, en el que el anticuerpo en la etapa (b) tiene una KD para el metabolito de reacción cruzada que es entre 10 veces y 1000 veces mayor que para el analito.
19. El inmunoensayo de cualquiera de las reivindicaciones 1 a 10, que además comprende:
(i) incubar la primera mezcla en la etapa (a) durante un primer período de incubación;
(ii) incubar la segunda muestra en la etapa (b) durante un segundo período de incubación; y
(iii) incubar la cuarta mezcla de la etapa (d) durante un tercer período de incubación. 20
20. El inmunoensayo de la reivindicación 19, en el que:
(i) el primer período de incubación comprende un período de 2 minutos a 60 minutos; o (ii) el segundo período de incubación comprende un período de 2 minutos a 30 minutos; o 25 (iii) el tercer período de incubación comprende un período de 2 minutos a 30 minutos.
Patentes similares o relacionadas:
Método de determinación de la presencia y/o cantidad de moléculas diana, del 22 de Julio de 2020, de Canopy Biosciences, LLC: Método para el análisis de células individuales en una muestra de sangre mediante la determinación de la presencia y/o cantidad de una o más moléculas […]
Kit de reactivos utilizado para detectar gastrina-17 y método de preparación y aplicación para el kit de reactivos, del 15 de Julio de 2020, de Shenzhen New Industries Biomedical Engineering Co., Ltd: Un kit para detectar gastrina-17, caracterizado porque comprende un componente A y un componente B, en donde el componente A es un primer […]
Un sustrato para inmovilizar sustancias funcionales y un método para preparar las mismas, del 15 de Julio de 2020, de Temasek Polytechnic: Un sustrato sólido que tiene compuestos dispuestos sobre el mismo, en donde se inmoviliza una molécula funcional sobre los compuestos, teniendo cada compuesto una cadena que […]
Análisis biológico autónomo de alta densidad, del 1 de Julio de 2020, de BioFire Diagnostics, LLC: Recipiente para realizar reacciones de amplificación en un sistema cerrado que comprende una porción flexible que tiene una serie de blísteres […]
Chip de análisis y aparato de análisis de muestras, del 1 de Julio de 2020, de Takano Co., Ltd: Un chip de análisis que comprende: un sustrato conformado sustancialmente en forma de disco; un puerto de inyección formado […]
Dispositivo para la detección de analitos, del 1 de Julio de 2020, de TECHLAB, INC.: Un dispositivo para detectar por lo menos una sustancia de interés en una muestra líquida, comprendiendo el dispositivo: (a) una unidad que […]
Estructuras para controlar la interacción de luz con dispositivos microfluídicos, del 3 de Junio de 2020, de Opko Diagnostics, LLC: Un sistema de ensayo múltiplex que comprende: un artículo que soporta ensayos en fase sólida, comprendiendo dicho artículo un sustrato plano rígido y comprendiendo […]
Uso de un estándar para la detección de agregados de proteínas de una enfermedad por plegamiento incorrecto de proteínas, del 27 de Mayo de 2020, de FORSCHUNGSZENTRUM JULICH GMBH: Uso de un estándar, que comprende una nanopartícula inorgánica con un tamaño de 2 a 200 nm, en cuya superficie ya sea mediante i) ácido carboxílico-espaciador-maleimida […]