Formulación líquida estable de hormonas de crecimiento.
Una formulación que comprende una cantidad terapéuticamente eficaz de hormona de crecimiento en solución acuosa,
un tampón que mantiene el pH de la formulación a un pH de aproximadamente 5 a aproximadamente 7, un tensioactivo no iónico, un polímero estabilizante, metionina y opcionalmente que comprende además uno o más excipientes seleccionados de entre el grupo que consiste en: un catión divalente presente en una sal de magnesio seleccionada de entre el grupo que consiste en hidróxido de magnesio, cloruro de magnesio, sulfato de magnesio, citrato de magnesio y edetato de magnesio; un agente tonificante; y un conservante, en la que la formulación permanece estable después de al menos un episodio de congelación y descongelación posterior; en la que dicho polímero estabilizante se selecciona de entre el grupo que consiste en polietilenglicol y derivados de polietilenglicol.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/IB2004/004159.
Solicitante: PHARMACIA CORPORATION.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 100 ROUTE 206 NORTH PEAPACK, NJ 07977 ESTADOS UNIDOS DE AMERICA.
Inventor/es: NEMA, SANDEEP, BADKAR,Advait, WADHWA,Manpreet.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K38/27 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Hormona de crecimiento [GH] (Somatotropina).
- A61K47/00 A61K […] › Preparaciones medicinales caracterizadas por los ingredientes no activos utilizados, p. ej. portadores o aditivos inertes; Agentes de direccionamiento o agentes modificadores enlazados químicamente al ingrediente activo.
- A61K47/10 A61K […] › A61K 47/00 Preparaciones medicinales caracterizadas por los ingredientes no activos utilizados, p. ej. portadores o aditivos inertes; Agentes de direccionamiento o agentes modificadores enlazados químicamente al ingrediente activo. › Alcoholes; Fenoles; Sus sales, p. ej. glicerol; Polietilenglicoles [PEG]; Poloxámeros; Éteres alquílicos PEG/POE.
- A61K47/12 A61K 47/00 […] › Acidos carboxílicos; Sus sales o anhídridos.
- A61K47/26 A61K 47/00 […] › Hidratos de carbono, p. ej. alcoholes de azúcares, amino azúcares, ácidos nucleicos, mono-, di- u oligo-sacáridos; Sus derivados, p. ej. polisorbatos, ésteres de ácidos grasos sorbitano o glicirricina.
- A61K9/00 A61K […] › Preparaciones medicinales caracterizadas por un aspecto particular.
PDF original: ES-2383691_T3.pdf
Fragmento de la descripción:
Formulación liquida estable de hormonas de crecimiento Campo de la invención La presente invención se refiere a formulaciones líquidas estables de hormonas de crecimiento, tal como la hormona de crecimiento humana, particularmente, a dichas formulaciones que permanecen estables después de un almacenamiento de larga duración, y también permanecen estables después de someterse a esfuerzo físico tal como agitación, congelación y descongelación.
Antecedentes de la invención La hormona de crecimiento humana natural es una proteína con una sola cadena de polipéptido que contiene 191 aminoácidos, reticulados internamente por dos fuentes disulfuro. Las hormonas de crecimiento de otras especies animales son muy homólogas con la hormona de crecimiento humana natural, y tienen actividad biológica similar en cuanto a que son eficaces en el tratamiento de enfermedades relacionadas con las deficiencias de la hormona de crecimiento en seres humanos, tal como el enanismo hipofisiario y la osteoporosis. Se han producido también formas recombinantes de la hormona de crecimiento humana con la misma o sustancialmente similar secuencia de aminoácidos que la hormona de crecimiento humana natural e idéntica actividad biológica que la hormona natural. Excepto, que se indique de otra manera a continuación, todas las formas naturales y recombinantes de la hormona de crecimiento humana se denominan en conjunto "hGH". Debido a las similitudes estructurales entre hGH y las hormonas de crecimiento de otras especies, serían de esperar formulaciones que sean eficaces en la estabilización de hGH que también son eficaces en la estabilización de las hormonas de crecimiento de otras especies.
La hGH está comercializada principalmente en forma liofilizada hoy en día. Véase, por ejemplo, Polvo Liofilizado de GENOTROPINA® (Pharmacia & Upjohn Company, actualmente propiedad de Pfizer Inc.) , HUMATROPE® (Eli Lilly) , NORDITROPINA® para inyectables (Novo Nordisk) , SAIZEN® para inyectables (Serono) y NUTROPINA® (Genentech) . Las formulaciones liofilizadas tienen la ventaja de proporcionar estabilidad a las proteínas durante largos períodos. Sin embargo, una formulación liofilizada debe utilizarse poco después de la redisolución, a medida que la aglomeración y la desamidación tienden a comenzar poco después la redisolución con un diluyente acuoso. Esto significa generalmente que se deja hasta que el consumidor de una formulación liofilizada redisuelva el producto poco antes de su utilización. Si la redisolución no se hace de manera apropiada, o si la formulación redisuelta se guarda durante demasiado tiempo antes de su utilización, el consumidor puede tener una dosis inapropiada de la hormona de crecimiento o una dosis que contiene concentraciones inapropiadas de los productos de degradación de la hGH. Además, la preparación de las formulaciones liofilizadas implica sustancialmente mayor coste y tiempo con relación a la preparación de las formulaciones líquidas.
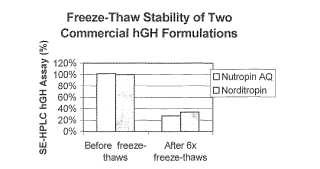
Debido a los inconvenientes anteriores con las formulaciones de hGH liofilizadas, varias formulaciones líquidas de hGH se han desarrollado durante los últimos años, cada una con grados variables de estabilidad en varias condiciones de almacenamiento y manipulación. Dos formulaciones comerciales líquidas de hGH se venden bajo las denominaciones de la marca comercial NUTROPINA AQ® (Genentech, Inc.) y NORDITROPINA® (Novo Nordisk) . La composición de éstas y otras formulaciones líquidas de hGH se ha dado a conocer en patentes publicadas y aplicaciones de patentes publicadas, resumidas a continuación. Cada una de las siguientes referencias pone de manifiesto que las formulaciones líquidas de las formulaciones de hGH descritas en la presente memoria son estables a las temperaturas de refrigeración, a aproximadamente 2ºC hasta aproximadamente 8ºC, excepto donde se indica de otra manera a continuación. Si embargo, ninguna reivindicación para dar a conocer formulaciones que puedan resistir la exposición a la congelación y descongelación, condiciones a las que los productos pueden exponerse en el trayecto. Por otra parte, la hGH en algunas de las formulaciones dadas a conocer anteriormente se degrada o experimenta aglomeración cuando se somete a agitación física, por ejemplo, durante el transporte. Estos tipos de inestabilidades no solamente originan desperdicio del producto costoso, sino que también puede dar lugar a problemas de seguridad si el producto degradado se administra involuntariamente a un paciente.
La patente de EE.UU. nº 5.567.677 (inventada por Castensson et al., ; transferida a PHARMACIA AB) da a conocer una formulación acuosa constituida por la hormona de crecimiento y el tampón de citrato en una cantidad de 2 a 50 mM a un pH de aproximadamente 5, 0 a 7, 0. La patente ‘677 también da a conocer que el manitol y la glicina pueden estar incluidos de manera adecuada en la formulación dada a conocer en la presente memoria.
Las patentes de EE.UU. nº 5.763.394 y nº 5.981.485 (inventada por O'Connor et al.; transferida a GENENTECH, INC.) da a conocer una formulación acuosa de la hormona de crecimiento humana que contiene hGH, un tampón que proporciona pH 5, 5 a pH 7 (p. ej., citrato sódico) , 0, 1% a 1% p/v de tensioactivo no iónico (p. ej., polisorbato 20) y, 50 a 200 mM de una sal neutra (p. ej., cloruro sódico) y un conservante (p. ej., fenol) , en la que dicha formulación está exenta de glicina y manitol.
La patente de EE. UU. nº 6.022.858 (inventada por Sorensen et al.; transferida a NOVO NORDISK A/S) , da a conocer una solución acuosa tamponada que contiene una hormona de crecimiento humana pretratada con sal de zinc, y que contiene opcionalmente lisina o ion calcio.
La patente de EE. UU. nº 5.849.704 (inventada por Sorensen et al.; transferida a NOVO NORDISK A/S) , da a conocer una solución acuosa tamponada que contiene una hormona de crecimiento tamponada con histidina y derivado de histidina.
La patente de EE. UU. nº 5.977.069, la patente de EE. UU: nº 5.631.225 y la patente de EE. UU. nº 5.547.696 (inventadas por Sorensen et al.; transferida a NOVO NORDISK A/S) , dan a conocer unas soluciones acuosas tamponadas que contienen una hormona de crecimiento humana con cantidades estabilizantes de los aminoácidos asparagina, isoleucina o valina, respectivamente.
La patente de EE.UU. nº 5.705.482 y la patente de EE.UU. nº 5.552.385 (inventadas por Christensen et al., transferidas a NOVO NORDISK A/S) , dan a conocer soluciones acuosas tamponadas que contienen una hormona de crecimiento humana con cantidades estabilizantes de los péptidos Leu-His-Leu y Lys-Gly-Asp-Ser respectivamente.
El documento WO 01/03741 A1 (para una invención de Siebold et al.; transferida a GRANDIS BIOTECH GMBH) da a conocer una "formulación líquida estable al almacenamiento de la hormona de crecimiento consistente esencialmente en hormona de crecimiento en solución isotónica tamponada con fosfato" y además reivindica formulaciones con tampón fosfato y un tensioactivo no iónico presente a una concentración de 0, 2% o inferior. En el apartado Ejemplos de la publicación, el único tensioactivo no iónico utilizado es Pluronic F-68 a una concentración de 0, 2% (p/v) en cada una de las formulaciones en las que se incluyó.
El documento WO 02/067989 A1 (para una invención de Siebold et al.; transferida a GRANDIS BIOTECH GMBH) se refiere a "una formulación acuosa de la hormona de crecimiento que comprende hormona de crecimiento y (a) tampón de citrato de pH aproximadamente 5, 6 o más, o (b) otro tampón aparte de citrato de pH aproximadamente 6, 0 o más, y sustancialmente exento de cristalización durante el almacenamiento". Las únicas temperaturas adecuadas durante el almacenamiento de las formulaciones descritas son la temperatura de refrigeración (4ºC a 8ºC) y superiores, o en un intervalo de temperaturas de 8ºC a 25ºC.
La publicación de la solicitud de EE.UU. nº 2002/0077461 (para una invención de Bjorn et al.; transferida a NOVO NORDISK OF NORTH AMERICA INC.) da a conocer formulaciones farmacéuticas que comprenden la hormona de crecimiento (p. ej., hGH) , un aminoácido seleccionado de entre el grupo consistente en asparagina, isoleucina, valina, leucina, histidina, un derivado de histidina o un péptido que comprende al menos un resto de aminoácido básico y al menos un resto de aminoácido básico, y un detergente no iónico (p. ej., un polisorbato o un poliaxámero) . La solicitud también da a conocer dichas formulaciones con un tampón (p. ej., histidina, citrato, tartrato o fosfato) para pH 6 a pH8, un agente tonificante (p. ej., manitol) , los únicos... [Seguir leyendo]
Reivindicaciones:
1. Una formulación que comprende una cantidad terapéuticamente eficaz de hormona de crecimiento en solución acuosa, un tampón que mantiene el pH de la formulación a un pH de aproximadamente 5 a aproximadamente 7, un tensioactivo no iónico, un polímero estabilizante, metionina y opcionalmente que comprende además uno o más excipientes seleccionados de entre el grupo que consiste en: un catión divalente presente en una sal de magnesio seleccionada de entre el grupo que consiste en hidróxido de magnesio, cloruro de magnesio, sulfato de magnesio, citrato de magnesio y edetato de magnesio; un agente tonificante; y un conservante, en la que la formulación permanece estable después de al menos un episodio de congelación y descongelación posterior; en la que dicho polímero estabilizante se selecciona de entre el grupo que consiste en polietilenglicol y derivados de polietilenglicol.
2. La formulación de la reivindicación 1, en la que la hormona de crecimiento humano es una forma recombinante de hormona de crecimiento humana.
3. La formulación de la reivindicación 2, en la que la hormona de crecimiento humano está presente en la formulación a una concentración de aproximadamente 0, 1 mg/ml a aproximadamente 20 mg/ml.
4. La formulación de la reivindicación 1, en la que el tampón se selecciona del grupo que consiste en: citrato sódico, edetato sódico, succinato sódico e hidrocloruro de histidina.
5. La formulación de la reivindicación 1, en la que el tensioactivo no iónico está presente a una concentración de aproximadamente 0, 2% a aproximadamente 10%.
6. La formulación de la reivindicación 1, en la que el tensioactivo no iónico es un polisorbato seleccionado de entre el grupo que consiste en polisorbato 20 y polisorbato 80.
7. La formulación de la reivindicación 1, en la que el polímero estabilizante está presente a una concentración de aproximadamente 0, 001% a aproximadamente 70%, de preferencia de aproximadamente 0, 05% a aproximadamente 5%.
8. La formulación de la reivindicación 1, en la que el polímero estabilizante es polietilenglicol que tiene un peso molecular comprendido en el intervalo de aproximadamente 3000 a aproximadamente 20.000.
9. La formulación de la reivindicación 1, en la que el agente tonificante es sorbitol.
10. La formulación de la reivindicación 1, en la que el conservante se selecciona de entre el grupo que consiste en fenol y alcohol bencílico.
11. Una formulación que comprende, aproximadamente de 0, 1 mg/ml a aproximadamente 20 mg/ml de una forma recombinante de hormona de crecimiento humana en solución acuosa, un tampón de citrato o edetato que mantiene la formulación a un pH de aproximadamente de 5 a aproximadamente 7, aproximadamente de 0, 04% a aproximadamente 5% (p/p) de un tensioactivo polisorbato, de aproximadamente 0, 01% a aproximadamente 20% (p/v) de polietilenglicol, metionina y opcionalmente que comprende además uno o más excipientes seleccionados de entre el grupo que consiste en: una concentración suficiente de sorbitol para la formulación que es aproximadamente isotónica, cloruro de magnesio o hidróxido de magnesio, un conservante en el que la formulación permanece estable después de al menos un episodio de congelación y descongelación.
12. La formulación de la reivindicación 11, en la que el conservante es fenol o alcohol bencílico.
13. La formulación de la reivindicación 11, en la que por lo menos aproximadamente el 90% de hGH permanece en solución tras la exposición de la formulación a tres o más episodios de congelación y descongelación.
14. La formulación de la reivindicación 11, en la que la formulación es estable de aproximadamente 2ºC a aproximadamente 8ºC durante al menos 52 semanas.
15. La formulación de la reivindicación 14, en la que después del almacenamiento durante 12 meses de aproximadamente 2ºC a aproximadamente 8ºC el aglomerado total medido por HPLC de exclusión por tamaños es inferior a aproximadamente 0, 5%, y/o la desaminación total medida por HPLC de intercambio aniónico es inferior a aproximadamente 7%, y/o la recuperación de la hGH medida por HPLC de fase inversa es mayor o igual al 85%.
Patentes similares o relacionadas:
Preparación sólida que contiene colorante, del 29 de Julio de 2020, de DAIICHI SANKYO COMPANY, LIMITED: Preparación farmacéutica sólida que comprende monobencenosulfonato de ácido [(1R,5S,6S)-6-(aminometil)-3- etilbiciclo[3.2.0]hept-3-en-6-il]acético […]
Preparación externa líquida, del 29 de Julio de 2020, de HISAMITSU PHARMACEUTICAL CO. INC.: Una preparación tópica líquida, que comprende: agua; oxibutinina o una sal farmacéuticamente aceptable de la misma; y un éster de ácido dicarboxílico, […]
Método de tratamiento del cáncer, del 22 de Julio de 2020, de Intensity Therapeutics, Inc: Una composición que comprende una cantidad terapéuticamente efectiva de un agente terapéutico y un agente mejorador de la permeación intracelular para uso en el tratamiento […]
Preparaciones ácidas de insulina con estabilidad mejorada, del 15 de Julio de 2020, de SANOFI-AVENTIS DEUTSCHLAND GMBH: Formulación farmacéutica que contiene insulina humana Gly(A21),Arg(B31),Arg(B32) y un tensioactivo, elegido de un grupo que contiene Tween 20® y Tween 80®; siendo […]
Métodos para el tratamiento de la enfermedad ocular en sujetos humanos, del 10 de Junio de 2020, de Clearside Biomedical, Inc: Una formulación farmacéutica que comprende un fármaco para su uso en un método de tratamiento de un trastorno ocular posterior en un sujeto humano que […]
Preparación liofilizada de dipéptidos citotóxicos, del 3 de Junio de 2020, de ONCOPEPTIDES AB: Una preparación farmacéutica liofilizada que comprende (i) melfalán flufenamida, o una sal farmacéuticamente aceptable de la misma; y (ii) al menos un […]
Método y composiciones para el tratamiento de la psoriasis, del 29 de Abril de 2020, de Anaplasi Pharmaceuticals LLC: Una composición tópica en forma de aerosol, espuma o mousse, para el uso en el tratamiento de la psoriasis, en donde la composición comprende: a) del 30 % en […]
Formulación farmacéutica acuosa de tapentadol para administración por vía oral, del 22 de Abril de 2020, de GRUNENTHAL GMBH: Una composición farmacéutica acuosa que contiene tapentadol o una sal fisiológicamente aceptable del mismo y que está adaptada para administración […]