USO DE (D-MEALA)3-(ETVAL)4-CICLOSPORINA PARA EL TRATAMIENTO DE INFECCIÓN POR HEPATITIS C.
Uso de [D-MeAla] 3 -[EtVal] 4 -CsA para la preparación de un producto medicinal para el tratamiento de infección por HCV,
o para la prevención de la recidiva por HCV
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/IB2005/002940.
Solicitante: DEBIOPHARM S.A..
Nacionalidad solicitante: Suiza.
Dirección: FORUM "APRES-DEMAIN", CH. MESSIDOR 5-7 1002 LAUSANNE SUIZA.
Inventor/es: MAUVERNAY, ROLLAND-YVES, SCALFARO,PIETRO, DUMONT,Jean-Maurice, VUAGNIAUX,Grégoire.
Fecha de Publicación: .
Fecha Solicitud PCT: 3 de Octubre de 2005.
Clasificación Internacional de Patentes:
- A61K38/13 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Ciclosporinas.
- C07K7/64A
Clasificación PCT:
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
PDF original: ES-2357587_T3.pdf
Fragmento de la descripción:
La presente invención se refiere al uso de [D-MeAla]3-[EtVal]4-CsA para el tratamiento de infección por virus de hepatitis C (HCV), y a una composición farmacéutica que comprende dicho [D-MeAla]3-[EtVal]4-CsA, posiblemente en combinación con Ribavirina o un interferón alfa. La presente invención se define en las reivindicaciones.
El HCV se clonó y caracterizó hace aproximadamente 15 años por Choo y colegas (véase Science 244, (1989), 359-362). El HCV pertenece a la familia de Flaviviridae, y comprende una nucleocápside con cubierta y un genoma de ARN monocatenario de polaridad positiva (véase Bartenschlager et al., Antiviral Res. 60, (2003), 91-102). El HCV se transmite principalmente por la sangre, productos de la sangre y transmisión vertical durante el embarazo. La introducción de ensayos de diagnóstico para identificar productos de la sangre ha reducido significativamente la tasa de nueva infección.
Aun así, el HCV sigue siendo un problema médico serio. Actualmente hay aproximadamente 170 millones de personas infectadas con HCV. El curso inicial de la infección es típicamente leve. Sin embargo, el sistema inmunitario es a menudo incapaz de aclarar el virus, y las personas con infecciones persistentes tienen riesgo elevado de sufrir cirrosis hepática y carcinoma hepatocelular (véase Poynard et al., Lancet 349, (1997), 825-832).
No existe ninguna vacuna disponible, y las opciones terapéuticas son muy limitadas (Manns et al., Indian J. Gastroenterol. 20 (Supl. 1), (2001), C47-51; Tan et al., Nat. Rev. Drug Discov. 1, (2002), 867-881).
La terapia actual se basa en una combinación de interferón alfa y ribavirina. Esta terapia produce una respuesta antiviral sostenida en el 85-90% de pacientes infectados con los genotipos 2 y 3, pero, desafortunadamente, sólo en aproximadamente 45% de pacientes infectados con el genotipo 1 predominante. Adicionalmente, los efectos secundarios son significativos, e incluyen mialgia, artralgia, cefalea, fiebre, depresión grave, leucopenia y anemia hemolítica.
Claramente, se necesitan terapias adicionales, con una mayor actividad antivírica y un mejor perfil de seguridad, para el tratamiento de infección por HCV, particularmente, por ejemplo, en el caso de la prevención de la recidiva del HCV. A fin de establecer el perfil de seguridad, para el tratamiento clínico de la infección por HCV son particularmente relevantes los criterios tales como baja citotoxicidad y efecto citostático, y alto índice de selectividad.
Recientemente se describió un nuevo enfoque para el tratamiento de infección por HCV usando ciclosporinas, mediante observaciones clínicas (véanse Teraoka et al., Transplant Proc., 1988, 20 (3 supl 3), 868-876, e Inoue et al. J Gastroenterol, 2003, 38, 567-572). Recientemente, se demostró que la ciclosporina A (CsA) inhibió la replicación intracelular in vitro de un replicón subgenómico del HCV a concentraciones farmacéuticas clínicamente logrables (véanse Watashi et al., Hepatology 38, 2003, 1282-1288, y Nakagawa et al., BBRC 313, 2004, 42-47). Ambos grupos sugirieron que el efecto anti-HCV de la CsA no estaba asociado con actividad inmunosupresora, basándose en las observaciones realizadas con el uso respectivamente de un macrólido inmunosupresor, es decir, el compuesto conocido con el nombre FK506, y un derivado de ciclosporina A no inmunosupresor, es decir, el compuesto conocido con el nombre NIM 811 o [MeIle]4-CsA. Nakagawa et al. considera que la expansión de las aplicaciones de CsA puede provocar problemas sustanciales debido a sus propiedades inmunosupresoras bien conocidas, y sugiere que una solución para superar este problema sería considerar el uso de análogos de ciclosporina no inmunosupresores.
Durante los últimos 15 años, se ha realizado un número de estudios de química médica con el objeto de identificar tales análogos de ciclosporina no inmunosupresores, y el compuesto NIM 811 es uno de los compuestos más representativos que tienen tal propiedad.
NIM 811, junto con otros 9 derivados de ciclosporina A, fueron dados a conocer por Ko et al. en la solicitud de patente EP 0 484 281 por sus propiedades no inmunosupresoras, y se consideraron como potencialmente útiles en el tratamiento de la infección por HIV y en la prevención de SIDA. El diseño de esos derivados implicó la modificación de los aminoácidos en las posiciones 4 y/o 5 de ciclosporina A.
Modificando los aminoácidos en las posiciones 2 y/o 6 de ciclosporina A, Sigal et al. sintetizaron un total de 61 análogos de ciclosporina, y observaron que tales modificaciones químicas inducen una disminución en la actividad inmunosupresora (véase Sigal et al., J. Exp. Med., 173, 1991, 619-628).
Se describieron intentos adicionales para modificar aminoácidos en la posición 3 de ciclosporina A, a fin de obtener compuestos inmunosupresores, en particular por Barrière et al., en los documentos WO 98/28328, W098/28329 y WO 98/28330.
Wenger et al. han diseñado una serie de compuestos que difieren de la ciclosporina A en la posición 3, en la que contienen un aminoácido hidrófobo o neutro no voluminoso N-metilado distinto de una glicina, y en la posición 4, en la que contienen un aminoácido hidrófobo o neutro N-metilado o N-etilado distinto de una leucina, y dan a conocer que esos compuestos tienen una potencia elevada para inhibir la replicación del HIV-1 y carecen esencialmente de actividad inmunosupresora (véanse la solicitud de patente internacional WO 00/01715 y Tetrahedron Lett., 41, (2000), 7193-6).
El objetivo de la presente invención es proporcionar al médico una nueva terapia para el tratamiento de la
45
infección por HCV, particularmente por ejemplo en el caso de la prevención de la recidiva del HCV. Esta terapia debería ofrecer una mayor actividad antivírica y un mejor perfil de seguridad en comparación con la terapia ya aprobada o las recientemente propuestas.
Sorprendentemente, se ha encontrado que la administración a un paciente infectado con HCV de un compuesto muy específico, es decir, [D-MeAla]3-[EtVal]4-CsA, satisface los requisitos anteriores. Se observó que, además de su propiedad no inmunosupresora, [D-MeAla]3-[EtVal]4-CsA tiene una afinidad significativamente aumentada por ciclofilinas, afinidad incrementada la cual se correlaciona con una eficacia elevada frente a la inhibición de la replicación del HCV.
En consecuencia, uno de los objetos de la presente invención se refiere al uso de [D-MeAla]3-[EtVal]4-CsA para la preparación de un producto médico destinado al tratamiento de la infección por HCV en un paciente, o para la prevención de la recidiva del HCV.
[D-MeAla]3-[EtVal]4-CsA fue dada a conocer por Wenger et al. en el documento WO 00/01715, y se le ha dado el número de registro CAS 254435-95-5. Es un undecapéptido cíclico descrito por la siguiente fórmula:
**(Ver fórmula)**
en la que MeBmt es N-metil-(4R)-4-but-2E-en-1-il-4-metil-(L)treonina, Abu es ácido L--aminobutírico, D-MeAla es Nmetil-D-alanina, EtVal es N-etil-L-valina, Val es L-valina, MeLeu es N-metil-L-leucina, Ala es L-alanina, (D)Ala es Dalanina, y MeVal es N-metil-L-valina. En la fórmula más abajo se muestra la numeración convencional de las posiciones de los aminoácidos generalmente usada con referencia a ciclosporina A. Esto se logra usando nombres compuestos que comprenden una primera porción que indica la identidad de los restos que son diferentes de aquellos en la ciclosporina A y proporcionando su posición, y una segunda porción etiquetada “CsA” que indica que todos los otros restos son idénticos a aquellos en la ciclosporina A. Por ejemplo, [MeIle]4-CsA es una ciclosporina que es idéntica a la ciclosporina A excepto que MeLeu en la posición 4 se sustituye por MeIle (N-metil-L-isoleucina).
La presente invención se explicará adicionalmente con los siguientes ejemplos y con el dibujo, en el que:
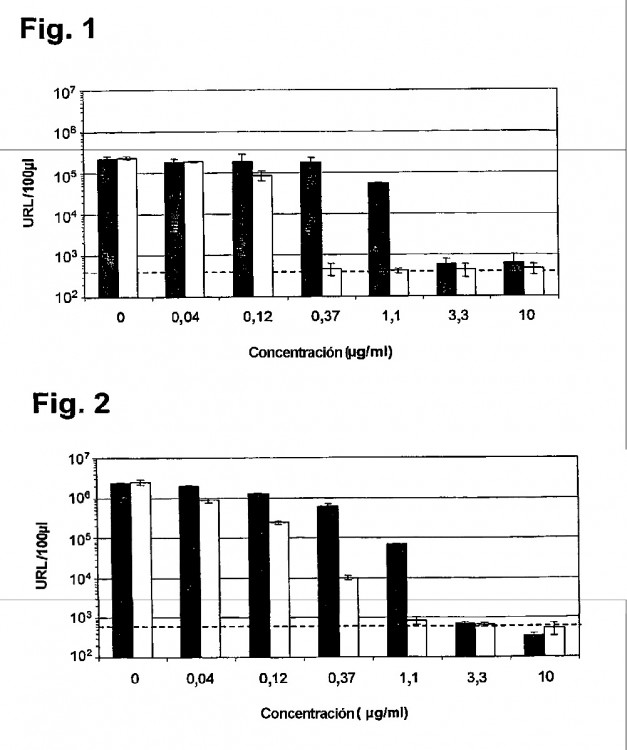
- La Fig. 1 representa un histograma de respuesta a la dosis medido por un ensayo de luciferasa en células Huh-7Lunet infectadas;
- La Fig. 2 representa un histograma de respuesta a la dosis medido por un ensayo de luciferasa en células Huh
7.5 infectadas;
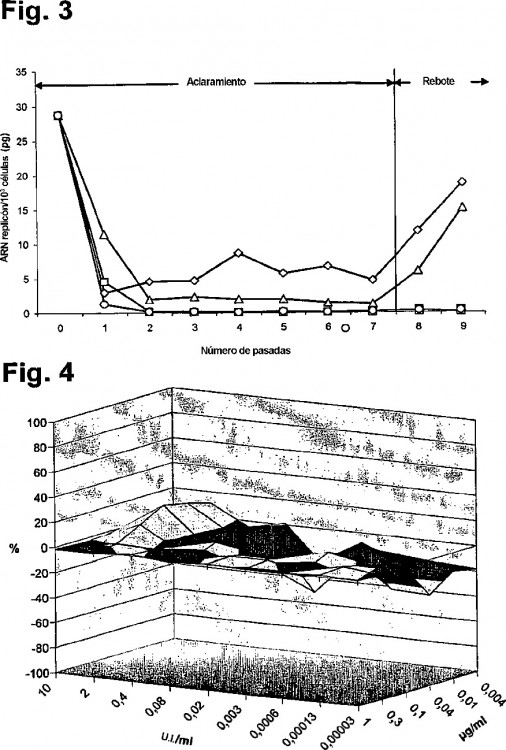
- La Fig. 3 representa curvas de respuesta al aclaramiento de células Huh-9-13 infectadas;
- La Fig. 4 representa una representación tridimensional de la respuesta a la dosis con la combinación IFN / [DMeAla]3-[EtVal]4-CsA.
Los usos médicos actuales de ciclosporina A se refieren a la capacidad de este compuesto para... [Seguir leyendo]
Reivindicaciones:
1. Uso de [D-MeAla]3-[EtVal]4-CsA para la preparación de un producto medicinal para el tratamiento de infección por HCV, o para la prevención de la recidiva por HCV.
2. Uso según la reivindicación 1, caracterizado porque dicha [D-MeAla]3-[EtVal]4-CsA, siendo un primer ingrediente, se coadministra o se administra separadamente con por lo menos un segundo ingrediente que es una
5 sustancia farmacéutica antivírica activa frente a HCV, seleccionada de entre el grupo constituido por ribavirina y un interferón alfa.
3. Composición farmacéutica que comprende [D-MeAla]3-[EtVal]4-CsA como primer ingrediente, y por lo menos una sustancia farmacéutica antivírica activa frente a HCV como segundo ingrediente, caracterizada porque dicho segundo ingrediente se selecciona de entre el grupo constituido por ribavirina y un interferón alfa.
4. Composición farmacéutica según la reivindicación 3, que comprende además un vehículo farmacéuticamente aceptable y, opcionalmente, un diluyente.
5. Composición farmacéutica según cualquiera de las reivindicaciones 3 ó 4, para uso en el tratamiento de infección por HCV o en la prevención de recidiva por HCV.
6. [D-MeAla]3-[EtVal]4-CsA para uso en el tratamiento de infección por HCV, o en la prevención de recidiva 15 por HCV.
Patentes similares o relacionadas:
Composición oftálmica para el tratamiento de la enfermedad del ojo seco, del 10 de Junio de 2020, de NOVALIQ GMBH: Una composición farmacéutica para usarse en el tratamiento tópico de la enfermedad de ojo seco en un sujeto que padece enfermedad del ojo seco, en donde la composición […]
Procedimiento para la fabricación de emulsiones oftálmicas de tipo aceite en agua, del 15 de Abril de 2020, de Santen SAS: Procedimiento para la fabricación de un preconcentrado de una emulsión oftálmica de tipo aceite en agua, comprendiendo dicho procedimiento una […]
Combinación de canrenoato y exenatida, del 8 de Abril de 2020, de Genesis Pharma SA: Una combinación que comprende un modulador de insulina, en donde el modulador de insulina es exenatida o una sal farmacéuticamente aceptable de la misma, y […]
Nanoportadores sintéticos tolerogénicos para reducir las respuestas de anticuerpos, del 1 de Abril de 2020, de Selecta Biosciences, Inc: Una composición para usar en un método que promueve una respuesta inmunitaria tolerogénica a un antígeno que de otro modo causaría una respuesta inmunitaria […]
Cannabidiol para la prevención y el tratamiento de la enfermedad de injerto contra huésped, del 19 de Febrero de 2020, de MOR RESEARCH APPLICATIONS LTD.: Una composición que comprende un cannabidiol para usar en la prevención y el tratamiento de la enfermedad de injerto contra huésped GVHD en un sujeto que la […]
Micropartículas cargadas con ciclosporina de liberación sostenida, del 29 de Enero de 2020, de Midatech Pharma (Wales) Limited: Una formulación farmacéutica de liberación controlada, que comprende micropartículas cargadas con ciclosporina de un polímero biorreabsorbible, que comprende poli(D,L-lactida), […]
Composiciones que comprenden agentes farmacéuticos poco solubles en agua y agentes antimicrobianos, del 15 de Enero de 2020, de ABRAXIS BIOSCIENCE, LLC: Una composición que comprende (a) nanopartículas que comprenden un agente farmacéutico poco soluble en agua y albúmina, (b) un edetato y citrato, […]
Composición oftálmica que comprende ciclosporina y trehalosa, del 8 de Enero de 2020, de Huons Co., Ltd: Una composición oftálmica que comprende ciclosporina y trehalosa como ingredientes activos, donde una relación de peso de ciclosporina:trehalosa es de 1:20 - 200 y la ciclosporina […]