PROCEDIMIENTO PARA LA PRODUCCIÓN DE CÉLULAS MADRE MULTIPOTENTES.
Procedimiento para la producción de células madre multipotentes partiendo de adipocitos o preadipocitos que comprende la fase de tratamiento desmetilante de dichas células con 5'-aza-2'-citidina a una concentración comprendida entre 0,
1 μM y 175 μM hasta la aparición de marcadores típicos del estado embrionario multipotente y no diferenciado y/o la reducción en la expresión de los marcadores adipogénicos de fase de diferenciación tardía
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/IB2007/002204.
Solicitante: METAPONTUM AGROBIOS S.R.L.
Nacionalidad solicitante: Italia.
Dirección: S.S. JONICA 106 KM. 448.2 75010 METAPONTO (METERA) ITALIA.
Inventor/es: CELLINI, FRANCESCO, CIFARELLI,ROSA,ANNA, DI LIDDO,Rosa, PARNIGOTTO,Pier,Paolo.
Fecha de Publicación: .
Fecha Solicitud PCT: 26 de Julio de 2007.
Clasificación Internacional de Patentes:
- C12N5/06B26
Clasificación PCT:
- C12N5/077 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › Células mesenquimales, p. ej. Células óseas, células cartilaginosas, Células del estroma de la médula ósea, células adiposas o células musculares.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
PDF original: ES-2358057_T3.pdf



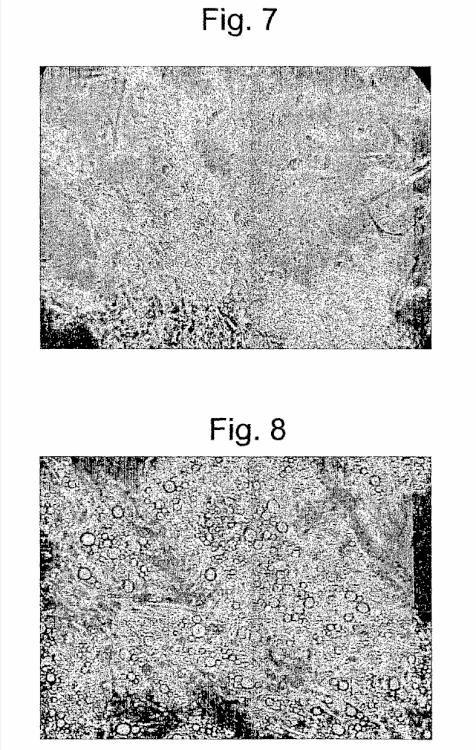
Fragmento de la descripción:
La presente invención se refiere a un nuevo procedimiento para la producción de células madre multipotentes.
La investigación sobre células madre multipotentes y totipotentes (Conrad C., et al., 2005) ha abierto posibilidades nuevas e interesantes de aplicación para la terapia celular y la ingeniería de tejidos. Sin embargo, ha de definirse todavía cuál es la fuente de células madre más adecuada para su aplicación.
La utilización de poblaciones de células embrionarias (ES) ha estimulado recientemente un interés científico creciente en el campo médico. Aunque estas células se caracterizan por una alta capacidad de replicación, pluripotencialidad de diferenciación y expansión a largo plazo in vitro, su utilización terapéutica, sin embargo, está limitada debido a los numerosos problemas éticos implicados (Kiatpongsan S. et al., 2006).
La considerable evidencia experimental ha demostrado que pueden identificarse fuentes alternativas de células madre en adultos; aunque éstas presentan únicamente capacidad de diferenciación en un número limitado de tipos celulares, no presentan problemas éticos. Entre las fuentes de células madre adultas están la médula ósea (Saulnier N. et al., 2005), el epitelio seminífero de la gónada masculina (Cyranoski D. et al., 2006), epitelios (Janes SM, et al., 2002), sangre periférica, sangre de cordón umbilical (Saulnier N. et al., 2005) y tejido adiposo (Strem BM, et al., 2005).
Sin embargo, las células madre adultas, no resultan disponibles fácilmente ya que están limitadas en cuanto a su número; además no pueden cultivarse in vitro durante un periodo prolongado ya que, tras diversas divisiones celulares, tienden a perder su multipotencialidad.
Junto con estas fuentes fisiológicas de células madre, se ha añadido recientemente otra fuente muy prometedora, que puede obtenerse mediante la modificación del programa genético de células diferenciadas (F. Santos, et al., 2002; A.J. Peter, et al., 2001; R. Wolf, et al., 2001; J.C. Gutierrez, et al., 2000; T.H. Bestor, 2000; C. Stewart, et al., 1982; R.D. Palmiter, et al., 1982; D. Biniszkiewicz, et al., 2002;
M.F. Chan, et al., 2001; M. Okano, et al., 1999). Los investigadores Wilmut y Campbell (Shiels PG, et al., 1999; Eyestone WH, et al., 1999) y posteriormente Yanagimachi y colaboradores (Wakayama T, et al., 2001) establecieron claramente, utilizando modelos de animales, que el núcleo de células somáticas completamente diferenciadas puede reprogramarse si se transfiere al citoplasma de un óvulo. Los mecanismos y las moléculas implicados en este proceso de desprogramación y reprogramación del genoma de células somáticas aún no se han aclarado completamente. Sin embargo, es evidente que durante este proceso se descondensa la cromatina, se desestabiliza la estructura del nucleosoma y se disocian las proteínas reguladoras de la fibra de ADN influyendo así en la expresión génica (T. Haaf, et al., 2000).
Otras observaciones experimentales han demostrado que, en las primeras fases del desarrollo embrionario, existen numerosas modificaciones de metilación epigenéticas de los residuos de citosina con respecto al genoma, produciéndose como resultado un cambio en el fenotipo celular e implicación de la célula hacia una línea de diferenciación específica (F. Santos, et al., 2002; A.J. Peter, et al., 2001; R. Wolf, et al., 2001; J.C. Gutierrez, et al., 2000; Jetsche A. et al., 2006; Szyf M, et al., 1989; Keshhet I, et al., 1985).
A este respecto, se desarrolló la idea de que se puede reprogramar cualquier célula completamente diferenciada modificando parcial o completamente el estado de metilación de su genoma, por medio del tratamiento con factores específicos.
Taranger y colaboradores (Taranger CK, et al., 2005), de hecho, han demostrado que las células epiteliales 293T pueden diferenciarse hasta que se expresan marcadores típicos del estado embrionario tras 1 hora de tratamiento con el extracto de células NCCIT, aisladas de teratoma. El análisis cuantitativo de la expresión génica y el estudio en micromatrices efectuados en las colonias mantenidas en un cultivo durante 23 pases reveló que la transición al fenotipo celular pluripotente implica una estimulación dinámica de cientos de genes típicos de las células NCCIT (entre los que se encuentran OCT4 (Ovitt CE, et al., 1998), SOX2 (M.V. Zappone, et al., 2000), NANOG (K. Mitsui, et al., 2003)) y una disminución de la expresión en los genes que caracterizan la células 293T y en los indicadores de diferenciación genéricos tales como, por ejemplo, lamininas de tipo A.
Además, la evidencia experimental ha demostrado que un agente desmetilante, la 5'-aza-2'citidina (5-AzaC), un producto análogo a la citosina, puede provocar una desmetilación exhaustiva de los residuos de 5-metilcitosina (M. Vlahovic, et al., 1999) y reducir la actividad de la ADN metiltransferasa (Tsuji-Takayama K, et al., 2004; Karpf AR, et al., 1999; U. Aapola, et al., 2001; X. Cheng, 1995; L.R. Silverman, et al., 1993; Simonsson, S., y Gurdon, 2004; Flasza, M., et al., 2003).
Se han identificado 4 enzimas de ADN citosina metiltransferasa, Dnmt1, Dnmt3a, Dnmt3b y Dnmt31 en células embrionarias (Shiels PG, et al., 1999; Eyestone WH, et al., 1999; Wakayama T, et al.,
**(Ver fórmula)**
2001).
La Dnmt1 es la principal enzima que mantiene el estado de metilación durante la replicación del ADN. Su inactivación en modelos murinos provocó la pérdida de la huella genómica y condujo a la mortalidad precoz del embrión. La Dnmt3a, la Dnmt3b y la Dnmt31, que principalmente catalizan la metilación de novo, son extremadamente activas en células madre embrionarias y promueven su diferenciación in vitro.
Utilizada como un agente quimioterápico eficaz en el tratamiento de la leucemia (Yang AS, et al., 2006), la 5-AzaC ha demostrado ser un medio experimental útil para estudiar la metilación del ADN en la diferenciación celular y en mecanismos de activación génica (J.G. Herman, et al., 1994; K. Yoshiura, et al., 1995; Y.L. Ottaviano, et al., 1994; C.M. Bender, et al., 1998). La 5-AzaC, por ejemplo, ha demostrado intervenir en la inducción de la diferenciación en sentido miogénico de las células madre multipotentes aisladas del cordón umbilical, la médula ósea y el tejido adiposo (Lin Y, et al., 2006). Otros estudios proporcionan asimismo datos relacionados con su actividad moduladora sobre el desarrollo embrionario con respecto a los efectos de proliferación y diferenciación. (Tsuji-Takayama K, et al., 2004). Además, los cuerpos embrioides diferenciados in vitro y tratados durante 6 horas con 5-AzaC (1 M) reestablecieron el proceso de crecimiento de colonias típico de las células madre y la sensibilidad al factor inhibidor de leucemia (LIF).
La acción desmetilante de la 5-azacitidina, con una restauración consiguiente de la multipotencialidad celular, se demuestra en gran medida y se verifica también en plantas, monocotiledóneas (trigo) y dicotiledóneas (tomates), en el documento W02005003344.
Lin Tsai Ming et al. (Stem cells and development, vol. 14, n.º1, febrero de 2005, páginas 92-102) dan a conocer un procedimiento para obtener células madre multipotenciales a partir de tejido adiposo utilizando un medio con antioxidantes y calcio reducido. Las células así obtenidas pueden diferenciarse en adipocitos, osteoblastos, condrocitos y mioblastos y expresar el marcador de células madre embrionarias Oct-4. El documento citado no da a conocer un procedimiento por el que se obtienen células madre multipotenciales tras el tratamiento con 5-AzaC.
El análisis morfológico/funcional y el estudio de la expresión génica concluyen que 5-AzaC revierte el estado diferenciado de las células embrionarias, organizadas en cuerpos embrioides, lo que puede atribuirse fenotípicamente a células madre pluripotentes no diferenciadas que expresan marcadores típicos tales como SSEA-1, fosfatasa alcalina, Oct4, Nanog y SOX2.
Otros numerosos estudios han descrito la reactivación en células somáticas mediante el tratamiento con 5-AzaC de genes silenciados tales como VHL, E-cadherina, receptor de estrógeno y p16. Los genes de la familia STAT, que presentan un papel importante en el mantenimiento del estado no diferenciado de las células madre embrionarias (ES) y su capacidad de autorreplicación mediante la transducción de la señal de LIF, son probablemente también la diana de agentes desmetilantes. Karpf y colaboradores (Karpf AR., et al., 1999) han observado que los genes... [Seguir leyendo]
Reivindicaciones:
1. Procedimiento para la producción de células madre multipotentes partiendo de adipocitos o preadipocitos que comprende la fase de tratamiento desmetilante de dichas células con 5'-aza-2'-citidina a una concentración comprendida entre 0,1 M y 175 M hasta la aparición de marcadores típicos del estado embrionario multipotente y no diferenciado y/o la reducción en la expresión de los marcadores adipogénicos de fase de diferenciación tardía.
2. Procedimiento según la reivindicación 1, que comprende las fases siguientes:
a) inducción de la diferenciación de los preadipocitos en adipocitos maduros mediante:
i) cultivo de los preadipocitos hasta alcanzar la confluencia máxima;
ii) tratamiento con factores de diferenciación;
iii) cultivo en un medio de mantenimiento exento de agentes de inducción adipogénicos hasta que se verifique la expresión de leptina o GLUT-4;
b) tratamiento desmetilante de las células adiposas maduras muy diferenciadas con 5'-aza-2'citidina a una concentración comprendida entre 0,1 M y 175 M hasta la aparición de los marcadores típicos del estado embrionario no diferenciado y/o la reducción en la expresión de los marcadores adipogénicos de fase de diferenciación tardía.
3. Procedimiento según cualquiera de las reivindicaciones 1 a 2, en el que la concentración de 5'-aza-2'-citidina se selecciona de entre 100 M, 125 M, 150 M, 175 M.
4. Procedimiento según cualquiera de las reivindicaciones 1 a 3, en el que dichos marcadores típicos del estado embrionario no diferenciado se seleccionan de entre OCT4, SOX2, NANOG, SSEA-1 y fosfatasa alcalina o una combinación de los mismos.
5. Procedimiento según cualquiera de las reivindicaciones 1 a 4, en el que dichos marcadores adipogénicos de fase de diferenciación tardía se seleccionan de leptina y GLUT-4 o una combinación de los mismos.
6. Procedimiento según cualquiera de las reivindicaciones 2 a 5, en el que dichos factores de diferenciación de la fase ii) se seleccionan de entre insulina, isobutilmetilxantina, dexametasona, indometacina o una combinación de las mismas.
7. Procedimiento según cualquiera de las reivindicaciones 2 a 6, en el que dicho cultivo de la fase iii) presenta una duración de 7 a 10 días.
8. Procedimiento según cualquiera de las reivindicaciones 1 a 7, que comprende además una fase de inducción de la diferenciación en un sentido osteogénico, condrogénico o miogénico.
9. Utilización de 5'-aza-2'-citidina a una concentración comprendida entre 0,1 M y 175 M para la inducción de la capacidad de formación de células madre multipotentes partiendo de adipocitos o preadipocitos.
10. Utilización según la reivindicación 9, en la que la concentración de 5'-aza-2'-citidina se selecciona de entre 100 M, 125 M, 150 M, 175 M.
Patentes similares o relacionadas:
MICROCÁPSULAS ESFÉRICAS O NO ESFÉRICAS QUE COMPRENDEN PÉPTIDOS GLP-1, SU PRODUCCIÓN Y SU USO, del 17 de Agosto de 2011, de BIOCOMPATIBLES UK LIMITED: Microcápsula esférica que comprende como mínimo un revestimiento superficial y un núcleo, en la que el como mínimo un revestimiento superficial comprende […]
 KIT PARA PREPARAR UNA COMPOSICION QUE COMPRENDE UNAS CELULAS ADIPOCITARIAS, del 23 de Julio de 2010, de STEMCIS: Kit para preparar una composición que comprende unas células adipocitarias, comprendiendo dicho kit:
a) por lo menos un tubo estéril apropiado para ser centrifugado, […]
KIT PARA PREPARAR UNA COMPOSICION QUE COMPRENDE UNAS CELULAS ADIPOCITARIAS, del 23 de Julio de 2010, de STEMCIS: Kit para preparar una composición que comprende unas células adipocitarias, comprendiendo dicho kit:
a) por lo menos un tubo estéril apropiado para ser centrifugado, […]
Reparación de tejido cartilaginoso, del 27 de Mayo de 2020, de CartiRegen B.V: Un método para la separación electroforética de células a partir de un tejido, comprendiendo el método: a) seccionar un tejido para preparar fragmentos de dicho tejido, […]
Composiciones de medio de cultivo para la maduración de cardiomiocitos derivados de células madre pluripotentes de mamíferos, del 6 de Mayo de 2020, de Ncardia B.V: Una composición de medio de cultivo acuoso, en la que dicha composición de medio de cultivo no contiene suero y comprende: - un agonista del receptor de la hormona […]
Ceramidasa y diferenciación celular, del 22 de Abril de 2020, de MOUNT SINAI SCHOOL OF MEDICINE: Un método in vitro para mejorar el fenotipo de una población de condrocitos, dicho método comprende: seleccionar una población de condrocitos de mamífero que […]
Composiciones y métodos de células grasas marrones, del 1 de Abril de 2020, de Biorestorative Therapies, Inc: Un método para generar una célula grasa marrón, el método comprende: aislar una célula madre de un tejido graso marrón obtenido; y cultivar la célula […]
Método para producir células precursoras renales, del 11 de Marzo de 2020, de KYOTO UNIVERSITY: Un método para producir células progenitoras renales a partir de células del mesodermo intermedio, que comprende la siguiente etapa de: cultivar […]
Método para diferenciar, células madre pluripotentes inducidas a partir de células madre mesenquimatosas, en neuronas, del 26 de Febrero de 2020, de BBHC Co. Ltd: Un método para diferenciar células madre mesenquimatosas en neuronas, que comprende las etapas de: (a) añadir un extracto de Ecklonia cava a un […]