CELULAS MARCADAS PARA SU USO COMO CONTROL FUNCIONAL INTERNO EN ENSAYOS DE DETECCIÓN DE CELULAS RARAS.
Un procedimiento para producir una célula estabilizada para uso como control interno en procedimientos para aislar e identificar células raras,
teniendo dicha célula de control estabilizada determinantes en común con dichas células raras, comprendiendo dicho procedimiento: a) marcar redundantemente dicha célula de control con al menos dos marcas fluorescentes que tienen las mismas propiedades espectrales; b) poner en contacto dicha célula marcada con un fijador de células efectuando dicho fijador la estabilización de tanto la estructura celular como de restos antigénicos presentes sobre dicha célula de control; c) eliminar posteriormente el fijador en exceso para promover el almacenamiento a largo plazo de dicha célula de control, siendo dicha célula de control físicamente y biológicamente estable durante al menos seis meses
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2002/006967.
Solicitante: VERIDEX LLC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 1001 US HIGHWAY ROUTE 202 NORTH RARITAN NJ 08869 ESTADOS UNIDOS DE AMERICA.
Inventor/es: TERSTAPPEN, LEON W. M. M., RAO,GALLA,CHANDRA, LIBERTI,PAUL,A, RUTNER,Herman.
Fecha de Publicación: .
Fecha Solicitud PCT: 7 de Marzo de 2002.
Clasificación Internacional de Patentes:
- B82Y25/00 TECNICAS INDUSTRIALES DIVERSAS; TRANSPORTES. › B82 NANOTECNOLOGIA. › B82Y USOS O APLICACIONES ESPECIFICOS DE NANOESTRUCTURAS; MEDIDA O ANALISIS DE NANOESTRUCTURAS; FABRICACION O TRATAMIENTO DE NANOESTRUCTURAS. › Nano magnetismo, p. ej. magnetoimpedancia, magnetorresistencia anisotrópica, magnetorresistencia gigante o magnetorresistencia de tunelización.
- G01N15/14 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 15/00 Investigación de características de partículas; Investigación de la permeabilidad, del volumen de los poros o del área superficial efectiva de los materiales porosos (identificación de microorganismos C12Q). › Investigación por medios electroópticos.
Clasificación PCT:
- C12N5/00 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00).
- G01N33/50 G01N […] › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › Análisis químico de material biológico, p. ej. de sangre o de orina; Ensayos mediante métodos en los que interviene la formación de uniones bioespecíficas con grupos coordinadores; Ensayos inmunológicos (procedimientos de medida o ensayos diferentes de los procedimientos inmunológicos en los que intervienen enzimas o microorganismos, composiciones o papeles reactivos a este efecto, procedimientos para preparar estas composiciones, procedimientos de control sensibles a las condiciones del medio en los procedimientos microbiológicos o enzimáticos C12Q).
- G01N33/533 G01N 33/00 […] › con un marcador fluorescente.
- G01N33/574 G01N 33/00 […] › para el cáncer.
Clasificación antigua:
- A01N1/02 NECESIDADES CORRIENTES DE LA VIDA. › A01 AGRICULTURA; SILVICULTURA; CRIA; CAZA; CAPTURA; PESCA. › A01N CONSERVACION DE CUERPOS HUMANOS O ANIMALES O DE VEGETALES O DE PARTES DE ELLOS (conservación de alimentos o productos alimenticios A23 ); BIOCIDAS, p. ej. EN TANTO QUE SEAN DESINFECTANTES, PESTICIDAS O HERBICIDAS (preparaciones de uso médico, dental o para el aseo que eliminan o previenen el crecimiento o la proliferación de organismos no deseados A61K ); PRODUCTOS QUE ATRAEN O REPELEN A LOS ANIMALES; REGULADORES DEL CRECIMIENTO DE LOS VEGETALES. › A01N 1/00 Conservación de cuerpos humanos o animales, o partes de ellos. › Conservación de partes vivas.
- A61K35/12 A […] › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 35/00 Preparaciones medicinales que contienen sustancias de constitución indeterminada o sus productos de reacción. › Sustancias procedentes de mamíferos; Composiciones que comprenden tejidos o células indeterminadas; Composiciones que comprenden células madre no embrionarias; Células modificadas genéticamente (vacunas o preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00).
- G01N33/48 G01N 33/00 […] › Material biológico, p. ej. sangre, orina (G01N 33/02, G01N 33/26, G01N 33/44, G01N 33/46 tienen prioridad ); Hemocitómetros (cómputo de glóbulos repartidos sobre una superficie por barrido óptico de la superficie G06M 11/02).
- G01N33/532 G01N 33/00 […] › Producción de compuestos inmunoquímicos marcados.
- G01N33/533 G01N 33/00 […] › con un marcador fluorescente.
- G01N33/554 G01N 33/00 […] › siendo el soporte una célula o un fragmento de célula biológica, p. ej. células de bacterias, de levadura.
- G01N33/555 G01N 33/00 […] › Glóbulo rojo.
- G01N33/556 G01N 33/00 […] › Glóbulo rojo fijado o estabilizado.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
PDF original: ES-2357101_T3.pdf


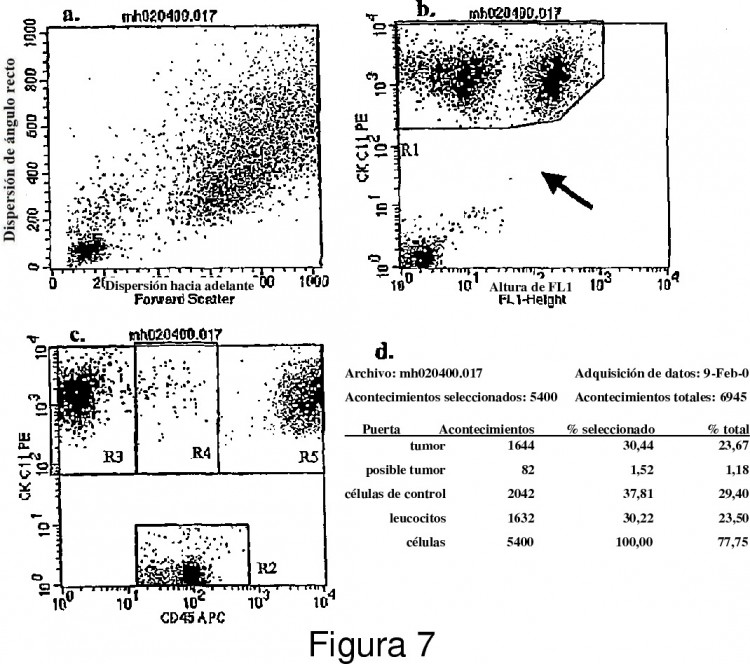
Fragmento de la descripción:
CAMPO DE LA INVENCIÓN
La presente invención se refiere al uso de células previamente marcadas como control funcional interno en los procedimientos de selección y análisis de células. La invención proporciona una única entidad que puede controlar esos diversos parámetros como marcado magnético, selección magnética, viscosidad, temperatura, adición de reactivos, actividad 5 de reactivos y error del operador en procedimientos que implican el aislamiento de células raras. La invención es útil en aspectos de la selección de células que incluye cribado de cáncer, estadificación, monitorización de tratamientos de quimioterapia, monitorización de recaída, hibridación de ADN y otras numerosas formas de diagnóstico y monitorización médicos. La presente invención es especialmente útil en la separación de células raras.
ANTECEDENTES DE LA INVENCIÓN 10
La mayoría de las muertes por cáncer no se producen por el tumor primario. En su lugar, la muerte se produce por metástasis, es decir, múltiples colonias de tumor extendidas establecidas por células malignas que se unen a sí mismas desde el sitio del tumor original y se desplazan por el cuerpo, frecuentemente a sitios distantes. Si un tumor primario se detecta suficientemente pronto, la cirugía, la radiación, la quimioterapia o alguna combinación de estos tratamientos puede eliminarlo frecuentemente. Desafortunadamente, las colonias metastásicas son más difíciles de detectar y eliminar y 15 frecuentemente es imposible tratar todas ellas satisfactoriamente. Por tanto, desde un punto de vista clínico, las metástasis pueden considerarse el acontecimiento decisivo en la progresión natural del cáncer.
Además, la capacidad de metastatizar es la propiedad que caracteriza excepcionalmente a un tumor maligno. La metástasis de cáncer comprende la siguiente serie compleja de acontecimientos secuenciales:
1. Extensión desde el locus primario a los tejidos circundantes; 20
2. Penetración en cavidades y vasos del cuerpo;
3. Liberación de células tumorales para el transporte por el sistema circulatorio hasta sitios distantes;
4. Reinvasión de tejido en el sitio de ataque; y
5. Adaptaciones al nuevo entorno de manera que se promueva la supervivencia de células tumorales, la vascularización y el crecimiento tumoral. 25
Basándose en la complejidad del cáncer y la metástasis del cáncer, y la frustración en el tratamiento de pacientes con cáncer con el transcurso de los años, se han hecho muchos intentos por desarrollar pruebas de diagnóstico para guiar el tratamiento y monitorizar los efectos de tal tratamiento en metástasis o recaída. Tales pruebas también podrían usarse supuestamente para el cribado de cáncer, sustituyendo pruebas relativamente rudimentarias tales como la mamografía para tumores de mama o exámenes rectales digitales para cánceres de próstata. Para ese fin se han desarrollado varias pruebas 30 durante los últimos 20 años y se han evaluado sus beneficios. Uno de los primeros intentos fue la formulación de un inmunoensayo para el antígeno carcinoembrionario [CEA]. Este antígeno aparece en células fetales y reaparece en células tumorales en ciertos cánceres. Se han hecho grandes esfuerzos para evaluar la utilidad de probar para CEA, además de para muchos otros antígenos “tumorales” tales como PSA, CA 15.3, CA125, PSMA, CA27.29. Estos esfuerzos han demostrado ser algo inútiles ya que la aparición de tales antígenos en una muestra de prueba no ha sido generalmente 35 predictiva y se detectan frecuentemente cuando hay poca esperanza para el paciente. Sin embargo, en los últimos años, una prueba ha demostrado ser útil en la detección temprana de cáncer, concretamente PSA para cánceres de próstata. Cuando se usa con examen físico de seguimiento y biopsia, la prueba de PSA ha desempeñado una notable función en la detección temprana de cáncer de próstata, momento en el que se trata mejor.
A pesar del éxito de la prueba de PSA, la prueba deja mucho que desear. Por ejemplo, altos niveles de PSA no siempre 40 establecen una correlación con cáncer ni parecen ser una indicación del potencial metastásico del tumor. Esto puede ser debido en parte al hecho de que el PSA es un componente de tejido de próstata normal, además de otros factores desconocidos. Además, cada vez es más evidente que un gran porcentaje de pacientes con cáncer de próstata continuarán teniendo enfermedad localizada que no es potencialmente mortal. Basándose en el deseo de obtener una mejor concordancia entre aquellos pacientes con cánceres que metastatizarán y aquellos que no se ha intentado determinar si las 45 células de la próstata están en la circulación. Cuando se añade a altos niveles de PSA y datos de biopsia, la existencia de células tumorales en circulación podrían dar indicaciones de cómo de enérgicamente debería tratarse el paciente.
El enfoque recomendado para determinar la presencia de células tumorales de la próstata en circulación ha sido probar la expresión de ARN mensajero de PSA en sangre. Esto se está haciendo mediante el laborioso procedimiento de aislar todo el ARNm de una muestra de sangre y realizar RT-PCR. No existe una buena correlación entre la presencia de tales células en 50 la sangre y la capacidad de predecir qué pacientes están en necesidad de un tratamiento enérgico (LG Gomella, J of Urology, 158:326-337(1997)). Es de notar que la PCR es difícil de realizar cuantitativamente, si no imposible, en muchas situaciones, es decir, para determinar el número de células tumorales por volumen unitario de muestra biológica. Adicionalmente, frecuentemente se observan positivos falsos usando esta técnica. Un inconveniente añadido es el límite finito y práctico a la sensibilidad de esta técnica basándose en el tamaño de muestra examinado. Normalmente, la prueba se 55
realiza en 105 a 106 células purificadas de eritrocitos interferentes. Con 5-10x106 leucocitos en sangre normal, esto se corresponde con un límite inferior práctico de sensibilidad de una célula tumoral/0,1 ml de sangre. Por tanto, se necesita que haya aproximadamente 10 células tumorales en un ml de sangre antes de que la señal sea detectable. Como complicación adicionalmente posible, las células tumorales son frecuentemente genéticamente inestables. Por consiguiente, las células cancerosas que tienen transposiciones genéticas y cambios de secuencias pueden pasarse por alto en un ensayo de PCR 5 ya que puede perderse la complementariedad de secuencias necesarias entre cebadores de PCR y secuencias diana.
En resumen, una prueba de diagnóstico útil necesita ser altamente sensible y cuantitativa de forma fiable. Una prueba tal debe poder detectar la presencia de una única célula tumoral en un ml de sangre, correspondiéndose así en promedio con 3000-4000 células totales en circulación. En estudios de inóculo que establecen tumores en animales, ese número de células puede conducir de hecho al establecimiento de un tumor. Además, si 3000-4000 células en circulación representan el 10 0,01% de las células totales en un tumor, entonces contendría aproximadamente 4x107 células totales. Un tumor que contiene ese número de células no sería visible por ninguna técnica actualmente existente. De ahí que, si las células tumorales se propagaran en las fases tempranas de cáncer, una prueba con la sensibilidad mencionada anteriormente detectaría el cáncer. Si las células tumorales se propagaran en alguna relación funcional con el tamaño del tumor, entonces sería beneficiosa una prueba cuantitativa para evaluar la carga tumoral. Hasta ahora no se ha informado de información 15 referente a la existencia de células tumorales en circulación en cánceres muy tempranos. Además, hay dudas muy considerables en la bibliografía médica referentes a la existencia de tales células y el potencial de tal información. La visión general es que los tumores están inicialmente muy confinados y de ahí que haya pocas células, si hay alguna, en circulación en fases tempranas de la enfermedad, y que sería poco probable que la detección temprana de células cancerosas en circulación, aunque fuera viable, proporcionara cualquier información útil. 20
Basándose en lo anterior, es evidente que es altamente deseable un procedimiento para identificar aquellas células en circulación con potencial metastásico antes del establecimiento de un tumor secundario, particularmente durante las fases tempranas de cáncer. Para apreciar la ventaja que una prueba tal tendría sobre... [Seguir leyendo]
Reivindicaciones:
1. Un procedimiento para producir una célula estabilizada para uso como control interno en procedimientos para aislar e identificar células raras, teniendo dicha célula de control estabilizada determinantes en común con dichas células raras, comprendiendo dicho procedimiento:
a) marcar redundantemente dicha célula de control con al menos dos marcas fluorescentes que tienen las mismas 5 propiedades espectrales;
b) poner en contacto dicha célula marcada con un fijador de células efectuando dicho fijador la estabilización de tanto la estructura celular como de restos antigénicos presentes sobre dicha célula de control;
c) eliminar posteriormente el fijador en exceso para promover el almacenamiento a largo plazo de dicha célula de control, siendo dicha célula de control físicamente y biológicamente estable durante al menos seis meses. 10
2. Un procedimiento según la reivindicación 1, en el que dicho fijador de células se selecciona del grupo que consiste en paraformaldehído, formaldehído, glutaraldehído y glioxal.
3. Un procedimiento según la reivindicación 1 ó 2, en el que dichas marcas fluorescentes son marcas de membrana seleccionadas del grupo que consiste en carbocianinas lipófilas de cadena larga, indocarbocianinas lipófilas de cadena larga, indodicarbocianinas lipófilas de cadena larga y análogos de las mismas, colorantes de aminoestirilo lipófilos y análogos de 15 cadena larga de colorantes de rodamina B C18 y de fluoresceína C18.
4. Un procedimiento según la reivindicación 1 ó 2, en el que dicha célula de control está marcada con un anticuerpo inmunológicamente específico para un antígeno presente sobre dicha célula, estando dicho anticuerpo conjugado con una molécula fluorescente.
5. Un procedimiento según la reivindicación 1 ó 2, en el que componentes celulares de dicha célula de control se marcan 20 con colorantes seleccionados del grupo que consiste en DAPI, Hoechst 33342, naranja de acridina, derivados de rodamina, rojo neutro y BODIPY™ lipófilo.
6. Un procedimiento según la reivindicación 5, en el que dicho componente celular se selecciona del grupo que consiste en ácidos nucleicos, núcleos, lisosomas, aparato de Golgi, mitocondrias y el retículo endoplásmico.
7. Un procedimiento según cualquiera de las reivindicaciones 1 a 6, en el que dicha célula de control expresa molécula de 25 adhesión a células epiteliales (EpCAM) sobre su superficie y también expresa citoqueratina intracelularmente, y en el que dicha célula de control se marca redundantemente en la membrana en la etapa a) con al menos dos marcas fluorescentes que tienen las mismas propiedades espectrales.
8. Una célula estabilizada para uso como control interno en procedimientos para aislar e identificar células raras, teniendo dicha célula de control determinantes en común con dichas células raras, en la que dicha célula de control se ha marcado 30 redundantemente con al menos dos marcas fluorescentes que tienen las mismas propiedades espectrales, y en la que componentes celulares y restos antigénicos de dicha célula de control se han estabilizado posteriormente mediante exposición a fijador.
9. Una célula de control según la reivindicación 8, en la que la membrana de dicha célula está marcada redundantemente con dichas marcas fluorescentes. 35
10. Una célula de control según la reivindicación 9 que se selecciona del grupo que consiste en células tumorales, células bacterianamente infectadas, células víricamente infectadas, células miocárdicas, células endoteliales en circulación y células fetales en circulación materna.
11. Una célula de control según la reivindicación 9 ó 10, en la que dichas marcas fluorescentes se seleccionan del grupo que consiste en carbocianinas lipófilas de cadena larga, indocarbocianinas lipófilas de cadena larga, indodicarbocianinas 40 lipófilas de cadena larga y análogos de las mismas, colorantes de aminoestirilo lipófilos y análogos de cadena larga de colorantes de rodamina B C18 y fluoresceína C18.
12. Una célula de control según cualquiera de las reivindicaciones 8 a 11, en la que dicha célula de control está marcada con un anticuerpo inmunológicamente específico para un antígeno presente sobre dicha célula, estando dicho anticuerpo conjugado con una molécula fluorescente. 45
13. Una célula de control según cualquiera de las reivindicaciones 8 a 10, en la que componentes celulares de dicha célula de control se marcan con colorantes seleccionados del grupo que consiste en DAPI, Hoechst 33342, naranja de acridina, derivados de rodamina, rojo neutro y BODIPY™ lipófilo.
14. Una célula de control según la reivindicación 13, en la que dicho componente celular se selecciona del grupo que consiste en ácidos nucleicos, núcleos, lisosomas, aparato de Golgi, mitocondrias y retículo endoplásmico. 50
15. Una célula de control según cualquiera de las reivindicaciones 8 a 14, en la que la célula de control es una célula
tumoral que expresa EpCAM sobre su superficie de membrana y la citoqueratina intracelularmente.
16. Una célula de control según la reivindicación 15, siendo dicha célula una célula de cáncer de mama SKBR3 que comprende además un segundo determinante de superficie detectablemente marcado seleccionado del grupo que consiste en mamoglobulina, globulina de grasa láctea humana y HER-2/neu.
17. Una célula de control según la reivindicación 15, siendo dicha célula una célula de cáncer de mama MCF-7 que 5 comprende además un segundo determinante de superficie detectablemente marcado que es un receptor estrogénico.
18. Una célula de control según la reivindicación 15, siendo dicha célula una célula de cáncer de próstata LNCaP que comprende además un segundo determinante de superficie detectablemente marcado seleccionado del grupo que consiste en PSMA, PSA y receptor androgénico.
19. Una célula de control según la reivindicación 15, siendo dicha célula una célula cancerosa de leucemia de linfocitos T 10 CEM que comprende además un segundo determinante de superficie detectablemente marcado que es una molécula CD4.
20. Una célula de control según la reivindicación 15, siendo dicha célula una célula de leucemia de linfocitos B Raji que comprende además un segundo determinante de superficie detectablemente marcado que es una molécula CD19.
21. Una célula de control según la reivindicación 15, siendo dicha célula una célula de leucemia no Hodgkin SU-DHL que comprende además un segundo determinante de superficie detectablemente marcado que es una molécula CD20. 15
22. Una célula de control según la reivindicación 15, siendo dicha célula una célula cancerosa de melanoma C32 que comprende además un segundo determinante de superficie detectablemente marcado que es una molécula CD146.
23. Una célula de control según cualquiera de las reivindicaciones 8 a 22, en la que dicho fijador de células se selecciona del grupo que consiste en paraformaldehído, formaldehído, glutaraldehído y glioxal.
24. Una célula de control según cualquiera de las reivindicaciones 8 a 23 en suspensión en un medio de densidad de 20 flotación.
25. Un procedimiento para detectar y enumerar células raras en una población de células mixtas comprendida en una muestra de sangre extraída de un sujeto de prueba, siendo la presencia de dichas células raras en dicha población indicativa de gravedad de un estado de enfermedad, que comprende:
a) preparar una muestra inmunomagnética en la que dicha muestra se mezcla con partículas magnéticas acopladas 25 a un ligando que reacciona específicamente con un determinante de las células raras para la exclusión sustancial de otros componentes de muestra;
b) poner en contacto dicha muestra inmunomagnética con al menos un reactivo que marca un determinante de dichas células raras; y
c) analizar dichas células raras marcada para determinar la presencia y el número de cualquier célula rara en dicha 30 muestra inmunomagnética, cuanto mayor sea el número de células raras presentes en dicha muestra, mayor será la gravedad de dicho estado de enfermedad,
caracterizado porque el procedimiento incluye la adición de una célula estabilizada según la reivindicación 8 para su uso como célula de control interno en dicho procedimiento.
26. Un procedimiento según la reivindicación 25, en el que dicha célula rara es una célula cancerosa y dicho estado de 35 enfermedad es cáncer.
27. Un procedimiento según la reivindicación 25 o la reivindicación 26, en el que dicha marca de membrana se selecciona del grupo que consiste en carbocianinas lipófilas de cadena larga, indocarbocianinas lipófilas de cadena larga, indodicarbocianinas lipófilas de cadena larga y análogos de las mismas, colorantes de aminoestirilo lipófilos, y análogos de cadena larga de colorantes de rodamina B C18 y fluoresceína C18. 40
28. Un procedimiento según cualquiera de las reivindicaciones 25 a 27, en el que dicho ligando es un anti-EpCAM y dicho reactivo marca una citoqueratina intracelular, estando dicho EpCAM y dicha citoqueratina presentes en tanto dicha célula rara como dicha célula de control.
29. Un procedimiento según la reivindicación 28, en el que la célula de control es una célula cáncer de mama SKBR3 que comprende además un segundo determinante de superficie detectablemente marcado seleccionado del grupo que consiste 45 en mamoglobulina, globulina de grasa láctea humana y HER-2/neu.
30. Un procedimiento según la reivindicación 28, en el que la célula de control es una célula de cáncer de mama MCF-7 que comprende además un segundo determinante de superficie detectablemente marcado que es un receptor estrogénico.
31. Un procedimiento según la reivindicación 28, en el que la célula de control es una célula de cáncer de próstata LNCaP que comprende además un segundo determinante de superficie detectablemente marcado seleccionado del grupo que 50
consiste en PSMA, PSA y receptor androgénico.
32. Un procedimiento según la reivindicación 28, en el que la célula de control es una célula cancerosa de leucemia de linfocitos T CEM que comprende además un segundo determinante de superficie detectablemente marcado que es una molécula CD4.
33. Un procedimiento según la reivindicación 28, en el que la célula de control es una célula de leucemia de linfocitos B Raji 5 que comprende además un segundo determinante de superficie detectablemente marcado que es una molécula CD19.
34. Un procedimiento según la reivindicación 28, en el que la célula de control es una célula de leucemia no Hodgkin SU-DHL que comprende además un segundo determinante de superficie detectablemente marcado que es una molécula CD20.
35. Un procedimiento según la reivindicación 28, en el que la célula de control es una célula cancerosa de melanoma C32 que comprende además un segundo determinante de superficie detectablemente marcado que es una molécula CD146. 10
36. Un kit para cribar una muestra de paciente para la presencia de células tumorales en circulación que comprende:
a) nanopartículas magnéticas recubiertas que comprenden un material de núcleo magnético, un material de recubrimiento basado en proteína y anti-EpCAM acoplado directa o indirectamente a dicho material de recubrimiento base;
b) al menos un anticuerpo que tiene especificidad de unión por un determinante de célula cancerosa; y 15
c) colorante específico de células para excluir componentes de muestra distintos de dichas células tumorales del análisis,
caracterizado porque el kit también incluye un recipiente que comprende células estabilizadas según la reivindicación 8 para uso como control interno.
37. Un kit según la reivindicación 36, en el que la célula de control es como se define en cualquiera de las reivindicaciones 20 16 a 22.
Patentes similares o relacionadas:
PROCEDIMIENTO Y DISPOSITIVO DE REGISTRO AUTOMÁTICO DE LA LOCOMOCIÓN DE NEMATODOS U ORGANISMOS PEQUEÑOS DE TAMAÑOS SIMILARES POR INTERFEROMETRÍA TEMPORAL DE MICROHACES DE LUZ, del 23 de Julio de 2020, de PHYLUMTECH S.A: Procedimiento y dispositivo de registro automático de la locomoción de nematodos u organismos pequeños de tamaños similares por interferometría temporal de microhaces […]
Monitor de aerosol en tiempo real, del 17 de Junio de 2020, de Wuxi Maitong Scientific Instrument Co., Ltd: Un monitor de aerosol en tiempo real, que comprende: un conjunto de fuente de luz láser , configurado para emitir un rayo láser y generar […]
Módulo transductor y método para usar el módulo transductor, del 6 de Mayo de 2020, de BECKMAN COULTER, INC.: Un módulo transductor para analizar una muestra de sangre completa, que comprende: una cubeta de lectura relativamente fija configurada […]
Método para evaluar el envejecimiento celular, del 6 de Mayo de 2020, de Sibelius Limited: Un método para tamizar y seleccionar al menos un compuesto de prueba que tiene un efecto sobre la vida útil cronológica de una población de organismos […]
Celdas de flujo óptico monolíticas y método de fabricación, del 15 de Abril de 2020, de BECKMAN COULTER, INC.: Método para producir una celda (30, 30', 30", 90) de flujo óptico monolítica, transparente, del tipo usado para caracterizar cuerpos formados que pasan a través de la misma, teniendo […]
Caracterización de partículas en cavidad de resonador óptico abierta, del 8 de Abril de 2020, de Oxford University Innovation Limited: Un método para detectar características de partículas polarizables en un fluido , el método que usa una cavidad óptica abierta que comprende […]
Método para producir microportadores, del 11 de Marzo de 2020, de MyCartis NV: Un método para producir microportadores que comprende las siguientes etapas: (a) proporcionar una oblea que tiene una estructura de tipo […]
Sistema y método para ajustar las mediciones de citometría, del 4 de Marzo de 2020, de BECTON, DICKINSON AND COMPANY: Un método para operar un citómetro de flujo que tiene un detector de dispersión frontal , un detector de dispersión lateral y una pluralidad de detectores de […]