BIOSINTESIS DE DERIVADOS DE MONACOLINA J.
Se describe un procedimiento para la obtención de derivados de monacolina J (I),
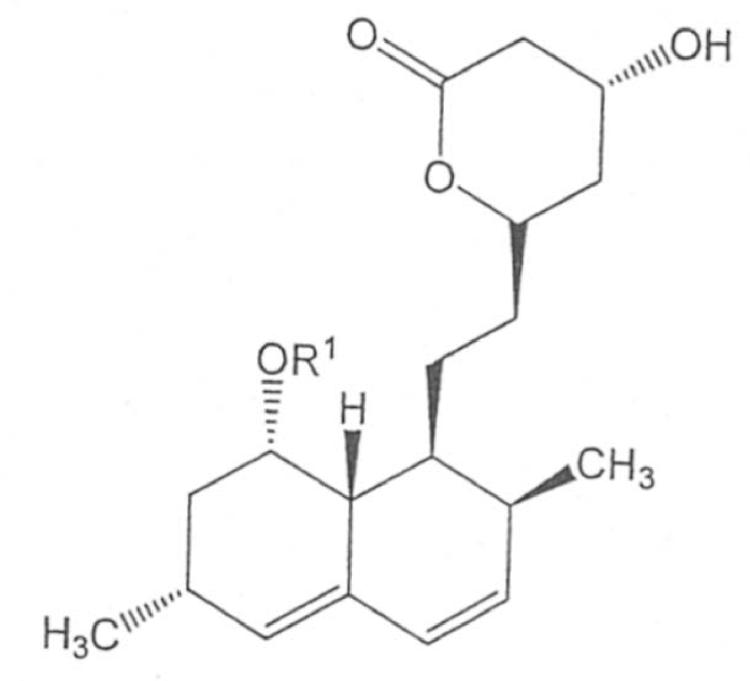
donde R{sup,1} es COR{sup,2}, donde R{sup,2} se selecciona entre alquilo C1-C15, cicloalquilo C3-C15, alquenilo C2-C15, alquinilo C2-C15, arilo y heterociclilo; que comprende la producción de monacolina J por fermentación a partir de un microorganismo productor de monacolina J y la acilación del grupo hidroxilo presente en la posición C8 de la monacolina J previamente obtenida mediante la adición al medio de fermentación de un agente acilante apropiado para obtener el derivado de monacolina J (I) deseado
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P200802971.
Solicitante: NEURON BIOPHARMA, S.A.
Nacionalidad solicitante: España.
Provincia: GRANADA.
Inventor/es: VELASCO ALVAREZ,JAVIER, CAMPOY GARCIA,SONIA, ADRIO FONDEVILA,JOSE LUIS, ZAFRA GOMEZ,ALBERTO.
Fecha de Solicitud: 15 de Octubre de 2008.
Fecha de Publicación: .
Fecha de Concesión: 31 de Mayo de 2011.
Clasificación Internacional de Patentes:
- A61K31/365 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Lactonas.
- C07D309/30 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 309/00 Compuestos heterocíclicos que contienen ciclos de seis miembros que tienen un átomo de oxígeno como único heteroátomo del ciclo, no condensados con otros ciclos. › Atomos de oxígeno, p. ej. delta-lactonas.
- C12P17/06 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12P PROCESOS DE FERMENTACION O PROCESOS QUE UTILIZAN ENZIMAS PARA LA SINTESIS DE UN COMPUESTO QUIMICO DADO O DE UNA COMPOSICION DADA, O PARA LA SEPARACION DE ISOMEROS OPTICOS A PARTIR DE UNA MEZCLA RACEMICA. › C12P 17/00 Preparación de compuestos heterocíclicos que contienen O, N, S, Se o Te como únicos heteroátomos del ciclo (C12P 13/04 - C12P 13/24 tienen prioridad). › que contienen un ciclo de seis miembros, p. ej. fluoresceína.
- C12R1/645 C12 […] › C12R SISTEMA DE INDEXACION ASOCIADO A LAS SUBCLASES C12C - C12Q, RELATIVO A LOS MICROORGANISMOS. › C12R 1/00 Microorganismos. › Hongos.
Clasificación PCT:
- A61K31/365 A61K 31/00 […] › Lactonas.
- C07D309/30 C07D 309/00 […] › Atomos de oxígeno, p. ej. delta-lactonas.
- C12P17/06 C12P 17/00 […] › que contienen un ciclo de seis miembros, p. ej. fluoresceína.
Fragmento de la descripción:
Biosíntesis de derivados de monacolina J.
Campo de la invención
La presente invención se refiere a un procedimiento para la obtención de derivados de monacolina J, un tipo de estatinas, que son compuestos con propiedades hipocolesterolémicas.
Antecedentes de la invención
Las estatinas constituyen un grupo de agentes hipocolesterolémicos que funcionan inhibiendo la enzima 3-hidroxi-3-metilglutaril-coenzima A (HMG-CoA) reductasa, la cuál cataliza el paso limitante de la biosíntesis celular de colesterol. Estos compuestos son utilizados para disminuir los altos niveles de colesterol asociados a las lipoproteínas de baja densidad (LDL) reduciendo el riesgo de infarto de miocardio y de muerte coronaria.
Las estatinas naturales (monacolina J, lovastatina, mevastatina y pravastatina) y semisintéticas (simvastatina) presentan una estructura poliquétida común, con un núcleo de hexahidronaftaleno al cual se le unen diferentes cadenas laterales en las posiciones C8 (R1) y C6 (R2), y un anillo lactónico, que en función de las condiciones aparece ciclado en forma de lactona o abierto dando lugar a los correspondientes hidroxiácidos (Fórmula A y Tabla 1).


Las rutas de biosíntesis de lovastatina en Aspergillus terreus y de mevastatina en Penicillium citrinum han sido descritas tanto desde el punto de vista bioquímico (Moore y col, J Am Chem Soc, 1985, 107, 3694-3701; Endo y col, J Antibiot, 1985, 38, 444-448) como a nivel molecular (Hendrickson y col, Chem Biol, 1999, 6, 429-439; Kennedy y col, Science, 1999, 284, 1368-1372), y en ella intervienen dos poliquétido sintasas de tipo I y numerosas enzimas. Concretamente, en el caso de la lovastatina, la lovastatina nonaquétido sintasa (LNS) codificada por el gen LovB, la enoil reductasa y citocromo P450 oxigenasas dan lugar a la monacolina J (Fórmula A, R1=OH, R2=CH3). Este intermedio no se acumula sino que directamente se le incorpora una cadena lateral mediante la actividad de la lovastatina diquétido sintasa (LDS), codificada por el gen LovF, y una acetil transferasa (LovD).
Además de A. terreus y P. citrinum se conocen otros microorganismos capaces de producir estatinas (lovastatina o mevastatina) tales como algunas especies de los géneros Monascus, Doratomyces, Eupenicillium, Gymnoascus, Hypomyces, Paecilomyces, Phoma, Trichoderma, Pleurotus, y levaduras tales como Pichia labacensis o Candida cariosilognicola (US 6.943.017).
La monacolina J se puede obtener a partir de caldos de cultivo de especies productoras de lovastatina pertenecientes al género Monascus (JP 55139396), o también al añadir monacolina K a cepas de hongos pertenecientes a diferentes géneros (ej. Mortierella, Emericella, Humicola, etc.) que hidrolizan la cadena lateral dando lugar a este intermediario (JP 60176595). Otra estrategia consiste en la clonación y expresión, en una cepa no productora de lovastatina, de un fragmento que contenga los genes de A. terreus necesarios para sintetizar monacolina J (US 6.943.017). Sin embargo, en todos estos casos, los rendimientos de monacolina J son bajos por lo que su producción no resulta rentable.
La simvastatina es un análogo semisintético de la lovastatina más eficaz en el tratamiento de la hipercolesterolemia debido a la substitución, por vía, química, de la cadena lateral de α-metilbutirato en la posición C8 (Fórmula A, R1) por una de α-dimetil butirato. Existen numerosos procedimientos químicos para realizar esta modificación que incluyen pasos de hidrólisis, lactonización, protección mediante sililación y acilación de la monacolina J protegida con cloruro de α-dimetil butirilo (CA 1.199.322; Hoffman y col, J Med Chem, 1986, 29, 849-852), aunque el rendimiento global es inferior al 40%. Se han descrito variaciones sobre este procedimiento en las patentes US 4.444.784, US 5.159.104 y US 4.450.171. En otro procedimiento, la lovastatina se hace reaccionar con una amina, y el diol de la amida resultante se protege y acila con yoduro de metilo y una base dando lugar a un diol que se lactoniza rindiendo simvastatina (US 4.820.850). En una variación mejorada de ese procedimiento, la protección de los grupos hidroxilo de la lovastatina se realiza con ácido fenil borónico (US 5.393.893). Otros procesos se basan en la obtención de nuevos intermedios al reaccionar la lovastatina con metoxietilamina (WO05066150), con monoalquilamidas o monocicloalquil-amidas (US 5.763.646), o al realizar una hidrólisis enzimática de la lovastatina, su lactonización y posteriores pasos de acilación e hidrólisis química o enzimática (WO05040107).
Todos estos procesos químicos requieren múltiples etapas, son laboriosos, las etapas de protección presentan unos rendimientos bajos, y el producto final presenta impurezas del compuesto no adiado. Todo ello contribuye a que el precio de la simvastatina sea unas cinco veces más elevado que el de la lovastatina.
Recientemente se ha descrito la síntesis de simvastatina mediante un procedimiento químico-biosintético a partir de lovastatina (Xie y col., Chem Biol, 2006, 13, 1161-1169; Xie y Tang, Appl Environ Microbiol, 2007, 73, 2054-2060; WO2007139871). El proceso parte de la obtención, por vía química, de monacolina J y de un substrato adiado (α-dimetilbutiril-S-metil-mentecapto- propionato) que se añaden a células en reposo, o en cultivo, de Escherichia coli capaces de sobreexpresar el gen LovD de A. terreus que codifica para una aciltransferasa. De esta forma, el substrato acilado, permeable a la membrana citoplasmática, se une a la monacolina J dando lugar a la simvastatina. Sin embargo, este procedimiento tiene limitaciones debido al elevado coste de los substratos y reactivos necesarios en las etapas de síntesis de monacolina J y α-dimetilbutiril-S-metil-mercaptopropionato, así como la degradación parcial del substrato acilado durante el proceso.
En base a estos antecedentes, resultaría necesario desarrollar procesos que solucionasen, desde el punto de vista económico y técnico, la desventaja de utilizar materias primas que implican un precio elevado, y que fuesen compatibles con el medio ambiente al prescindir o minimizar el uso de reactivos químicos o disolventes.
Compendio de la invención
Los autores de la presente invención han desarrollado un nuevo procedimiento para la producción de derivados de monacolina J, tales como simvastatina, etc., a partir de un proceso sencillo, económico y favorable desde el punto de vista medioambiental. Concretamente, el procedimiento comprende la obtención de monacolina J por fermentación y la acilación del grupo hidroxilo presente en la posición C8 de la monacolina J mediante la adición al medio de fermentación de agentes acilantes que actúan como precursores de la cadena lateral presente en dicha posición C8 en el derivado de monacolina J.
Por tanto, en un aspecto, la presente invención se relaciona con un procedimiento para la obtención de un derivado de monacolina J de fórmula (I) [definido más adelante] que comprende la producción de monacolina J por fermentación a partir de un microorganismo productor de monacolina J seguido de acilación del grupo hidroxilo presente en la posición C8 de la monacolina J mediante la adición al medio de fermentación de un agente acilante apropiado para obtener el derivado de monacolina J de fórmula (I) deseado.
En otro aspecto, la invención se relaciona con un microorganismo del género Neosartorya que tiene la capacidad de producir y acumular monacolina J en una concentración igual o superior a 50 mg/L. En una realización particular, dicho microorganismo es un microorganismo de la especie N. stramenia. En una realización concreta, dicho microorganismo es un microorganismo de la especie Neosartorya stramenia, depositado en la Colección Española de Cultivos Tipo (CECT) con número de acceso CECT 20472, que tiene la capacidad de producir y acumular monacolina J en una concentración igual o superior a 50 mg/L, o un mutante de dicho microorganismo que mantiene la capacidad de producir y acumular monacolina J en una concentración igual o superior a 50 mg/L. El empleo de dicho microorganismo para producir monacolina...
Reivindicaciones:
1. Un procedimiento para la obtención de un derivado de monacolina J de fórmula (I)

donde R1 es COR2, donde R2 se selecciona entre alquilo C1-C15, cicloalquilo C3-C15, alquenilo C2-C15, alquinilo C2-C15, arilo y heterociclilo;
que comprende las etapas de:
a) producción de monacolina J por fermentación a partir de un microorganismo productor de monacolina J; y
b) acilación del grupo hidroxilo presente en la posición C8 de la monacolina J obtenida en la etapa a) mediante la adición al medio de fermentación de un agente acilante apropiado para obtener el derivado de monacolina J de fórmula (I) deseado.
2. Procedimiento según la reivindicación 1, en el que dicho microorganismo productor de monacolina J es un microorganismo capaz de producir y acumular monacolina J en una concentración igual o superior a 50 mg/L.
3. Procedimiento según la reivindicación 1, en el que dicho microorganismo productor de monacolina J es un microorganismo perteneciente a un género seleccionado entre Aspergillus, Monascus, Penicillium, y Neosartorya.
4. Procedimiento según la reivindicación 1, en el que dicho microorganismo productor de monacolina J es N. stramenia.
5. Procedimiento según la reivindicación 1, en el que dicho. microorganismo productor de monacolina J es la cepa de Neosartorya stramenia CECT 20472.
6. Procedimiento según la reivindicación 1, en el que dicho agente acilante es un compuesto de fórmula (II)
donde
R2 tiene el significado previamente indicado en relación con la fórmula (I); o
un derivado del mismo seleccionado entre un halogenuro, un éster, una amida, un anhídrido o una sal de dicho ácido carboxílico de fórmula (II).
7. Procedimiento según la reivindicación 1, en el que dicho agente acilante se selecciona entre propionato sódico, 2,2-dimetilpropionato sódico, 2,2-dimetil butirato sódico y 2-metil butirato sódico.
8. Procedimiento según la reivindicación 1, en el que dicho derivado de monacolina J de fórmula (I) es un compuesto de fórmula (I) en el que R1 se selecciona entre propionilo, 2,2-dimetilpropionilo, 2-metilbutirilo (lovastatina) y 2,2-dimetilbutirilo (simvastatina).
9. Procedimiento según la reivindicación 1, que comprende, además, el aislamiento, y, opcionalmente, purificación, del derivado de monacolina J de fórmula (I) obtenido.
10. Un microorganismo del género Neosartorya, que tiene la capacidad de producir y acumular monacolina J en una concentración igual o superior a 50 mg/L.
11. Microorganismo según la reivindicación 10, caracterizado porque es un microorganismo de la especie Neosartorya stramenia depositado en la Colección Española de Cultivos Tipo (CECT) con número de acceso CECT 20472, que tiene la capacidad de producir y acumular monacolina J en una concentración igual o superior a 50 mg/L, o un mutante de dicho microorganismo que mantiene la capacidad de producir y acumular monacolina J en una concentración igual o superior a 50 mg/L.
12. Un cultivo biológicamente puro de un microorganismo según la reivindicación 10 ú 11.
13. Empleo de un microorganismo según cualquiera de las reivindicaciones 10 ú 11, para producir monacolina J o un derivado de monacolina J de fórmula (I) según la reivindicación 1.
14. Un procedimiento para identificar un microorganismo productor de monacolina J, que comprende:
a) incubar un cultivo de un microorganismo en una placa inoculada con un cultivo de Candida albicans bajo condiciones que permiten el crecimiento de dicha cepa y de C. albicans;
b) analizar la existencia de actividad antifúngica asociada a dicho microorganismo;
c) en caso de que dicho microorganismo no manifieste actividad antifúngica o manifieste una baja actividad antifúngica, recoger una muestra del cultivo de dicho microorganismo y analizarla para detectar y/o cuantificar monacolina J en dicha muestra; y
d) en caso de que dicho análisis ponga de manifiesto la presencia de monacolina J, identificar a dicho microorganismo como un microorganismo productor de monacolina J.
15. Procedimiento según la reivindicación 14, en el que la existencia de actividad fungicida asociada a dicho microorganismo se analiza mediante la formación de halos de inhibición de crecimiento de C. albicans.
16. Procedimiento según la reivindicación 14 ó 15, que comprende, además, utilizar un control positivo de actividad antifúngica.
17. Procedimiento según la reivindicación 16, que comprende seleccionar los microorganismos que muestran unos halos de inhibición de crecimiento de C. albicans de menor tamaño que el producido por dicho control.
18. Procedimiento según cualquiera de las reivindicaciones 14 a 17, en el que el microorganismo productor de monacolina J identificado es un microorganismo capaz de producir y acumular monacolina J en una concentración igual o superior a 50 mg/L.
Patentes similares o relacionadas:
Uso de (1R,2R)-3-(3-dimetilamino-1-etil-2-metil-propil)-fenol para tratar el dolor inflamatorio, del 22 de Julio de 2020, de GRUNENTHAL GMBH: (1R, 2R)-3-(3-Dimetilamino-1-etil-2-metil-propil)-fenol para uso en el tratamiento del dolor inflamatorio.
Derivados de podofilotoxina y su uso, del 3 de Junio de 2020, de CALIFORNIA PACIFIC MEDICAL CENTER: Un compuesto de fórmula (I): **(Ver fórmula)** o un N-óxido del mismo, o una sal farmacéuticamente aceptable de cada uno de los mismos, […]
Composiciones para el suministro de sensaciones de comodidad bucal, del 13 de Mayo de 2020, de THE PROCTER & GAMBLE COMPANY: Una composición para la higiene personal que comprende un agonista de TREK-1 para usar en la reducción de la sensibilidad dental y/o las molestias orales, en […]
Uso de butilideneftalida, del 25 de Marzo de 2020, de Everfront Biotech Inc: Una preparación para su uso en la disminución de la tasa de incidencia y/o tasa de recurrencia de cáncer oral al prevenir, mitigar y/o inhibir […]
Uso de un compuesto ftalida, del 11 de Marzo de 2020, de Everfront Biotech Inc: Ftalida para su uso en el tratamiento y/o el retardo de la aparición de la atrofia cerebelosa espinal, en el que el ftalida se selecciona del grupo que consiste en n-butilidenoftalida […]
Dimetilaminomiqueliolida para su uso en el tratamiento de fibrosis pulmonar, del 4 de Marzo de 2020, de Accendatech: Dimetilaminomiqueliolida para uso en un método de tratamiento de fibrosis pulmonar, en donde la dimetilaminomiqueliolida tiene la fórmula estructural molecular: **(Ver […]
Métodos y composiciones farmacéuticas para tratar la rabdomiólisis, del 1 de Enero de 2020, de INSERM (INSTITUT NATIONAL DE LA SANTE ET DE LA RECHERCHE MEDICALE): Un compuesto seleccionado del grupo que consiste en antagonistas de TLR9 e inhibidores de la expresión de TLR9 para su uso en el tratamiento de la rabdomiólisis […]
Cuerpos de cetona y ésteres de cuerpos de cetona como agentes reductores de lípidos de la sangre, del 13 de Noviembre de 2019, de Oxford University Innovation Limited: Una composición para uso en un procedimiento terapéutico para reducir o disminuir los niveles de colesterol en suero y/o los niveles de triglicéridos […]