ANTICUERPOS ESPECÍFICOS DEL proBNP(1-108) Y SU UTILIZACIÓN PARA EL DIAGNÓSTICO DE LA INSUFICIENCIA CARDIACA.
Anticuerpo anti proBNP(1- 108) caracterizado porque, por una parte,
reconoce un epítope que comprende la secuencia RAPR76S77P (SEQ ID Nº 5) del proBNP(1-108) y no reconoce sustancialmente los péptidos BNP (1-76) ni el BNP (77-108), y, por otra parte, tiene la capacidad de reconocer específicamente el proBNP (1- 108) circulante en muestras séricas o plasmáticas humanas
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/FR2003/002483.
Solicitante: BIO-RAD PASTEUR
CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE (CNRS)
UNIVERSITÉ MONTPELLIER I.
Nacionalidad solicitante: Francia.
Dirección: 3, BOULEVARD RAYMOND POINCARÉ 92430 MARNES-LA-COQUETTE FRANCIA.
Inventor/es: RIEUNIER, FRANCOIS, PAU, BERNARD, GIULIANI,Isabelle.
Fecha de Publicación: .
Fecha Solicitud PCT: 7 de Agosto de 2003.
Clasificación Internacional de Patentes:
- C07K14/58 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Complejo del factor natriurético atrial; Atriopeptina; Péptido natriurético atrial (ANP); Cardionatrina; Cardiodilatina.
- C07K16/26 C07K […] › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › contra hormonas.
Clasificación PCT:
- C07K16/06 C07K 16/00 […] › del suero.
- C07K16/26 C07K 16/00 […] › contra hormonas.
- C07K7/06 C07K […] › C07K 7/00 Péptidos con 5 a 20 aminoácidos en una secuencia totalmente determinada; Sus derivados. › con 5 a 11 aminoácidos.
- C07K7/08 C07K 7/00 […] › con 12 a 20 aminoácidos.
- C12N5/12 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › Células fusionadas, p. ej. hibridomas.
- C12N5/20 C12N 5/00 […] › siendo uno de los integrantes de la fusión un linfocito B.
- G01N33/53 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › Ensayos inmunológicos; Ensayos en los que interviene la formación de uniones bioespecíficas; Materiales a este efecto.
- G01N33/74 G01N 33/00 […] › en los que intervienen hormonas.
Clasificación antigua:
- C07K16/06 C07K 16/00 […] › del suero.
- C07K16/26 C07K 16/00 […] › contra hormonas.
- C07K7/06 C07K 7/00 […] › con 5 a 11 aminoácidos.
- C07K7/08 C07K 7/00 […] › con 12 a 20 aminoácidos.
- C12N5/12 C12N 5/00 […] › Células fusionadas, p. ej. hibridomas.
- C12N5/20 C12N 5/00 […] › siendo uno de los integrantes de la fusión un linfocito B.
- G01N33/53 G01N 33/00 […] › Ensayos inmunológicos; Ensayos en los que interviene la formación de uniones bioespecíficas; Materiales a este efecto.
- G01N33/74 G01N 33/00 […] › en los que intervienen hormonas.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
Fragmento de la descripción:
La invención se refiere al campo del diagnóstico in vitro de la insuficiencia cardiaca ventricular. La insuficiencia cardiaca (Congestive heart failure) es un síndrome clínico frecuente, en particular en las personas mayores. Se presenta habitualmente en forma de disparo insidioso de síntomas no específicos tales como tos al esfuerzo, fatiga, aparición de edemas periféricos. El diagnóstico reposa clásicamente en el estudio de diversos 5 parámetros tales como signos clínicos (clasificados en 4 estadios, estadios I a IV de la NYHA, es decir, de la Asociación de Cardiología de Nueva York), ecocardiografía, escintigrafía, prueba de esfuerzo, etc.
Debido a la gravedad de a enfermedad cardiaca, y también de los costes elevados de su tratamiento, un diagnóstico precoz de este síndrome es, evidentemente, muy deseable: contribuiría a evitar la progresión rápida del síndrome hacia la insuficiencia cardiaca severa. Identificar a las personas con riesgo de insuficiencia cardiaca es 10 por lo tanto una necesidad. Esto permitiría también adaptar un seguimiento terapéutico más rápido, más fácil y menos costoso. Desgraciadamente, no existe un procedimiento diagnóstico de la insuficiencia cardiaca totalmente satisfactorio y totalmente informativo.
Se han buscado desde hace mucho marcadores presintomáticos predictivos de la insuficiencia cardiaca. Con este fin, se ha puesto de manifiesto el hecho de que los cardiomiocitos fabrican y secretan péptidos con actividad 15 natriurética: un péptido de origen auricular, el ANP (Atrial Natriurectic Peptide) descubierto en la rata por de Bold et al. Life Science 1981, vol. 28(1) : 89-94, y un péptido natriurético de origen auriculo-ventricular denominado BNP (Brain Natriuretic Peptide) descubierto por Sudoh et al., Nature 1988, vol. 332 : 78-81 en el cerdo, y a continuación en el hombre.
El precursor del BNP es el preproBNP (1-134), forma de almacenamiento de la molécula en el interior de los 20 cardiomiocitos. Este se cliva para liberar un péptido señal y el proBNP (1-108). El proBNP (1-108) consiste en un polipéptido de 108 aminoácidos, de secuencia:
H1PLGSPGSASDLETSGLQEQRNHLQGKLSELQVEQTSLEPLQESPRPTGV WKSREVATEGIRGHRKMVLYTLRAPR78S77PKMVQGSGCFGRKMDRISSSSG LGCKVLRRH108 (SEQ ID Nº 1).
Se cliva, antes y/o durante su secreción, entre los aminoácidos Arg78 y Ser77 en, por una parte, el BNP, también 25 designado BNP (77-108) o BNP-32, incluso BNP (1-32), y la parte N-terminal de la prohormona, el BNP (1-76), también designado fragmento N-terminal de proBNP o NT-proBNP.
El BNP o BNP (77-108), forma vasoréactiva de la molécula, consiste en un péptido de 32 aminoácidos, de secuencia: S77PKMVQGSGCFGRKMDRISSSSGLGCKVLRRH108 (SEQ ID Nº 2). 30
El NT-proBNP o BNP(1-76) consiste en los 76 aminoácidos N-terminales del proBNP(1-108) que constituyen la siguiente secuencia:
H1PLGSPGSASDLETSGLQEQRNHLQGKLSELQVEQTSLEPLQESPRPTGV WKSREVATEGIRGHRKMVLYTLRAPR76 (SEQ ID Nº 3).
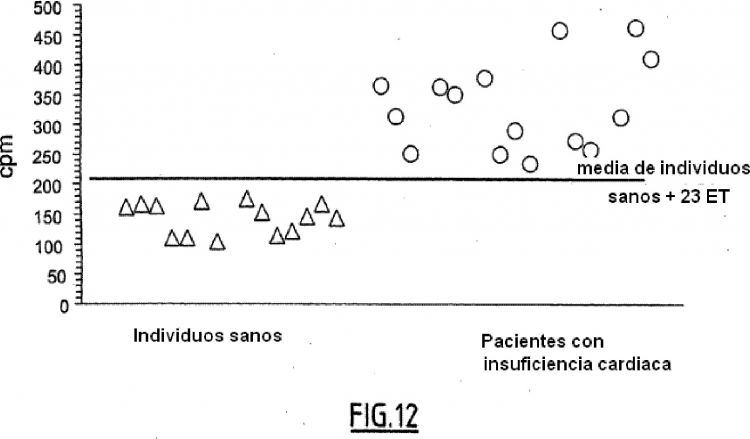
La tasa plasmática de BNP hormonal, el BNP (77-108), es elevada en los pacientes que presentan una 35 distrofia ventricular. Se han descrito asimismo determinaciones plasmáticas del BNP(77-108) utilizánbdolo como marcador predictivo de la insuficiencia cardiaca ventricular. Sin embargo, es bien sabido que la hormona BNP(77-108) es poco estable. De ello resulta que su determinación necesita precauciones particulares (Davidson, N. C. et al. Circulation 1995; 91:1276) (Gobinet-Georges et al. Clin. Chem. Lab. Med. 2000; ademá la semivida del BNP muy corta y su concentración plasmática es poco elevada. De ello se resulta que se observa un cierto número de 40 respuestas falsamente negativas en sujetos con riesgo de insuficiencia cardiaca. De este modo la determinación del BNP (77-108) no permite discriminar correctamente los pacientes en estadio I de la clasificación NYHA, de los individuos sanos (Clerico A. et al. J. Endocrinol. Invest. 1998 ; 21:170-9) (Del Ry S. et al. Scand. J. Clin. Lab. Invest. 2000; 60:81-90).
Para solventar esta dificultar, la solicitud de patente WO 93/24531 describe un procedimiento de 45 diagnóstico in vitro de la insuficiencia cardiaca que descansa sobre la detección del BNP (1-76) (fragmento N-terminal del proBNP), un compuesto abundante y que tiene una larga semivida en comparación con la de la hormona BNP (77-108). Sin embargo, el procedimiento descrito en la solicitud WO 93/24531 no parece simple de aplicar al BNP (1-76) en muestras sanguíneas. En efecto, los únicos ejemplos mostrados se realizan, no en sueros reales, sino en gamas patrón obtenidas con la ayuda de un péptido sintético, el péptido BNP (47-64), (38:519-23) 50 del BNP (1-76). Para paliar este inconveniente, un sistema automatizado muy sofisticado se ha revelado, desde
entonces, necesario.
El artículo Hunt et al. Biochemical and Biophysical Research Communications, vol. 214(3), 1995, pp. 1175-1183 describe una determinación RIA de tipo competitivo del BNP(1-76) sobre plasmas de pacientes que padecen insuficiencia cardiaca, haciendo intervenir un antisuero dirigido contra el fragmento N-terminal del proBNP(1-13). El artículo muestra precisamente que, en pacientes con insuficiencia cardiaca, la tasa de BNP(1-76), muy bien 5 correlacionada con la del BNP(77-108), es considerablemente elevada respecto de la tasa observada en los individuos testigo. Sin embargo, el protocolo descrito para extraer específicamente el único BNP (1-76) plasmático es complejo, ya que necesita una extracción del plasma sobre cartucho Sep-pak C18 TM (Millipore-Waters), seguida de una cromatografía HPLC. Por otra parte, este artículo subraya que, en la determinación RIA así aplicada, el proBNP (1-108) no parece reconocido. Sugiere más bien que el proBNP(1-108) podría ser secretado en 10 la circulación a partir del tejido cardiaco pero sería a continuación rápidamente degradado en un péptido más pequeño, por clivado de los ácidos N-terminales. O también, según el artículo, el proBNP(1-108) se presentaría de tal manera que el antisuero anti-proBNP(1-108) sería incapaz de ligarse al mismo. Finalmente, los autores sugieren que el BNP (1-76) (fragmento N-terminal del proBNP) podría incluso ser un marcador más específico de la disfunción cardiaca que el BNP (77-108) o que el fragmento N-terminal del proANP 15
El artículo Karl et al. (Scand. J. Clin. Lab. Invest. 1999; 59(supl 230): 177-181) describe un procedimiento de detección del BNP(1-76) similar al de la solicitud de patente W093/24531, pero no proporciona ningún resultadp obtenido en las muestras de pacientes.
El artículo Schulz et al. Scand. J. Clin. Lab. Invest., 2001, vol. 61, pp. 33-42, describe igualmente una determinación radioinmunológica específica del BNP (1-76) (fragmento N-terminal del proBNP), sin extracción, con 20 la ayuda de un antisuero dirigido contra los aminoácidos 1-21 de este fragmento. Los autores confirman el interés de la determinación del BNP (1-76) en el diagnóstico de la insuficiencia cardiaca ventricular así como su buena correlación con la determinación del BNP(77-108). Durante un estudio de las diferentes formas circulantes del proBNP(1-108), avanzan la hipótesis que el proBNP(1-108) circularía en la sangre, a la vez en forma de prohormona intacta y de productos de clivado, BNP (1-76) (fragmento N-terminal del proBNP) y BNP (77-108). Sin 25 embargo, no se dice nada ni se sugiere nada en el artículo relativo a una eventual actividad fisiológica del proBNP (1-108) o un interés diagnóstico cualquiera del proBNP(1-108) como marcador predictivo o diagnóstico de la insuficiencia cardiaca ventricular.
El artículo Shimizu et al. Clinica Chimica Acta, 2002, vol. 316, pp. 129-135, presenta un estudio sobre la degradación del BNP humano en la sangre y las formas moleculares circulantes de BNP inmunorreactivo en el 30 plasma de individuos con insuficiencia cardiaca. Observa en el plasma de estos últimos la presencia de dos formas de BNP inmunorreactivo: un BNP de gran peso molecular (de 36 KD, que podría corresponder a un trimero del proBNP(1- 108)) y un BNP de bajo peso molecular. Este último corresponde a la presencia simultánea de una forma de producto de degradación del BNP-32 que ha perdido la serina y la prolina N-terminales (des-SerPro-BNP (BNP3-32)) de la forma hormonal del BNP-32 (denominada aquí BNP(1-32)). El proBNP(1-108) y el BNP hormonal (BNP-35 32, BNP (1-32) también BNP(77-108)) son por lo tanto secretados por el corazón en la sangre. Sin embargo, los autores parecen sugerir que el proBNP (1-108) bajo su forma oligomerizada (trimero) está presente...
Reivindicaciones:
1. Anticuerpo anti proBNP(1- 108) caracterizado porque, por una parte, reconoce un epítope que comprende la secuencia RAPR76S77P (SEQ ID Nº 5) del proBNP(1-108) y no reconoce sustancialmente los péptidos BNP (1-76) ni el BNP (77-108), y, por otra parte, tiene la capacidad de reconocer específicamente el proBNP (1-108) circulante en muestras séricas o plasmáticas humanas. 5
2. Anticuerpo anti proBNP(1-108) según la reivindicación 1 que reconoce de manera específica la secuencia V70TLRAPR76S77PKMVQGSG85 (SEQ ID Nº4) del proBNP(1-108).
3. Anticuerpo anti proBNP(1-108) según la reivindicación 1 que reconoce de manera específica la secuencia Y70TLRAPR78S77PKMVQGS84 (SEQ ID Nº108) del proBNP(1-108).
4. Anticuerpo anti proBNP(1-108) según una de las reivindicaciones 1 a 3, dicho anticuerpo es monoclonal. 10
5. Anticuerpo anti proBNP(1-108) según la reivindicación 4, secretado por el hibridoma 3D4 registrado en la CNCM con el Nº CNCM I-3073.
6. Hibridoma que produce un anticuerpo tal como se ha definido en la reivindicación 5, denominado 3D4 y registrado en la CNCM con el Nº CNCM I-3073.
7. Péptido de fórmula: 15
a1-X1-RAPRSP-X2-a2 (I)
en la que
a1 puede ser H o representar una función o un grupo químico elegido entre una función tiol, alcohol, aminoxi, amina primaria o secundaria, un grupo aminocarboxilo, un grupo biotinilo y un grupo acetilo,
X1 representa una secuencia peptídica de 0 a 3 aminoácidos, procedente de la secuencia natural del 20 proBNP(1-108) o no,
X2 representa una secuencia peptídica de 0 a 7 aminoácidos, procedente de la secuencia natural del proBNP(1-108) o no,
a2 puede representar una función OH, NH2 o un grupo alcoxilo.
8. Péptido de fórmula: 25
X-Y70TLRAPR76S77PKMVQGSG85- Z (II)
en la que X puede ser H o representar bien un grupo acetilo, bien 1 a 3 aminoácidos no pertenecientes a la secuencia del proBNP (1-108), y en la que Z puede representar una función OH, o 1 a 3 aminoácidos no pertenecientes a la secuencia del proBNP(1-108).
9. Péptido según la reivindicación 8, que tiene la secuencia X-Y70TLRAPR76S77PKMVQGSG85- Z (SEQ ID 30 Nº4)
10. Péptido de fórmula
X-Y70TLRAPR76S77PKMVQGS84- Z (III)
en la que X puede ser H o representar bien un grupo acetilo, bien 1 a 3 aminoácidos no pertenecientes a la secuencia del proBNP (1-108), y en la que Z puede representar una función OH, o 1 a 3 aminoácidos no 35 pertenecientes a la secuencia del proBNP(1-108).
11. Péptido según la reivindicación 10, que tiene la secuencia Y70TLRAPR76S77PKMVQGS84 (SEQ ID Nº 108)
12. Péptido que comprende una secuencia derivada de la secuencia del péptido de fórmula (II) tal como se ha definido en la reivindicación 8 o del péptido de fórmula (III) tal como se ha definido en la reivindicación 10 por sustitución de uno o más aminoácidos entre los aminoácidos Y70, T71, L72, K79, M80, V81, Q82, G83, S84 y G85. 40
13. Péptido según la reivindicación 7, que tiene una secuencia elegida en el grupo constituido por las
siguientes secuencias:
SEQ ID Nº 16:C-Y-T-L-R-A-P-R-S-P-K-M-V-Q-G-S-G (péptido C13P30)
SEQ ID Nº 109: C-Y-T-L-R-A-P-R-S-P-K-M-V-Q-G-S (péptido CN32)
SEQ ID Nº 6: C-G-R-A-P-R-S-P
SEQ ID Nº 7: Acetil -C-G-R-A-P-R-S-P 5
SEQ ID Nº 8: C-G-R-A-P-R-S-P-K
SEQ ID Nº 9: Acetil -C-G-R-A-P-R-S-P-K
SEQ ID Nº 10 C-G-R-A-P-R-S-P-K-M-V
SEQ ID Nº 11: C-G-R-A-P-R-S-P-K-M-V-Q-G-S-G
SEQ ID Nº 12: R-A-P-R-S-P-G-C 10
SEQ ID Nº 13: Acetil -R-A-P-R-S-P-G-C
SEQ ID Nº 110: C-Y-T-L-R-A-P-R-S-P-K
SEQ ID Nº 111: C-Y-T-L-R-A-P-R-S-P-K-M-V
SEQ ID Nº 112: C-Y-T-L-R-A-P-R-S-P-K-M-V-Q
SEQ ID Nº 113: C-Y-T-L-R-A-P-R-S-P-K-M-V-Q-G 15
SEQ I D N 19:C-Y-T-L-R-A-P-R-S-P-K-M-V-Q-G-S-BA
SEQ ID Nº 20: C-Y-T-L-R-A-P-R-S-P-K-M-V-Q-A-T-A
SEQ ID Nº 114: Acetil -C-T-L-R-A-P-R-S-P-K -M-V-Q
SEQ ID Nº 115: C-T-L-R-A-P-R-S-P-K -M-V-Q-G
SEQ ID Nº 116: C-T-L-R-A-P-R-S-P-K -M-V-Q-G-S 20
SEQ ID Nº 117: C-T-L-R-A-P-R-S-P-K -M-V-Q-G-S-G
SEQ ID Nº 118: C-L-R-A-P-R-S-P-K -M-V
SEQ ID Nº 119: C-L-R-A-P-R-S-P-K -M-V-Q
SEQ ID Nº 120: L-R-A-P-R-S-P-K -M-V-Q-C
SEQ ID Nº 121 C-L-R-A-P-R-S-P-K -M-V-Q-G-S 25
SEQ ID Nº 122 C-L-R-A-P-R-S-P-K -M-V-Q-G-S-G
14. Kit de detección del proBNP (1-108) en una muestra biológica, que contiene al menos un anticuerpo tal como se ha definido en una de las reivindicaciones 1 a 5.
15. Kit de detección del proBNP (1-108) en una muestra biológica, que contiene, como patrón y/o testigo, al menos un péptido según se ha definido en una de las reivindicaciones 7 a 13. 30
16. Kit de detección del proBNP(1-108) en una muestra biológica según la reivindicación 14 o 15, que contiene:
(i) en un recipiente, a menos un anticuerpo tal como se ha definido en una de las reivindicaciones 1 a 5,
(ii) en otro recipiente, al menos un péptido tal como se ha definido en una de las reivindicaciones 7 a 13.
17. Procedimiento de obtención de un anticuerpo anti proBNP(1-108) tal como se ha definido en una de las reivindicaciones 1, 2 y 3 en el que se inmuniza un animal con la molécula entera de proBNP(1-108), y a continuación se agota, con la ayuda del péptido BNP(77-108) y/o del péptido BNP(1-76), el antisuero obtenido.
18. Procedimiento de obtención de un anticuerpo anti proBNP(1-108) tal como se ha definido en una de las reivindicaciones 1, 2 y 3 en el que se inmuniza un animal con un péptido tal como se ha definido en una de las 5 reivindicaciones 7 a 13, y eventualmente se agota con la ayuda del péptido BNP(77-108) y/o del péptido BNP(1-76), el antisuero obtenido.
19. Procedimiento de obtención de hibridoma secretor de anticuerpos anti proBNP (1-108) tal como se ha definido en la reivindicación 4 o 5, en el cual
- se inmuniza un animal con un péptido tal como se ha definido en una de las reivindicaciones 7 a 13, 10
- se toman linfocitos secretores de inmunoglobulinas de este animal,
- se procede a una fusión de los linfocitos con células de mieloma para obtener al menos un hibridoma secretor de inmunoglobulinas,
- y se selecciona un hibridoma secretor de anticuerpos monoclonales específicos.
20. Procedimiento según una de las reivindicaciones 18 y 19, en el cual el péptido es un péptido de fórmula (II) 15 que tiene la secuencia Y70TLRAPR76S77PKMVQGSG85 (SEQ ID Nº 4).
21. Procedimiento según una de las reivindicaciones 18 y 19, en el cual el péptido es un péptido de fórmula (III) que tiene la secuencia Y70TLRAPR76S77PKMVQGS84 (SEQ ID Nº 108).
22. Procedimiento de diagnóstico in vitro de la insuficiencia cardiaca en un humano que comprende la puesta en contacto de una muestra biológica con un anticuerpo anti proBNP (1-108), tal como se ha definido en una de las 20 reivindicaciones 1 a 5, y la detección del proBNP(1- 108) en la muestra.
23. Procedimiento de diagnóstico in vitro de la insuficiencia cardiaca en un ser humano que comprende;
a) la puesta en contacto de una muestra biológica con un anticuerpo anti proBNP (1-108) tal como se ha definido en una de las reivindicaciones 1 a 5,
b) la incubación de la mezcla en condiciones que permiten la formación de complejos antígenos-anticuerpos; 25 y
c) el revelado de los complejos antígenos-anticuerpos formados,
eventualmente con la ayuda de un anticuerpo de detección marcado, capaz de ligarse específicamente al proBNP (1-108) presente en el primer complejo, o con la ayuda de un antígeno de detección, marcado, capaz de ligarse al anticuerpo dirigido contra dicho proBNP(1-108) presente en el primer complejo. 30
24. Procedimiento de diagnóstico según la reivindicación 23 que comprende, además, una etapa d) de correlación de la cantidad de los complejos antígenos-anticuerpos revelados en el estado clínico del individuo.
Patentes similares o relacionadas:
Ligandos que potencian la bioactividad de las gonadotrofinas, del 8 de Abril de 2020, de ReproPharm Vet: Ligando de la hormona foliculoestimulante (FSH) que potencia la bioactividad de FSH, hormona luteinizante (LH) y gonadotropina coriónica (CG), caracterizado […]
Anticuerpos antineurotensina y usos los mismos, del 12 de Febrero de 2020, de INSERM (INSTITUT NATIONAL DE LA SANTE ET DE LA RECHERCHE MEDICALE): Un anticuerpo neutralizante que se une a neurotensina humana y que comprende una región variable de cadena pesada que comprende la SEQ ID […]
Método y kit para detectar 1,25-dihidroxivitamina D y anticuerpos relacionados, del 15 de Enero de 2020, de DIASORIN S.P.A: Anticuerpo monoclonal que se une al dominio de unión a ligando del complejo receptor de vitamina D (VDR-LBV)/1,25-dihidroxivitamina D, en el que las secuencias […]
Anticuerpo antiadrenomedulina (ADM) o fragmento de anticuerpo anti-ADM o andamiaje no Ig anti-ADM para la prevención o la reducción de una disfunción orgánica o una insuficiencia orgánica en un paciente que presenta una enfermedad crónica o aguda o una afección aguda, del 5 de Noviembre de 2019, de AdrenoMed AG: Anticuerpo antiadrenomedulina (ADM) o fragmento de anticuerpo anti-ADM que se une a adrenomedulina o andamiaje no Ig anti-ADM que se une a la adrenomedulina para […]
 Anticuerpo anti-adrenomedulina (ADM) o fragmento de anticuerpo anti-ADM o armazón no Ig anti-ADM para uso en la terapia de una enfermedad aguda o una afección aguda de un paciente para estabilizar la circulación, del 25 de Septiembre de 2019, de AdrenoMed AG: Un anticuerpo anti-adrenomedulina (ADM) o un fragmento de anticuerpo anti-ADM que se une a adrenomedulina o un armazón no Ig anti-ADM que se une a […]
Anticuerpo anti-adrenomedulina (ADM) o fragmento de anticuerpo anti-ADM o armazón no Ig anti-ADM para uso en la terapia de una enfermedad aguda o una afección aguda de un paciente para estabilizar la circulación, del 25 de Septiembre de 2019, de AdrenoMed AG: Un anticuerpo anti-adrenomedulina (ADM) o un fragmento de anticuerpo anti-ADM que se une a adrenomedulina o un armazón no Ig anti-ADM que se une a […]
Anticuerpos anti-neurotensina y usos de los mismos, del 21 de Agosto de 2019, de INSTITUT NATIONAL DE LA SANTE ET DE LA RECHERCHE MEDICALE (INSERM): Un anticuerpo neutralizador que se une al fragmento largo de la neurotensina humana como se expone en SEQ ID NO:9, y que tiene una región variable de la cadena pesada que comprende […]
Profilaxis de cáncer colorrectal y gastrointestinal, del 21 de Agosto de 2019, de Progastrine et Cancers S.à r.l: Anticuerpo monoclonal antiprogastrina humana (hPG) neutralizante para la utilización en la prevención del cáncer gastrointestinal en un sujeto humano, que comprende administrar […]
Medios y métodos de medición de la hormona paratiroidea en pacientes que sufren de estrés oxidativo, del 11 de Junio de 2019, de IMMUNDIAGNOSTIK AG: Método para obtener moléculas de anticuerpos monoclonales específicos para el péptido de la hormona paratiroidea humana (hPTH) inactivada oxidativamente y sus […]