UTILIZACION DEL VECTOR PIL8+ DE TRUCHA COMO INMUNOESTIMULANTE O ADYUVANTE PARA VACUNAS ADN EN PECES.
Utilización del vector pIL8+ de trucha como inmunoestimulante o adyuvante para vacunas ADN en peces.
Procedimiento para inmunizar peces de cultivo industrial contra la infección de rabdovirus, que comprende la administración de: a) una vacuna ADN que induce una respuesta inmune en los peces contra la infección de rabdovirus, en una cantidad inferior a la que produciría un 100% de protección imunogénica; y b) un coadyuvante obtenido por clonación de la interleuquina-b (IL-8) de trucha en una cantidad suficiente para aumentar el efecto de la vacuna (a) entre un 10% y un 60%. Los peces son Truchas Arco Iris (Oncorhynchus mykiss). Los rabdovirus son el virus de la septicemia hemorrágica viral (VHSV) y el virus de la necrosis hematopoiética infecciosa (IHNV). El coadyuvante (b) es un plásmido denominado pIL8+ obtenido por clonación de la región codificante del gen de la IL-8 de Trucha Arco Iris en un vector de expresión eucariota. También incluye la composición farmacéutica y/o el kitconteniendo (a) y (b)
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P200700563.
Solicitante: INSTITUTO NACIONAL DE INVESTIGACION Y TECNOLOGIA AGRARIA Y ALIMENTARIA (INIA).
Nacionalidad solicitante: España.
Provincia: MADRID.
Inventor/es: TAFALLA PIEIRO,CAROLINA, COL MORALES,JULIO.
Fecha de Solicitud: 2 de Marzo de 2007.
Fecha de Publicación: .
Fecha de Concesión: 1 de Marzo de 2010.
Clasificación Internacional de Patentes:
- C12N7/00 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › Virus, p. ej. bacteriófagos; Composiciones que los contienen; Su preparación o purificación (preparaciones de uso médico que contienen virus A61K 35/76; preparación de composiciones de uso médico que contienen antígenos o anticuerpos virales, p. ej. vacunas virales, A61K 39/00).
Clasificación PCT:
- C12N7/00 C12N […] › Virus, p. ej. bacteriófagos; Composiciones que los contienen; Su preparación o purificación (preparaciones de uso médico que contienen virus A61K 35/76; preparación de composiciones de uso médico que contienen antígenos o anticuerpos virales, p. ej. vacunas virales, A61K 39/00).
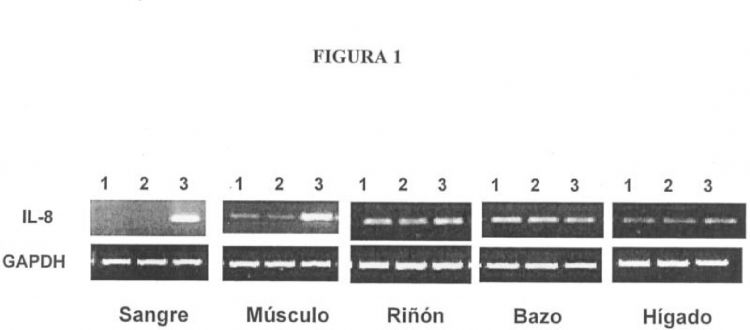
Fragmento de la descripción:
Utilización del vector pIL8+ de trucha como inmunoestimulante o adyuvante para vacunas ADN en peces.
Sector de la técnica
La presente invención se refiere a la utilización del vector pIL8+ obtenido de Trucha Arco Iris (Oncorhynchus mykiss) como inmunoestimulante o adyuvante para vacunas ADN para prevenir la infección de peces por virus. La presente invención también se refiere al procedimiento y dosis de utilización de dicho vector pIL8+ como adyuvante de las vacunas ADN concretamente frente a los rabdovirus, tales como el virus de la septicemia hemorrágica viral (VHSV) y el virus de la necrosis hematopoiética infecciosa IHNV). La presente invención también se refiere a una composición farmacéutica para inmunizar truchas contra el VHSV y el IHNV, que comprende una vacuna ADN y el pIL8+ como adyuvante.
Estado de la técnica
La población mundial es actualmente de 6 billones de personas y se estima que en el año 2050, seamos alrededor 9 billones. Este aumento de la población se traduce en un aumento del consumo de alimentos y también de pescado y mariscos. Así, desde el año 1991 al 97, se produjo un aumento en el consumo mundial de pescado y mariscos aproximadamente 10 millones de toneladas métricas. Pero los recursos pesqueros no son inagotables y es por ello que la FAO, en mayo de 1998 llamo la atención a la comunidad internacional para que se redujera en un 30% la capacidad pesquera mundial. Para contrarrestar este descenso en las capturas pesqueras, la acuicultura se ha desarrollado enormemente, duplicando su producción durante los años 92-97. En la actualidad 1 de cada 3 pescados o mariscos consumidos, se produjo en una instalación de acuicultura. Uno de los graves problemas que puede frenar el desarrollo de la acuicultura son las enfermedades, fundamentalmente las producidas por virus. Se estima que alrededor del 10% de las especies acuáticas cultivadas, murió como consecuencia de enfermedades, la mayoría de ellas víricas. Por ejemplo en 1991, 1 millón de toneladas de trucha murieron en los Estados Unidos, como consecuencia de una infección por el Virus de la Necrosis Hematopoyética Infecciosa (IHNV).
El impacto económico que estas enfermedades provocan en la acuicultura mundial es muy grande y por ello es necesario desarrollar estrategias de prevención (vacunas) de estas enfermedades.
Las primeras vacunas contra enfermedades bacterianas en las piscifactorías se desarrollaron en los 1970s, y se introdujeron en la acuicultura comercial en los 1980s. Como consecuencia ha disminuido grandemente la utilización de antibióticos lo que ha contribuido a una mayor aceptación de los peces crecidos en piscifactorías por parte del consumidor. Además, la salud de los peces ha mejorado notablemente desde la introducción de las vacunas.
Así, para la prevención de estas enfermedades virales nuevas vacunas están siendo desarrolladas. En concreto, los niveles de protección obtenidos con las recientes vacunas ADN no habían sido obtenidos con ninguna de las vacunas anteriores. Es por ello, por lo que se está trabajando en el diseño de vacunas de ADN más seguras y eficaces para controlar enfermedades víricas.
Entre los virus de peces que mayor impacto económico causan en la piscicultura europea destacan los rabdovirus. Los rabdovirus afectan, tanto a especies de peces tradicionalmente cultivadas (trucha, salmón, carpa), como a especies con perspectivas de incipiente cultivo y futuro desarrollo (lubina, rodaballo, anguila) y también a especies silvestres (carpa, Lucio) incluidos incluso algunos crustáceos cultivados (langostinos).
De todos los virus de peces actualmente conocidos, los rabdovirus junto con los birnavirus constituyen el grupo más numeroso y más extendido por todo el mundo. De estos dos grupos, los rabdovirus tienen una mayor incidencia económica porque causan altas mortalidades en adultos. Entre los rabdovirus de peces que se han aislado e identificado en Europa destacan los que afectan a peces de agua fría como el virus de la Septicemia Hemorrágica Vírica y el virus de la Necrosis Hematopoyética Infecciosa, conocidos por sus iniciales en inglés VHSV e IHNV respectivamente.
Entre un 20% y un 40% del tonelaje anual se pierde por rabdovirosis a nivel mundial (Europa, Estados Unidos y Japón). Ninguna otra patología infecciosa o no, vírica, bacteriana o parasitaria, causa semejantes pérdidas en Acuicultura.
Ha habido varios intentos para desarrollar vacunas tipo tradicional con virus atenuados o inactivados pero estos conllevan un alto coste.
Hace ya más de 15 años que se empezaron a investigar las vacunas genéticas (vacunas ADN) y desde entonces se han desarrollado vacunas para hacer resistentes a los humanos frente a diversas infecciones virales, como por ejemplo la hepatitis B, el herpes 1 y 2 o el virus de la polio.
La vacunación con ADN consiste en administrar al organismo receptor el gen que codifica el antígeno inmunógeno en lugar del propio antígeno. La subsiguiente expresión del gen en las células del animal vacunado activa su sistema inmunitario.
En los últimos años, la vacunación genética frente a los rabdovirus de peces, tanto el virus de la septicemia hemorrágica viral (VHSV) como el virus de la necrosis hematopoiética infecciosa (IHNV) ha demostrado ser muy efectiva utilizando un plásmido de expresión que codifica para la glicoproteína G del virus mediante la acción de un promotor del citomegalovirus (CMV) incluido en el plásmido. Estos plásmidos para conferir protección deben de ser inyectados intramuscularmente en el pez, donde se expresará la glicoproteína viral, desatando la respuesta inmune [1: Leong JC, Anderson E, Bootland LM, Chiou PW, Johnson M, Kim C, et al.. Fish vaccine antigens produced or delivered by recombinant DNA technologies. Dev Biol Stand 1997; 90: 267-77; and US 5,354555 (Jo-Ann C.Leong); 2: Lorenzen N, Lorenzen E, Einer-Jensen K, Heppell J, Wu T, Davis H. Protective immunity to VHS in rainbow trout (Oncorhynchus mykiss, Walbaum) following DNA vaccination. Fish Shellfish Immunol. 1998; 8: 261-70.; 3: LaPatra SE, Corbeil S, Jones GR, Shewmaker WD, Lorenzen N, Anderson ED, et al. Protection of rainbow trout against infectious hematopoietic necrosis virus four days after specific or semi-specific DNA vaccination. Vaccine 2001; 19: 4011-9.] A pesar de que los mecanismos a través de los cuales confieren protección todavía no están claros [4: Boudinot P, Blanco M, de Kinkelin P, Benmansour A. Combined DNA immunization with the glycoprotein gene of viral hemorrhagic septicemia virus and infectious hematopoietic necrosis virus induces double-specific protective immunity and nonspecific response in rainbow trout. Virology 1998; 249: 297-306.; 5: McLauchlan PE, Collet B, Ingerslev E, Secombes CJ, Lorenzen N, Ellis AE. DNA vaccination against viral haemorrhagic septicaemia (VHS) in rainbow trout: size, dose, route of injection and duration of protection-early protection correlates with Mx expression. Fish & Shellfish Immunol 2003; 15(1): 39-50.], los mecanismos de defensa inespecíficos, que pueden incrementarse mediante el uso de adyuvantes, tienen un papel muy importante en la protección conferida [5: McLauchlan PE, Collet B, Ingerslev E, Secombes CJ, Lorenzen N, Ellis AE. DNA vaccination against viral haemorrhagic septicaemia (VHS) in rainbow trout: size, dose, route of injection and duration of protection-early protection correlates with Mx expression. Fish & Shellfish Immunol 2003; 15(1): 39-50.; 6: Lorenzen N, Lorenzen E, Einer-Jensen K, LaPatra SE. DNA vaccines as a tool for analysing the protective immune response against rhabdoviruses in rainbow trout. Fish & Shellfish Immunol 2002; 12(5): 439-53.; 7: Purcell MK, Kurath G, Garver KA, Herwig RP, Winton JR. Quantitative expression profiling of immune response genes in rainbow trout following infectious haematopoietic necrosis virus (IHNV) infection or DNA vaccination. Fish & Shellfish Immunol 2004; 17(5): 447-62.].
Además, hay otros aspectos que también podrían verse favorablemente afectados por el uso de adyuvantes tales como el poder utilizar rutas de administración mas cómodas o como disminuir el coste de la vacuna.
En los mamíferos, las citoquinas (proteínas de bajo peso molecular con funciones inmunes producidas generalmente por células del sistema inmune) se han estudiado en muchos casos como adyuvantes en vacunación contra los virus. Dentro de las citoquinas, el grupo de las quimioquinas, ha sido uno de los mas estudiados [8: Eo SK, Pack C, Kumaraguru U, Rouse BT. Optimisation of DNA vaccines for the prophylaxis and modulation of herpes simplex virus...
Reivindicaciones:
1. Procedimiento para inmunizar peces contra la infección de rabdovirus, caracterizado porque comprende la administración de:
a) una vacuna ADN que induce una respuesta inmune en los peces contra la infección de rabdovirus, en una cantidad inferior a la que produciría un 100% de protección imunogénica; y
b) un coadyuvante obtenido por clonación de la interleuquina-8 (IL-8) de trucha en una cantidad suficiente para aumentar el efecto de la vacuna (a) entre un 10% y un 60%.
2. Procedimiento para inmunizar peces contra la infección de rabdovirus, de acuerdo con la reivindicación 1, caracterizado porque los peces son truchas.
3. Procedimiento para inmunizar peces contra la infección de rabdovirus, de acuerdo con las reivindicaciones 1-2, caracterizado porque los peces son Truchas Arco Iris (Oncorhynchus mykiss).
4. Procedimiento para inmunizar peces contra la infección de rabdovirus, de acuerdo con las reivindicaciones 1-3, caracterizado porque el rabdovirus es el virus de la septicemia hemorrágica viral (VHSV).
5. Procedimiento para inmunizar peces contra la infección de rabdovirus, de acuerdo con las reivindicaciones 1-3, caracterizado porque el rabdovirus es el virus de la necrosis hematopoiética infecciosa (IHNV).
6. Procedimiento para inmunizar peces contra la infección de rabdovirus, de acuerdo con las reivindicaciones 1-5, caracterizado porque el coadyuvante (b) es un plásmido denominado pIL8+ obtenido por clonación de la región codificante del gen de la IL-8 de Trucha Arco Iris en un vector de expresión eucariota cuya secuencia de nucleótidos se muestra en SEQ. ID. No. 1.
7. Procedimiento para inmunizar peces contra la infección de rabdovirus, de acuerdo con las reivindicaciones 1-6, caracterizado porque la vacuna (a) se administra en una cantidad tal que está comprendida entre el 40% y el 90% de la cantidad que produciría una protección inmunogénica del 100%.
8. Procedimiento para inmunizar peces contra la infección de rabdovirus, de acuerdo con las reivindicaciones 1-7, caracterizado porque la vacuna (a) se administra en una cantidad tal que está comprendida entre el 45% y el 80% de la cantidad que produciría una protección inmunogénica del 100%.
9. Procedimiento para inmunizar peces contra la infección de rabdovirus, de acuerdo con las reivindicaciones 1-8, caracterizado porque la vacuna (a) se administra en una cantidad tal que está comprendida entre el 50% y el 70% de la cantidad que produciría una protección inmunogénica del 100%.
10. Procedimiento para inmunizar peces contra la infección de rabdovirus, de acuerdo con las reivindicaciones 1-9, caracterizado porque el plásmido (b) se administra en una cantidad suficiente para incrementar el efecto inmunológico de la vacuna (a) entre un 15% y un 50%.
11. Procedimiento para inmunizar peces contra la infección de rabdovirus, de acuerdo con las reivindicaciones 1-9, caracterizado porque el plásmido (b) se administra en una cantidad suficiente para incrementar el efecto inmunológico de la vacuna (a) entre un 20% y un 40%.
12. Procedimiento para inmunizar peces contra la infección de rabdovirus, de acuerdo con las reivindicaciones 1-9, caracterizado porque el plásmido (b) se administra en una cantidad suficiente para incrementar el efecto inmunológico de la vacuna (a) entre un 25% y un 35%.
13. Utilización de un plásmido obtenido por donación de la interleuquina-8 (IL-8) de Trucha Arco Iris, en el procedimiento para inmunizar peces contra la infección de rabdovirus de acuerdo con las reivindicaciones 1-12.
14. Utilización de un plásmido de acuerdo con la reivindicación 13, denominado pIL8+ obtenido por donación de la región codificante del gen de la IL-8 de Trucha Arco Iris en un vector de expresión eucariota cuya secuencia de nucleótidos se muestra en SEQ. ID. No. 1.
15. Utilización del plásmido pIL8+, de acuerdo con las reivindicaciones 13-14, caracterizado porque cuando se utiliza con una vacuna ADN contra rabdovirus incrementa del 10% al 60% el efecto de dicha vacuna.
16. Composición farmacéutica para inmunizar peces contra la infección de rabdovirus, de acuerdo con el procedimiento de cualquiera de las reivindicaciones 1-12, caracterizada porque comprende:
a) una vacuna ADN que induce una respuesta inmune en los peces contra la infección de rabdovirus de peces, en una cantidad inferior a la que produciría un 100% de protección imunogénica; y
b) un coadyuvante obtenido por donación de la interleuquina-8 (IL-8) de trucha en una cantidad suficiente para aumentar el efecto de la vacuna (a) en al menos un 10%.
17. Composición farmacéutica para inmunizar peces contra la infección de rabdovirus, de acuerdo con la reivindicación 16, caracterizada porque el coadyuvante (b) es el plásmido pIL8+ cuya secuencia de nucleótidos se muestra en SEQ. ID. No. 1..
18. Composición farmacéutica para inmunizar peces contra la infección de rabdovirus, de acuerdo con las reivindicaciones 16-17, caracterizada porque los peces son Truchas Arco Iris (Oncorhynchus mykiss).
19. Composición farmacéutica para inmunizar Truchas Arco Iris contra la infección de rabdovirus, de acuerdo con las reivindicaciones 16-18, caracterizada porque el rabdovirus es el virus de la septicemia hemorrágica viral (VHSV).
20. Composición farmacéutica para inmunizar Truchas Arco Iris contra la infección de rabdovirus, de acuerdo con las reivindicaciones 16-18, caracterizada porque el rabdovirus es el virus de la necrosis hematopoiética infecciosa (IHNV).
21. Composición farmacéutica para inmunizar Truchas Arco Iris contra la infección de rabdovirus, de acuerdo con las reivindicaciones 16-20, caracterizada porque la vacuna (a) está presente en una cantidad tal que está comprendida entre el 40% y el 90% de la cantidad que produciría una protección inmunogénica del 100%.
22. Composición farmacéutica para inmunizar Truchas Arco Iris contra la infección de rabdovirus, de acuerdo con las reivindicaciones 16-21, caracterizada porque la vacuna (a) está presente en una cantidad tal que está comprendida entre el 45% y el 80% de la cantidad que produciría una protección inmunogénica del 100%.
23. Composición farmacéutica para inmunizar Truchas Arco Iris contra la infección de rabdovirus, de acuerdo con las reivindicaciones 16-22, caracterizada porque la vacuna (a) está presente en una cantidad tal que está comprendida entre el 50% y el 70% de la cantidad que produciría una protección inmunogénica del 100%.
24. Composición farmacéutica para inmunizar Truchas Arco Iris contra la infección de rabdovirus, de acuerdo con las reivindicaciones 16-23, caracterizada porque el plásmido (b) está presente en una cantidad suficiente para incrementar el efecto inmunológico de la vacuna (a) entre un 15% y un 50%.
25. Composición farmacéutica para inmunizar Truchas Arco Iris contra la infección de rabdovirus, de acuerdo con las reivindicaciones 16-24, caracterizada porque el plásmido (b) está presente en una cantidad suficiente para incrementar el efecto inmunológico de la vacuna (a) entre un 20% y un 40%.
26. Composición farmacéutica para inmunizar Truchas Arco Iris contra la infección de rabdovirus, de acuerdo con las reivindicaciones 16-25, caracterizada porque el plásmido (b) está presente en una cantidad suficiente para incrementar el efecto inmunológico de la vacuna (a) entre un 25% y un 35%.
27. Composición farmacéutica para inmunizar Truchas Arco Iris contra la infección de rabdovirus, de acuerdo con las reivindicaciones 16-26, caracterizada porque además comprende los vehículos o excipientes necesarios para contener los ingredientes (a) y (b) en una forma farmacéuticamente adecuada para su administración.
28. Una composición farmacéutica para inmunizar Truchas Arco Iris contra la infección de rabdovirus, de acuerdo con la reivindicación 27, caracterizada porque dicha composición está preparada para ser administrada por inyección intramuscular.
Patentes similares o relacionadas:
Métodos mejorados para la preparación de escualeno, del 15 de Julio de 2020, de NOVARTIS AG: Un procedimiento para la preparación de escualeno a partir de una composición que comprende escualeno a partir de una fuente animal, dicho procedimiento comprendiendo […]
Señal para el empaquetamiento de vectores del virus de la gripe, del 24 de Junio de 2020, de WISCONSIN ALUMNI RESEARCH FOUNDATION: Un vector del virus de la gripe para la expresión y empaquetamiento de ARNv recombinante, en el que el vector comprende: secuencias correspondientes […]
Nueva especie de tobamovirus, del 17 de Junio de 2020, de Nunhems B.V: Un tobamovirus cuyo genoma comprende al menos 83% de identidad de secuencia con la SEQ ID NÚM.: 1 y en el que el virus causa síntomas sistémicos en plantas homocigotas […]
Vectores de AAV dirigidos a oligodendrocitos, del 10 de Junio de 2020, de THE UNIVERSITY OF NORTH CAROLINA AT CHAPEL HILL: Un ácido nucleico que codifica una cápside de AAV, comprendiendo el ácido nucleico una secuencia codificante de la cápside de AAV que es al menos el 96 % idéntica […]
Métodos para la transducción y el procesamiento de células, del 27 de Mayo de 2020, de Juno Therapeutics, Inc: Un método de transducción, que comprende incubar, en una cavidad interna de una cámara de centrífuga, una composición de entrada que comprende células y partículas […]
Composiciones para tratar MPSI, del 22 de Abril de 2020, de THE TRUSTEES OF THE UNIVERSITY OF PENNSYLVANIA: Un vector que lleva un casete de expresión que comprende un gen de la alfa-L-iduronidasa humana (hIDUA) que tiene la secuencia de nucleótidos de SEQ ID NO: […]
Métodos mejorados para producir terapias celulares adoptivas, del 22 de Abril de 2020, de Bluebird Bio, Inc: Un método in vitro para producir un producto terapéutico de células T que comprende: a) proporcionar una población de células mononucleares […]
Nuevo bacteriófago y composición que comprende el mismo, del 25 de Marzo de 2020, de CJ CHEILJEDANG CORPORATION: Un bacteriófago ΦCJ25 (KCCM11463P) que tiene una capacidad específica para matar Escherichia coli patógena aviar.