SINTESIS DE POLICETIDOS.
Un procedimiento para producir un macrólido de 14 miembros que tiene un grupo 13-metilo,
comprendiendo dicho procedimiento cultivar un organismo transformante que contiene ADN que codifica y está dispuesto para expresar una multienzima PKS (policétido sintasa) que produce un macrólido de 14 miembros, comprendiendo dicha multienzima PKS un módulo de carga y una pluralidad de módulos de extensión; en el que dicho módulo de carga está adaptado para cargar un residuo de malonilo y para efectuar luego la descarboxilación del residuo cargado para proporcionar una unidad de iniciador de acetato que se transfiere a una adyacente de dichos módulos de extensión; en el que dicho módulo de carga es de la forma KSq-ATq-ACP en la que:
(a) KSq representa un dominio de tipo cetosintasa que se diferencia de un dominio KS de un módulo de extensión por tener un residuo de glutamina en lugar de una cisteína en el sitio activo;
(b) ATq representa un dominio aciltransferasa que carga un malonilo y tiene un residuo de arginina en el sitio activo; y
(c) ACP representa una proteína portadora de acilos; y en el que los módulos de extensión no están naturalmente asociados a un módulo de carga que efectúa la descarboxilación de un residuo de malonilo
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/GB99/02042.
Solicitante: BIOTICA TECHNOLOGY LIMITED
PFIZER INC.
Nacionalidad solicitante: Reino Unido.
Dirección: 112 HILLS ROAD,CAMBRIDGE CB2 1PH.
Inventor/es: LEADLAY, PETER, FRANCIS, STAUNTON, JAMES, CORTES, JESUS, MCARTHUR, HAMISH, ALASTAIR, IRVINE.
Fecha de Publicación: .
Fecha Concesión Europea: 17 de Marzo de 2010.
Clasificación Internacional de Patentes:
- C12N15/52 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Genes que codifican enzimas o proenzimas.
- C12N9/10C1
- C12P17/06 C12 […] › C12P PROCESOS DE FERMENTACION O PROCESOS QUE UTILIZAN ENZIMAS PARA LA SINTESIS DE UN COMPUESTO QUIMICO DADO O DE UNA COMPOSICION DADA, O PARA LA SEPARACION DE ISOMEROS OPTICOS A PARTIR DE UNA MEZCLA RACEMICA. › C12P 17/00 Preparación de compuestos heterocíclicos que contienen O, N, S, Se o Te como únicos heteroátomos del ciclo (C12P 13/04 - C12P 13/24 tienen prioridad). › que contienen un ciclo de seis miembros, p. ej. fluoresceína.
- C12P19/62 C12P […] › C12P 19/00 Preparación de compuestos que contienen radicales sacárido (ácido cetoaldónico C12P 7/58). › teniendo el heterociclo al menos ocho miembros y sólo oxígeno como heteroátomo del ciclo, p. ej. eritromicina, espiramicina, nistatina.
Clasificación PCT:
- C12P19/62 C12P 19/00 […] › teniendo el heterociclo al menos ocho miembros y sólo oxígeno como heteroátomo del ciclo, p. ej. eritromicina, espiramicina, nistatina.
Clasificación antigua:
- A61K31/70 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Hidratos de carbono; Azúcares; Sus derivados (sorbitol A61K 31/047).
- C07H17/08 C […] › C07 QUIMICA ORGANICA. › C07H AZUCARES; SUS DERIVADOS; NUCLEOSIDOS; NUCLEOTIDOS; ACIDOS NUCLEICOS (derivados de ácidos aldónicos o sacáricos C07C, C07D; ácidos aldónicos, ácidos sacáricos C07C 59/105, C07C 59/285; cianohidrinas C07C 255/16; glicales C07D; compuestos de constitución indeterminada C07G; polisacáridos, sus derivados C08B; ADN o ARN concerniente a la ingeniería genética, vectores, p. ej. plásmidos o su aislamiento, preparación o purificación C12N 15/00; industria del azúcar C13). › C07H 17/00 Compuestos que contienen radicales heterocíclicos unidos directamente a los heteroátomos de los radicales sacárido. › Heterociclos que contienen ocho o más miembros cíclicos, p. ej. eritromicinas.
Fragmento de la descripción:
Síntesis de policétidos.
La presente invención se refiere a procedimientos para preparar macrólidos de 14 miembros mediante síntesis recombinante. Los genes biosintéticos de policétidos o porciones de los mismos que pueden derivarse de diferentes agrupaciones de genes biosintéticos de policétidos se manipulan para permitir la producción de policétidos novedosos específicos de estructura predicha. Esta invención se refiere particularmente a la sustitución de material genético que codifica la unidad de iniciador natural con otros genes con el fin de preparar macrólidos de 14 miembros con preferencialmente una unidad de iniciador de acetato, a la vez que se minimiza la formación de subproductos que contienen una unidad de iniciador diferente.
Los policétidos son una clase grande y estructuralmente diversa de productos naturales que incluye muchos compuestos que poseen propiedades antibióticas u otras farmacológicas tales como eritromicina, tetraciclinas, rapamicina, avermectina, monensina, epotilonas y FK506. En particular, los policétidos se producen abundantemente por Streptomyces y bacterias de actinomicetos relacionadas. Se sintetizan por la condensación en etapas repetida de aciltioésteres de un modo análogo al de la biosíntesis de ácidos grasos. La mayor diversidad estructural encontrada entre los policétidos naturales surge de la selección de (normalmente) acetato o propionato como unidades de iniciador o "extendedor"; y del diferente grado de procesamiento del grupo ß-ceto observado después de cada condensación. Ejemplos de etapas de procesamiento incluyen reducción a ß-hidroxiacil-, reducción seguida de deshidratación a 2-enoil- y reducción completa al aciltioéster saturado. El resultado estereoquímico de estas etapas de procesamiento también se especifica para cada ciclo de extensión de cadenas.
La biosíntesis de policétidos se inicia por un grupo de enzimas formadoras de cadenas conocidas como policétido sintasas. Se han descrito dos clases de policétido sintasa (PKS) en actinomicetos. Una clase, llamada PKS de tipo I, representada por las PKS para los macrólidos eritromicina, oleandomicina, avermectina y rapamicina, está constituida por un conjunto diferente o "módulo" de enzimas para cada ciclo de extensión de cadenas de policétidos. Para un ejemplo véase la Figura 1 (Cortés, J. y col. Nature (1990) 348:176-178; Donadio, S. y col. Science (1991) 2523:675-679; Swan, D.G. y col. Mol. Gen. Genet. (1994) 242:358-362; MacNeil, D. J. y col. Gene (1992) 115:119-125; Schwecke, T. y col. Proc. Natl. Acad. Sci. USA (1995) 92:7839-7843).
El término "módulo de extensión" como se usa en este documento se refiere al conjunto de dominios contiguos desde un dominio ß-cetoacil-ACP sintasa ("AKS") hasta el siguiente dominio proteína portadora de acilos ("ACP") que realiza un ciclo de extensión de cadenas de policétidos. El término "módulo de carga" se usa para referirse a cualquier grupo de dominios contiguos que realiza la carga de la unidad de iniciador sobre la PKS y así hace que esté disponible para el dominio KS del primer módulo de extensión. La longitud del policétido formado se ha modificado, en el caso de la biosíntesis de eritromicina, por la relocalización específica usando ingeniería genética del dominio enzimático de la PKS productora de eritromicina que contiene la cadena que libera la actividad de tioesterasa/ciclasa (Cortés y col. Science (1995) 268:1487-1489; Kao, C.M. y col. J. Am. Chem. Soc. (1995) 117:9105-9106).
Se ha mostrado que la deleción en el marco del ADN que codifica parte del dominio cetoreductasa en el módulo 5 de la pKS productora de eritromicina (también conocida como 6-desoxieritronolida B sintasa, DEBS) conduce a la formación de análogos de eritromicina 5,6-didesoxi-3-a-micarosil-5-oxoeritronolida B, 5,6-didesoxi-5-oxoeritronolida B y 5,6-didesoxi-6ß-epoxi-5-oxoeritronolida B (Donadio, S. y col. Science (1991) 252:675-679). Asimismo, la alteración de residuos de sitios activos en el dominio enoilreductasa de módulo 4 en DEBS, por ingeniería genética del ADN que codifica la PKS correspondiente y su introducción en Saccharopolyspora erythraea, condujo a la producción de 6,7-anhidroeritromicina C (Donadio, S. y col. Proc Natl. Acad. Sci. USA (1993) 90:7119-7123).
La solicitud de patente internacional número WO 93/13663 describe tipos adicionales de manipulación genética de los genes de DEBS que pueden producir policétidos cambiados. Sin embargo, se ha notificado que muchos esfuerzos han sido improductivos (Hutchinson, C. R. y Fujii, I. Annu. Rev. Microbiol. (1995) 49:201-238, en la pág. 231). Se ha desvelado la secuencia de ADN completa de los genes de Streptomyces hygroscopicus que codifican la PKS de tipo I modular que gobierna la biosíntesis del policétido inmunodepresor macrocíclico rapamicina (Schwecke, T. y col. (1995) Proc. Natl. Acad. Sci. USA 92:7839-7843). La secuencia de ADN está depositada en la base de datos EMBL/Genbank con el número de registro X86780.
La segunda clase de PKS, llamada PKS de tipo II, está representada por las sintasas para compuestos aromáticos. Las PKS de tipo II sólo contienen un único conjunto de actividades enzimáticas para la extensión de cadenas y éstas se vuelven a usar como apropiadas en ciclos sucesivos (Bibb, M. J. y col. EMBO J. (1989) 8:2727-2736; Sherman, D. H. y col. EMBO J. (1989) 8:2717-2725; Fernandez-Moreno, M.A. y col. J. Biol. Chem. (1992) 267:19278-19290). Las unidades de "extendedor" para las PKS de tipo II son normalmente unidades de acetato y la presencia de ciclasas específicas impone la ruta preferida para la ciclación de la cadena completa en un producto aromático (Hutchinson, C. R. y Fujii, I. Annu. Rev. Microbiol. (1995) 49:201-238). Los policétidos híbridos se han obtenido mediante la introducción de clones de ADN que contiene genes de PKS de tipo II en otro cepa que contiene una agrupación de genes de PKS de tipo II diferente, por ejemplo, mediante la introducción de ADN derivado del agrupamiento de genes para actinorrodina, un policétido pigmentado de azul de Streptomyces coelicolor, en una cepa productora de policétidos antraquinona de Streptomyces galileus (Bartel, P. L. y col. J. Bacteriol. (1990) 172:4816-4826).
El número mínimo de dominios requeridos para la extensión de cadenas de policétidos en una PKS de tipo II cuando se expresa en una célula huésped de Streptomyces coelicolor (la "PKS mínima") se ha definido, por ejemplo, en la solicitud de patente internacional número WO 95/08548 de forma que contiene los tres siguientes polipéptidos que son productos de los genes act I: primer KS; en segundo lugar un polipéptido llamando CLF con similitud de secuencias de aminoácidos de extremo a extremo respecto a la KS pero en la que el residuo del sitio activo esencial de la KS, concretamente un residuo de cisteína, está sustituido o bien por un residuo de glutamina, o en el caso de la PKS para un pigmento de espora tal como el producto génico whiE (Chater, K. F. y Davis, N. K. Mol. Microbiol. (1990) 4:1679-1691) por un residuo de ácido glutámico (Figura 2); y finalmente una ACP. Se ha establecido, por ejemplo, en la solicitud de patente internacional número WO 95/08548 que el CLF es un factor que determina la longitud de cadena de la cadena de policétido que se produce por la PKS mínima. Sin embargo, se ha encontrado (Shen, B. y col. J. Am. Chem. Soc. (1995) 117:6811-6821) que cuando el CLF para el octacétido actinorrodina se usa para sustituir el CLF por el decacétido tetracenomicina en células huésped de Streptomyces glaucescens no se encuentra que se haya cambiado el producto de policétido de un decacétido a un octacétido, por lo que queda poco clara la función exacta del CLF. Se ha propuesto una nomenclatura alternativa en la que la KS se designa KSa y el CLF se designa KSß para reflejar esta falta de conocimiento (Meurer, G. y col. Chemistry and Biology (1997) 4:433-443). El mecanismo por el que las unidades de iniciador de acetato y las unidades de extendedor de acetato se cargan sobre la PKS de tipo II no es conocido, pero se especula que la malonil-CoA:ACP aciltransferasa de la ácido graso sintasa de la célula huésped puede cumplir la misma función para la PKS de tipo II (Revill, W. P. y col. J. Bacteriol. (1995) 177:3946-3952).
La solicitud de patente internacional número WO 95/08548 describe la sustitución de genes de PKS actinorrodina por ADN heterólogo de otras agrupaciones de genes de PKS de tipo II para obtener policétidos híbridos. La misma solicitud de patente internacional WO 95/08548 describe la construcción de una cepa de Streptomyces coelicolor que...
Reivindicaciones:
1. Un procedimiento para producir un macrólido de 14 miembros que tiene un grupo 13-metilo, comprendiendo dicho procedimiento cultivar un organismo transformante que contiene ADN que codifica y está dispuesto para expresar una multienzima PKS (policétido sintasa) que produce un macrólido de 14 miembros, comprendiendo dicha multienzima PKS un módulo de carga y una pluralidad de módulos de extensión; en el que dicho módulo de carga está adaptado para cargar un residuo de malonilo y para efectuar luego la descarboxilación del residuo cargado para proporcionar una unidad de iniciador de acetato que se transfiere a una adyacente de dichos módulos de extensión; en el que dicho módulo de carga es de la forma KSq-ATq-ACP en la que:
2. El procedimiento de la reivindicación 1, en el que el compuesto producido es un compuesto de fórmula 1:
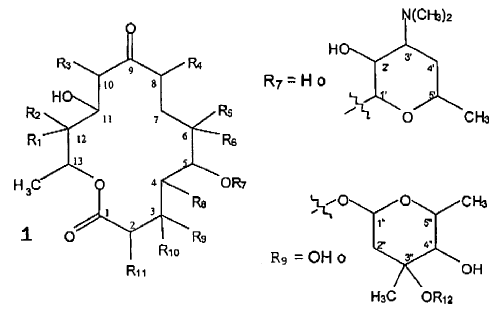
en la que:
R1 es H o OH; R2-R4 son cada uno independientemente H, CH3 o CH2CH3; R5 es H o OH; y R6 es H, CH3 o CH2CH3; R7 es H o desosamina; R8 es H, CH3 o CH2CH3; R9 es OH, micarosa (R12 es H) o cladinosa (R12 es CH3), R10 es H; o R9 = R10 = O; y R11 es H, CH3 o CH2CH3, con la condición de que cuando R2-R4 sea CH3, R6 sea CH3, R8 sea CH3 y R11 sea CH3, entonces R1 y R5 no son H y R12 no es H; o también cuando R2-R4 sea CH3, R6 sea CH3, R8 sea CH3 y R11 sea CH3, entonces R1 y R5 no son OH y R12 no es H.
3. El procedimiento de la reivindicación 1, en el que el compuesto producido es 15-noreritromicina A.
4. El procedimiento de la reivindicación 1, en el que el compuesto producido es 15-noreritromicina B.
5. El procedimiento de cualquier reivindicación precedente, en el que el dominio KSq se deriva por mutagénesis de un dominio KS de un módulo de extensión.
6. El procedimiento de cualquier reivindicación precedente, en el que el dominio ATq es un dominio AT de módulo de extensión natural de una PKS de tipo I.
7. El procedimiento de cualquier reivindicación precedente, en el que dicho módulo de carga se corresponde con el módulo de carga de la multienzima PKS de oleandomicina, espiramicina, nidamicina, metimicina o monensina.
8. El procedimiento según cualquiera de las reivindicaciones precedentes, en el que la pluralidad de módulos de extensión se corresponde con los módulos de extensión de una PKS seleccionada de eritromicina, narbomicina, picromicina, lancamicina, kujimicina o megalomicina.
9. El procedimiento de la reivindicación 8, en el que la pluralidad de módulos de extensión se corresponde con los módulos de extensión de la PKS eritromicina.
10. El procedimiento de cualquier reivindicación precedente, en el que el organismo transformante se selecciona de: Saccharopolyspora erythraea, Streptomyces coelicolor, Streptomyces avermitilis, Streptomyces griseofuscus, Streptomyces cinnamonensis, Streptomyces fradiae, Streptomyces longisporoflavus, Streptomyces hygroscopicus, Micromonospora griseorubida, Streptomyces lasaliensis, Streptomyces venezuelae, Streptomyces antibioticus, Streptomyces lividans, Streptomyces rimosus, Streptomyces albus, Amycolatopsis mediterranei y Streptomyces tsukubaensis.
Patentes similares o relacionadas:
PRODUCCIÓN BIOTECNOLÓGICA DE D-DIBOA Y SUS DERIVADOS CLORADOS A PARTIR DE SUS PRECURSORES NITROFENOXIDO-ACETATO, del 7 de Julio de 2020, de UNIVERSIDAD DE CADIZ: Producción biotecnológica de D-Diboa y sus derivados clorados a partir de sus precursores nitrofenoxido-acetato. El área científica al que corresponde la invención es la […]
Agrupación de genes de biosíntesis de carrimicina, del 27 de Mayo de 2020, de Shenyang Fuyang Pharmaceutical Technology Co., Ltd: Agrupación de genes de biosíntesis de carrimicina, que consiste en 44 genes que comprende: 1) cinco genes de policétido sintasa, incluyendo los residuos […]
Células huéspedes modificadas y usos de las mismas, del 22 de Abril de 2020, de GLAXOSMITHKLINE BIOLOGICALS S.A.: Una célula huésped que comprende: i. un ácido nucleico que codifica una glicosiltransferasa derivada de un racimo rfb de Pseudomonas; ii. un ácido nucleico […]
Fábrica de células bacterianas modificadas genéticamente para la producción de tiamina, del 22 de Abril de 2020, de Biosyntia ApS: Bacteria modificada genéticamente para la producción de tiamina no fosforilada; en la que dicha bacteria se caracteriza por tener transgenes […]
 Cepas de microorganismo para la producción de 2,3-butanodiol, del 25 de Diciembre de 2019, de Alderys: Una levadura recombinante que tiene una actividad piruvato descarboxilasa reducida, en cuyo genoma se ha insertado:
- uno o más ácidos nucleicos que codifican una […]
Cepas de microorganismo para la producción de 2,3-butanodiol, del 25 de Diciembre de 2019, de Alderys: Una levadura recombinante que tiene una actividad piruvato descarboxilasa reducida, en cuyo genoma se ha insertado:
- uno o más ácidos nucleicos que codifican una […]
Producción microbiana de aminas grasas, del 20 de Noviembre de 2019, de Genomatica, Inc: Una célula bacteriana recombinante para la producción de una amina grasa, que comprende: (i) uno o más genes expresados que co 5 difican una […]
Cartucho de expresión para la trasformación de una célula eucariótica, método para transformar una célula eucariótica, organismo genéticamente modificado, y procedimiento para la producción de biocombustibles y/o compuestos bioquímicos y biocombustibles producidos de ese modo, del 13 de Noviembre de 2019, de Biocelere Agroindustrial Ltda: Un casete de expresión para transformar una célula eucariótica caracterizado porque comprende una combinación de los siguientes casetes de expresión: […]
Métodos para producir abienol, del 23 de Octubre de 2019, de DSM IP ASSETS B.V.: Un método para producir abienol, que comprende convertir difosfato de geranilgeranilo (GGPP) en abienol en presencia de una combinación de diterpeno […]