PREPARACION FARMACEUTICA DE FACTOR VIII RECOMBINANTE LIOFILIZADA SIN ALBUMINA COMO ESTABILIZANTE.
Una preparación farmacéutica del factor VIII recombinante liofilizada con un estabilizante que comprende arginina,
isoleucina y ácido glutámico, estabilizando el estabilizante el factor VIII recombinante, para su uso para tratar la hemofilia
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E05102880.
Solicitante: GREEN CROSS HOLDINGS.
Nacionalidad solicitante: República de Corea.
Dirección: 227 GUGAL-RI, GIHEUNG-EUP,YONGIN-SI, GYEONGGI-DO, 449-59.
Inventor/es: LEE, JUNG, SIK, PAIK,SANG-HOON, SHIN,YONG-NAM, KIM,JEAN-MAN, HUH,JAE-WOOK, KWON,KI-SUNG, CHUN,JI-HYUN.
Fecha de Publicación: .
Fecha Solicitud PCT: 12 de Abril de 2005.
Fecha Concesión Europea: 10 de Marzo de 2010.
Clasificación Internacional de Patentes:
- A61K38/37 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Factores VIII.
- A61K9/19 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › liofilizados.
- C07K14/755 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Factores VIII.
Clasificación PCT:
- A61K38/37 A61K 38/00 […] › Factores VIII.
- A61K47/18 A61K […] › A61K 47/00 Preparaciones medicinales caracterizadas por los ingredientes no activos utilizados, p. ej. portadores o aditivos inertes; Agentes de direccionamiento o agentes modificadores enlazados químicamente al ingrediente activo. › Aminas; Amidas; Ureas; Compuestos de amonio cuaternario; Aminoácidos; Oligopéptidos que tienen hasta cinco aminoácidos.
- A61K9/19 A61K 9/00 […] › liofilizados.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
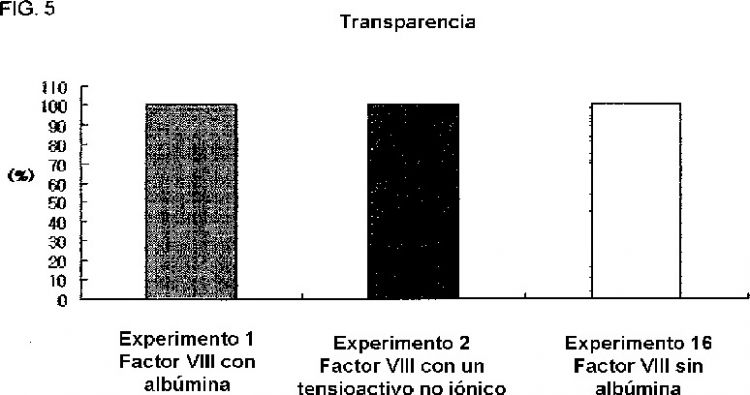
Fragmento de la descripción:
Preparación farmacéutica de factor VIII recombinante liofilizada sin albúmina como estabilizante.
Antecedentes de la invención
La presente invención se refiere a una composición liofilizada del factor VIII recombinante utilizada como preparación terapéutica de la hemofilia A y, más en concreto, a una composición liofilizada del factor VIII recombinante sin albúmina que emplea un aminoácido como estabilizante para estabilizar el factor recombinante que tiene una actividad inestable durante la liofilización, estando el aminoácido exento de riesgo de infección vírica.
La hemofilia es uno de los trastornos de coagulación heredados y se sabe que está provocado por una escasez de factores de coagulación biológicamente activos, que normalmente están presentes en el plasma sanguíneo de la sangre humana.
Puesto que la hemofilia es una enfermedad de sangrado recesiva heredada ligada al sexo, las mujeres rara vez resultan afectadas incluso si las mujeres portan los genes de la hemofilia, que afecta principalmente a la población masculina. La hemofilia se clasifica como hemofilia A, hemofilia B, hemofilia AB y hemofilia C según el tipo de factor de coagulación sanguíneo deficiente.
La hemofilia A afecta a 1-2 individuos por cada 20.000 hombres debido a la deficiencia o a la ausencia del factor VIII coagulante sanguíneo in vivo humano (factor antihemofílico). La hemofilia B aparece en aproximadamente 1 de cada 100.000 hombres debido una deficiencia en el factor IX de coagulación sanguínea humano (factor de Christmas). La hemofilia AB refleja una deficiencia en los factores VIII y IX coagulantes sanguíneos recombinantes humanos, y la hemofilia C refleja una deficiencia en el factor XI coagulante recombinante humano.
Se han producido agentes terapéuticos para el tratamiento de la hemofilia A durante las últimas tres decadas aislando el factor VIII del plasma sanguíneo humano, purificándolo y concentrándolo. Estos agentes terapéuticos han permitido que muchos hemofílicos tengan una vida normal.
Sin embargo, el factor VIII coagulante derivado de sangre humana, que se aisla a partir de plasma sanguíneo humano para ser utilizado como agente terapéutico convencional para el tratamiento de la hemofilia, presenta ciertas desventajas, incluyendo la susceptibilidad a la infección con virus portados por la sangre, como el virus de la hepatitis, el virus de la inmunodeficiencia humana (VIH) o el virus TT. Para solucionar estos problemas, como se indicó en J. Gitschier et al., Nature, 312, 330-337, 1984, y en el documento EP 160457, la preparación del factor VIII coagulante humano recombinante en general implica aislarlo de productos de cultivo de células animales recombinantes utilizando la tecnología del ADN recombinante, y purificar los factores coagulantes aislados.
La estructura y el esquema de reacción bioquímica de los productos del factor VIII recombinante se describe en Kaufman, Tibtech, vol. 9, 1991, y en Hematology, 63, 155-165, 1991.
Los concentrados del factor VIII humano aislados a partir de plasma sanguíneo humano contienen varias formas del factor VIII fragmentadas de actividad estable (véase Andersson et al., Proc. Natl. Acad. Sci. USA, vol. 83, 2979-2983, mayo de 1986). La forma activa más pequeña del factor VIII tiene un peso molecular de aproximadamente 170 kDa y está compuesta por dos cadenas de fragmentos de 90 kDa y 80 kDa unidas entre sí mediante un enlace iónico metálico (véase el documento EP 197901). Kabi Pharmacia ha desarrollado productos del factor VIII recombinantes de 170 kDa con un dominio B delecionado a partir del factor VIII de coagulación derivado de sangre humana. El factor recombinante cortado se denomina r-VIII SQ y es producido por la línea celular de ovario de hámster chino (CHO) a partir de medio exento de suero mediante el cultivo de células animales. La estructura y el esquema de reacción bioquímica de r-VIII SQ se describe en el documento WO 91/09122.
Las proteínas del factor recombinante se producen en una forma liofilizada para ser distribuidas en el mercado para una mejor conservación, almacenaje y manipulación. Para ser administradas a un paciente, las proteínas liofilizadas se reconstituyen en un disolvente apropiado. Sin embargo, durante la liofilización las proteínas del factor recombinante pueden experimentar una considerable reducción en su actividad mientras se están sometiendo a la purificación, la esterilización, la liofilización, el envasado y la reconstitución para su inyección. Además, el aspecto de la torta seca es malo y no se desea. Por tanto, se realizó un intento convencional para lograr la estabilización del factor recombinante utilizando albúmina derivada de sangre humana como estabilizante en la liofilización. La albúmina derivada de sangre humana actúa como estabilizante general en la purificación y en la esterilización, así como en la liofilización (véase Wang et al., J. of Parenteral Sci. and Tech., vol. 42, nº 2S, suplemento, 1988). Además, la albúmina derivada de sangre humana es un buen agente formador de torta en formulaciones para la liofilización. El uso de albúmina para estabilizar el factor VIII recombinante es muy conocido en la técnica, y la albúmina también se emplea en algunos productos de factor VIII recombinante muy purificado que están disponibles en el mercado en la actualidad. Sin embargo, puesto que la albúmina derivada de sangre humana se aísla a partir de plasma de sangre humana resulta vulnerable a las infecciones por virus derivados de sangre, como el virus de la hepatitis, VIH o TT. Por tanto, la albúmina derivada de sangre humana no puede utilizarse de modo adecuado para agentes terapéuticos de la hemofilia producidos mediante la tecnología del ADN recombinante. Además, cuando se realiza un ensayo fisicoquímico en los productos finales, un exceso de albúmina con relación a una baja concentración de los principales componentes farmacéuticamente eficaces puede provocar interferencia, haciendo que sea difícil un control de la calidad preciso.
Por tanto, sería deseable proporcionar una preparación farmacéutica de factor recombinante sin albúmina, que sea estable en una disolución durante la liofilización o como la disolución resultante después de la liofilización y la reconstitución.
Para estabilizar los factores recombinantes se han propuesto varias estrategias. Por ejemplo, la patente de EEUU nº 5.763.401 (documento EP 818204, Bayer) describe un procedimiento para estabilizar el factor recombinante utilizando de 15 a 60 mM de sacarosa como estabilizante.
La patente de EEUU nº 5.733.873 (documento EP 627924, Pharmacia & Upjohn) describe un procedimiento de estabilización de un factor recombinante utilizando de 0,01 a 1 mg/ml de un tensioactivo no iónico (polisorbato 20 ó 80) como estabilizante.
La patente de EEUU nº 4.877.608 (documento EP 315968, Rhone-Poulenc Rorer) describe un procedimiento de estabilización de un factor recombinante que emplea bajas concentraciones de iones, es decir, de 0,5 a 15 mM de NaCl, KCl, y de 0,01 a 10 mM de hidrocloruro de lisina, al cual también pueden añadirse azúcares, como maltosa, sacarosa o manitol.
La patente de EEUU nº 5.605.884 (documento EP 314095, Rhone-Poulenc Rorer) describe un procedimiento de estabilización de un factor recombinante que utiliza altas concentraciones de iones, es decir, NaCl de 0,35 a 1,2 M, y KCl de 1,5 a 40 mM, al cual también pueden añadirse sacáridos, como maltosa, sacarosa o manitol.
La solicitud de patente internacional WO 96/22107 (Quadrant Holings Cambrige Limited) describe el uso de trehalosa como estabilizante.
La solicitud de patente internacional WO 89/09614 (Genentech) describe una formulación que tiene una hormona del crecimiento humana estabilizada que incluye glicina, manitol y un tampón. En una realización preferida de la formulación se añade a ésta un tensioactivo no iónico, como polisorbato 80. El tensioactivo no iónico se añade para reducir la agregación y la desnaturalización. La formulación preparada muestra una mayor estabilidad durante la liofilización y después de su reconstitución.
El documento EP 268110 (Cetus) describe una disolución que comprende una proteína concreta disuelta en un medio vehículo inactivo que porta un aclarante de polímero no iónico como disolvente/estabilizante, por ejemplo la interleuquina-2. Los ejemplos preferidos del aclarante incluyen un compuesto...
Reivindicaciones:
1. Una preparación farmacéutica del factor VIII recombinante liofilizada con un estabilizante que comprende arginina, isoleucina y ácido glutámico, estabilizando el estabilizante el factor VIII recombinante, para su uso para tratar la hemofilia.
2. La preparación farmacéutica de la reivindicación 1, en la que antes de la liofilización, la arginina tiene una concentración de 6 a 100 mM, la isoleucina tiene una concentración de 3,5 a 50 mM, y el ácido glutámico tiene una concentración de 10 a 100 mM.
3. La preparación farmacéutica de la reivindicación 1 ó 2, en la que antes de la liofilización, la arginina tiene una concentración de 6 a 42 mM.
4. La preparación farmacéutica de la reivindicación 1 ó 2, en la que antes de la liofilización, la isoleucina tiene una concentración de 7 a 35 mM.
5. La preparación farmacéutica de la reivindicación 1 ó 2, en la que antes de la liofilización, el ácido glutámico tiene una concentración de 10 a 70 mM.
6. La preparación farmacéutica de la reivindicación 1 ó 2, en la que antes de la liofilización, la arginina tiene una concentración de 6 a 42 mM, la isoleucina tiene una concentración de 7 a 35 mM, y el ácido glutámico tiene una concentración de 10 a 70 mM.
Patentes similares o relacionadas:
Composiciones para la supresión de la formación de inhibidores contra el factor VIII en pacientes con hemofilia A., del 22 de Julio de 2020, de THE TRUSTEES OF THE UNIVERSITY OF PENNSYLVANIA: Una composición que comprende material vegetal liofilizado que comprende al menos un fragmento de FVIII conjugado con la subunidad B de la toxina […]
Modificación de FVIII dirigida al sitio, del 15 de Julio de 2020, de BAYER HEALTHCARE LLC: Un conjugado que tiene actividad procoagulante del factor VIII que comprende un factor VIII polipeptídico funcional con el dominio B eliminado que está mutado […]
Proteínas del factor VIII que tienen secuencias ancestrales, vectores de expresión, y usos relacionados con ellos, del 15 de Julio de 2020, de EMORY UNIVERSITY: Una proteína FVIII recombinante o quimérica que comprende una o más mutaciones ancestrales y una eliminación del dominio B, y en donde la secuencia […]
Compuestos para aumentar la semi-vida del factor von Willebrand, del 22 de Abril de 2020, de CSL Behring Lengnau AG: Un anticuerpo capaz de fijarse a la proteína receptora humana CLEC10A para uso en el tratamiento de un trastorno de la coagulación de la sangre, […]
Vectores lentivirales, del 8 de Abril de 2020, de IP2IPO Innovations Limited: Un vector lentiviral pseudotipado con hemaglutinina-neuraminidasa (HN) y proteínas de fusión (F) de un paramixovirus respiratorio, en el que dicho vector lentiviral comprende […]
Productos terapéuticos de unión a los eritrocitos, del 8 de Enero de 2020, de ECOLE POLYTECHNIQUE FEDERALE DE LAUSANNE (EPFL): Una composición farmacéuticamente aceptable que comprende: un antígeno; un grupo de unión a los eritrocitos, en donde el grupo de unión a los eritrocitos […]
Un procedimiento para aumentar la productividad de células eucarióticas en la producción de FVIII recombinante, del 25 de Diciembre de 2019, de OCTAPHARMA AG: Un procedimiento para aumentar la productividad, en particular, la productividad específica de las células, de factor VIII recombinante (rFVIII) […]
 Procedimiento de producción de gránulos liofilizados que comprenden el factor VIII, del 25 de Diciembre de 2019, de Bayer Pharma Aktiengesellschaft: Un procedimiento de producción de gránulos liofilizados que comprende factor VIII, comprendiendo el procedimiento las etapas de:
a) congelar gotitas de una solución que comprende […]
Procedimiento de producción de gránulos liofilizados que comprenden el factor VIII, del 25 de Diciembre de 2019, de Bayer Pharma Aktiengesellschaft: Un procedimiento de producción de gránulos liofilizados que comprende factor VIII, comprendiendo el procedimiento las etapas de:
a) congelar gotitas de una solución que comprende […]