PROCEDIMIENTO DE PREPARACION DE INHIBIDORES DE POLI(ADP-RIBOSA)-POLIMERASAS.
Un procedimiento de preparación de un compuesto de fórmula I
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/IB2005/002881.
Solicitante: PFIZER, INC.
CANCER RESEARCH TECHNOLOGY LIMITED.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 235 EAST 42ND STREET,NEW YORK, NY 10017.
Inventor/es: MA,CHUNRONG AGOURON PHARMACEUTICALS,INC, NAYYAR,NARESH AGOURON PHARMACEUTICALS,INC, STANKOVIC,N. S. AGOURON PHARMACEUTICALS,INC.
Fecha de Publicación: .
Fecha Concesión Europea: 23 de Diciembre de 2009.
Clasificación Internacional de Patentes:
- C07D487/06 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 487/00 Compuestos heterocíclicos que contienen átomos de nitrógeno como únicos heteroátomos del ciclo en el sistema condensado, no previstos por los grupos C07D 451/00 - C07D 477/00. › Sistemas peri-condensados.
Clasificación PCT:
- C07D487/06 C07D 487/00 […] › Sistemas peri-condensados.
Clasificación antigua:
- C07D20/900
- C07D22/300
- C07D48/706
Fragmento de la descripción:
Procedimiento de preparación de inhibidores de poli(ADP-ribosa)-polimerasas.
Campo de la invención
La presente invención generalmente se refiere a procedimientos de preparación de compuestos que inhiben poli(ADP-ribosa)-polimerasas, retardando de este modo la reparación del daño a hebras de DNA. El procedimiento de la invención es particularmente útil en la preparación de compuestos que son útiles para la potenciación de terapias anticancerígenas.
Antecedentes de la invención
El compuesto 8-fluoro-2-{4-[(metilamino)metil]fenil}-1,3,4,5-tetrahidro-6H-azepino[5,4,3-cd]indol-6-ona representado por la fórmula

es un inhibidor de molécula pequeña de poli(ADP-ribosa)-polimerasa (PARP). Se revelan 8-fluoro-2-{4-[(me-tilamino)metil]fenil}-1,3,4,5-tetrahidro-6H-azepino[5,4,3-cd]indol-6-ona y sales de la misma en la Patente de los Estados Unidos N.º: 6,495,541 y la Solicitud PCT N.º: PCT/IB2004/000915, la Publicación Internacional N.º: WO 2004/087713, las Solicitudes de Patente Provisionales de los Estados Unidos N.º: 60/612.459 y 60/679,296, titulada "Polymorphic Forms of the Phosphate Salt of 8-Fluoro-2-{4-[(methylamino)methyl]phenyl}-1,3,4,5-tetrahydro-6H-azepino[5,4,3-cd]indol-6-one", describen formas polimórficas novedosas de la sal de fosfato de 8-fluoro-2-{4-[(metilamino)metil]fenil}-1,3,4,5-tetrahidro-6H-azepino[5,4,3-cd]indol-6-ona, y procedimientos para su preparación. Las Solicitudes de Patente Provisionales de los Estados Unidos N.º: 60/612.458 y 60/683,006, titulada "Therapeutics Combinations Comprising Poly(ADP-Ribose) Polymerases Inhibitor", describen combinaciones farmacéuticas de 8-fluoro-2-{4-[(metilamino)metil]fenil}-1,3,4,5-tetrahidro-6H-azepino[5,4,3-cd]indol-6-ona.
Hasta la fecha, se han identificado dieciocho enzimas por homología de secuencia de DNA en la familia PARP y se han investigado las propiedades bioquímicas y enzimáticas de siete: PARP-1 y PARP-2 se estimulan por roturas en hebras de DNA, PARP-3 interacciona con PARP-1 y el centrosoma, PARP-4 también conocida como PARP de vault (VPARP) es la PARP más grande y está asociada con vaults citoplásmicos, tankirasa 1 y 2 (PARP-5a y PRAP-5b) están asociadas con proteínas teloméricas y la función de PARP-7(TiPARP) no está clara actualmente pero puede estar implicada en la función de las células T y puede poli-ADP-ribosilar histonas (AmeJC, Splenlehauer C. y de Murcia G. The PARP Superfamily: Bioessays 26: 882-893 (2004)). Estudios farmacológicos han mostrado que el compuesto de fórmula 1 es un inhibidor de PARP-1 (Ki = 1,4 nM) y PARP-2 (Ki = 0,17 nM). En base a similaridades estructurales en las secuencias de aminoácidos entre las enzimas de PARP, el compuesto de fórmula 1 probablemente se une con alta afinidad a los otros miembros de la familia también.
La reparación mediada por enzimas de roturas en la hebra simple o doble del DNA es un mecanismo potencial de resistencia a radioterapia o drogas citotóxicas cuyo mecanismo depende de daño de DNA. La inhibición de enzimas reparadoras del DNA es así una estrategia para la potenciación de estos agentes. PARP-1, el miembro mejor caracterizado de la familia de las PRAP, es una enzima nuclear que tras activación por daño en el DNA media la transferencia de fragmentos de ADP-ribosa a partir de NAD+ a un número de proteínas aceptoras. Dependiendo de la extensión del daño de DNA sufrido, la activación de PARP-1 y la subsiguiente poli(ADP-ribosil)ación median la reparación del DNA dañado o inducen muerte celular. Cuando el daño de DNA es moderado, PARP-1 juega un papel significativo en el proceso de reparación de DNA. En cambio, en el caso de daño de DNA masivo, la activación excesiva de PARP-1 agota las reservas de ATP (en un esfuerzo por reponer NAD+, lo que en última instancia conduce a mortalidad celular por necrosis (Tentori L., Portarena I., Graziani G. Potential applications of poly(ADP-ribose) polymerase (PARP) inhibitors. Pharmacol. Res. 2002; 45:73-85)).
Como el resultado del papel dual de PARP-1, los inhibidores de esta enzima, tales como 8-fluoro-2-{4-[(metilami-no)metil]fenil}-1,3,4,5-tetrahidro-6H-azepino[5,4,3-cd]indol-6-ona, pueden tener un papel como agentes quimiosensibilizantes (evitando la reparación de DNA, por ejemplo, después de terapia anticancerígena), o como tratamientos para una diversidad de estados morbosos y tóxicos que implican estrés oxidativo o inducido por óxido nítrico e hiperactivación de PARP subsiguiente. Tales afecciones incluyen trastornos neurológicos y neurodegenerativos (por ejemplo, enfermedad de Parkinson, enfermedad de Alzheimer) (Love S., Barber, R., Wilcock G.K. Increased poly(ADP-ribosyl)ation of nuclear proteins in Alzheimer's disease. Brain 1999; 122: 247-53; Mandir A.S., Przedborski, S., Jackson-Lewis V., y col. Poly(ADP-ribose) polymerase activation mediates 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine (MPTP)-induced parkinsonism. Proc. Natl. Acad. Sci. EE.UU. 1999; 96: 5774-9), trastornos cardiovasculares (por ejemplo, infarto de miocardio, daño por isquemia-reperfusión) (Pieper A.A., Walles T., Wei G., y col. Myocardial postischemic injury is reduced by poly(ADP-ribose) polymerase-1 gene disruption. J. Mol. Med. 2000; 6: 271-82; Szabó G., Bärhrle S., Stumpf N., y col. Poly(ADP-ribose) polymerase inhibition reduces reperfusion injury after heart transplantation. Circ. Res. 2002; 90: 100-6; Patente de los Estados Unidos 6,423,705), enfermedades inflamatorias, (Szabó C., Dawson V. Role of poly(ADP-ribose) synthetase in inflammation and ischaemia-reperfusion. TIPS 1998; 19: 287-98), disfunción vascular diabética (Soriano F.G., Virág L., Szabó C. Diabetic endotelial dysfunction: role of reactive oxygen and nitrogen species production and poly(ADP-ribose) polymerase activation. J. Mol. Med. 2001; 79: 437-448), artritis (Szabó C., Virág L., Cuzzocrea S., y col. Protection against peroxynitrite-induced fibroblast injury and arthritis development by inhibition of poly(ADP-ribose) synthase. Proc. Natl. Acad. Sci. EE.UU. 1998; 95: 3867-3872), y nefrotoxicidad inducida por cisplatina (Racz I., Tory K., Gallyas F., y col. BGP-15 -a novel poly(ADP-ribose) polymerase inhibitor- protects against nephrotoxicity of cisplatin without compromising its antitumor activity. Biochem Pharmacol 2002; 63: 1099-1111). Además, se mostró que las células tumorales deficientes en BRCA2 son agudamente sensibles a inhibidores de PARP-1 (Bryant y col. "Specific killing of BRCA2 deficient tumors with inhibitors of poly(ADP-ribose) polymerase", presentado para publicación). Los inhibidores de PARP están también implicados en potenciar la inducción de la expresión de gen Reg en células ß y de gen HFG y, de acuerdo con ello, en promover la proliferación de células ß-pancreáticas de los islotes de Langerhans y suprimir la apoptosis de las células (Publicación de Solicitud de Patente de los Estados Unidos 2004/0091453; Publicación PCT N.º WO 02/00665). Además, los inhibidores de PARP se usan también en preparaciones cosméticas, especialmente en lociones para después del sol (Publicación PCT N.º WO 01/82877). No hay inhibidores de PARP comercializados actualmente.
Un procedimiento de sintetizar 8-fluoro-2-{4-[(metilamino)metil]fenil}-1,3,4,5-tetrahidro-6H-azepino[5,4,3-cd]indol-6-ona se revela en Patente de los Estados Unidos N.º 6,495,541 referida anteriormente. Este procedimiento es una síntesis de 10 etapas lineal, que implica una etapa de formación de indol de Leimgruber-Batcho clave y una reacción de acoplamiento de Suzuki. Aunque la vía actual es una vía de síntesis efectiva empleada en la síntesis de lotes de toxicología y clínicos de 8-fluoro-2-{4-[(metilamino)metil]fenil}-1,3,4,5-tetrahidro-6H-azepino[5,4,3-cd]indol-6-ona, sería deseable tener una vía alternativa convergente para elaboración comercial eventual. La presente invención proporciona una vía nueva y convergente para 8-fluoro-2-{4-[(metilamino)metil]fenil}-1,3,4,5-tetrahidro-6H-azepino[5,4,3-cd]indol-6-ona, vía que se desarrolla por medio de una reacción de acoplamiento de Sonogashira clave y una formación de indol promovida por CuI.
Sumario de la invención
En una realización, la presente invención proporciona un procedimiento para preparar un compuesto de fórmula I

en la que R1 es:
H;
ciano;
un grupo alquilo, alquenilo, alquinilo, cicloalquilo, heterocicloalquilo,...
Reivindicaciones:
1. Un procedimiento de preparación de un compuesto de fórmula I

en la que R1 es:
H;
ciano;
un grupo alquilo, alquenilo, alquinilo, cicloalquilo, heterocicloalquilo, arilo, o heteroarilo opcionalmente sustituido o insustituido; o
-C(=)-R5, donde R5 es: H; un grupo alquilo, alquenilo, alquinilo, cicloalquilo, heterocicloalquilo, arilo, o heteroarilo opcionalmente insustituido o sustituido; u OR6 o NR6R7, donde R6 y R7 son cada uno independientemente H o un grupo alquilo, alquenilo, alquinilo, cicloalquilo, heterocicloalquilo, arilo, o heteroarilo opcionalmente sustituido o insustituido;
R2 es H o alquilo;
R3 es H o alquilo;
R4 es H, halógeno o alquilo,
y en la que, en cada aparición:
"alquilo" quiere decir un grupo hidrocarburo parafínico (grupo alifático saturado) de cadena ramificada o recta (lineal) que tiene desde 1 hasta 10 átomos de carbono en su cadena;
"alquenilo" quiere decir un grupo hidrocarburo olefínico (grupo alifático insaturado que tiene uno o más dobles enlaces) de cadena ramificada o recta que contiene desde 2 hasta 10 átomos de carbono en su cadena;
"alquinilo" quiere decir un grupo hidrocarburo de cadena ramificada o recta que tiene uno o más enlaces triples carbono-carbono, y que tiene desde 2 hasta 10 átomos de carbono en su cadena;
"grupo cicloalquilo" quiere decir una estructura de anillo monovalente, monocíclica o policíclica condensada, no aromática que tiene un total desde 3 hasta 18 átomos de anillo (pero no heteroátomos);
"grupo heterocicloalquilo" quiere decir una estructura de anillo monovalente, monocíclica o policíclica condensada, no aromática que tiene un total desde 3 hasta 18 átomos de anillo, incluyendo 1 a 5 heteroátomos seleccionados de nitrógeno, oxígeno y azufre,
"arilo" quiere decir una estructura de anillo monocíclica o policíclica condensada aromática que tiene desde 4 hasta 18 átomos de carbono de anillo (sin ningún heteroátomo); y
"grupo heteroarilo" quiere decir una estructura de anillo monovalente, monocíclica o policíclica condensada, aromática que tiene desde 4 hasta 18 átomos de carbono de anillo, incluyendo desde 1 hasta 5 heteroátomos seleccionados de nitrógeno, oxígeno y azufre,
el procedimiento comprende:
a) acoplamiento de Sonogashira de un compuesto de fórmula II, en el que X es halógeno o CF3SO2-O-

con un compuesto de fórmula III

para formar un compuesto de fórmula IV;

b) reducir el compuesto de fórmula IV para generar un compuesto de fórmula V;

c) convertir el compuesto de fórmula V en un compuesto de fórmula VI; y

d) convertir el compuesto de fórmula VI en el compuesto de fórmula 1.
2. El procedimiento de la reivindicación 1, en el que la etapa c) comprende una formación de indol promovida por CuI.
3. Un procedimiento de preparación de 8-fluoro-2-{4-[(metilamino)metil]fenil}-1,3,4,5-tetrahidro-6H-azepino[5,4,3-cd]indol-6-ona, el procedimiento comprende el acoplamiento de Sonogashira de un compuesto de fórmula VII, en el que X es CF3SO2-O o halógeno,
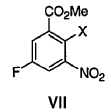
con éster metílico del ácido (4-etinil-bencil)-metil-carbámico para formar éster metílico del ácido 5-fluoro-2-{4-[(metoxicarbonil-metil-amino)-metil]-feniletinil}-3-nitro-benzoico.
4. El procedimiento de la reivindicación 3, en el que X es CF3SO2-O-.
5. El procedimiento de la reivindicación 3, en el que X es bromo.
6. El procedimiento de la reivindicación 3 que comprende adicionalmente:
a) reducir éster metílico del ácido 5-fluoro-2-{4-[(metoxicarbonil-metil-amino)-metil]-feniletinil}-3-nitro-benzoico a éster metílico del ácido 3-amino-5-fluoro-2-{4-[(metoxicarbonil-metil-amino)-metil]-feniletinil}-benzoico;
b) convertir éster metílico del ácido 3-amino-5-fluoro-2-{4-[(metoxicarbonil-metil-amino)-metil]-feniletinil}-ben-zoico en 6-fluoro-2-{4-[(metoxicarbonil-metil-amino)-metil]-fenil}-1H-indol-4-carboxílico;
c) tratar éster metílico del ácido 6-fluoro-2-{4-[(metoxicarbonil-metil-amino)-metil]-fenil}-1H-indol-4-carboxílico con N,N-dimetil-2-nitroetilenoamina para generar éster metílico del ácido 6-fluoro-2-{4-[(metoxicarbonilmetil-amino)-metil]-fenil}-3-((E)-2-nitro-vinil)-1H-indol-4-carboxílico;
d) reducir éster metílico del ácido 6-fluoro-2-{4-[(metoxicarbonil-metil-amino)-metil]-fenil}-3-((E)-2-nitro-vinil)-1H-indol-4-carboxílico en éster metílico del ácido 6-fluoro-2-{4-[(metoxicarbonil-metil-amino)-metil]-fenil}-3-(2-nitro-etil)-1H-indol-4-carboxílico;
e) convertir éster metílico del ácido 6-fluoro-2-{4-[(metoxicarbonil-metil-amino)-metil]-fenil}-3-(2-nitro-etil)-1H-indol-4-carboxílico en éster metílico del ácido [4-(8-fluoro-6-oxo-3,4,5,6-tetrahidro-1H-azepino[5,4,3-cd]indol-2-il)-bencil]-metil-carbámico; y
f) desproteger éster metílico del ácido [4-(8-fluoro-6-oxo-3,4,5,6-tetrahidro-1H-azepino[5,4,3-cd]indol-2-il)-bencil]-metil-carbámico para producir 8-fluoro-2-{4-[(metilamino)metil]fenil}-1,3,4,5-tetrahidro-6H-azepino[5,4,3-cd]indol-6-ona.
7. El procedimiento de la reivindicación 6, en el que la etapa b) comprende una formación de indol promovida por CuI.
8. El procedimiento de la reivindicación 6, en el que la etapa e) comprende hidrogenación.
Patentes similares o relacionadas:
Compuestos heterocíclicos tricíclicos sustituidos, del 22 de Abril de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de fórmula (I) **(Ver fórmula)** o un estereoisómero, un tautómero, una sal farmacéuticamente aceptable o un solvato del mismo, […]
Compuestos heterocíclicos útiles como inhibidores de TNF, del 22 de Abril de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de fórmula (I) **(Ver fórmula)** o un estereoisómero, un tautómero, una sal farmacéuticamente aceptable o un solvato del mismo, […]
Compuestos heterocíclicos tricíclicos útiles como inhibidores de TNF, del 22 de Abril de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de fórmula (I) **(Ver fórmula)** o un estereoisómero, un tautómero, una sal farmacéuticamente aceptable o un solvato del mismo, en donde: X […]
Procedimiento para la obtención de enantiómeros de pirlindol ópticamente activos y sales de los mismos, del 28 de Agosto de 2019, de TECNIMEDE-SOCIEDADE TECNICO-MEDICINAL, S.A.: Procedimiento para obtener enantiómeros de pirlindol ópticamente activos, en forma de una base libre o en forma de una sal farmacéuticamente aceptable caracterizado […]
Agonistas y composiciones del receptor 5-HT2C y métodos de uso, del 21 de Agosto de 2019, de ARENA PHARMACEUTICALS, INC.: Un compuesto seleccionado de los siguientes compuestos, y las sales, hidratos y solvatos farmacéuticamente aceptables de los mismos: N-(2,2-difluoroetil)-7-metil-1,2,3,4,6,7-hexahidro-[1,4]diazepino […]
Sales y polimorfos de 8-fluoro-2-{4-[(metilamino}metil]fenil}-1,3,4,5-tetrahidro-6H-azepino[5,4,3-cd]indol-6-ona, del 31 de Julio de 2019, de PFIZER INC.: Una sal para su uso en un método de inhibición de la actividad poli(ADP-ribosa) polimerasa (PARP) en un mamífero, comprendiendo el método administrar al mamífero […]
Intermediarios para la síntesis de ligadores P1 cíclicos como inhibidores del factor XIA, del 10 de Abril de 2019, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de la Fórmula 14i:**Fórmula** en el que: el anillo A se selecciona del grupo que consiste en un arilo de 6 miembros y […]
Macrociclos como inhibidores del factor XIa, del 2 de Mayo de 2018, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de Formula (I):**Fórmula** o un estereoisomero, un tautomero, una sal farmaceuticamente aceptable, un solvato del mismo, en donde: […]