PEPTIDO MODULADOR DE LA ACTIVACION DE CASPASA.
Un péptido correspondiente al sitio apoptóticamente activo de alfa-fetoproteína humana ubicado en los restos de aminoácidos 251-259 de dicha proteína,
que tiene la secuencia de aminoácidos C*C*RGDVLDC*, en la que los restos marcados como asterisco indican posiciones de posibles puentes disulfuro
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/FI2003/000735.
Solicitante: DUDICH, ELENA IVANOVNA
TATULOV, EDUARD BORISOVICH.
Nacionalidad solicitante: Federación de Rusia.
Dirección: SPORTIVNAYA UL. 11-55 CHEKHOV DIS., MOSKOSKAYA OBL.,LYUBICHANY 142380.
Inventor/es: DUDICH,ELENA IVANOVA, SEMENKOVA,LIDIA NIKOLAEVNA, DUDICH,IGOR VYACHESLAVOVICH, TATULOV,EDUARD BORISOVICH, ZUBOV,DMITRY LVOVICH, KORPELA,TIMO KALEVI.
Fecha de Publicación: .
Fecha Concesión Europea: 9 de Junio de 2010.
Clasificación Internacional de Patentes:
- C07K16/18 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › contra materiales animales o humanos.
- C07K7/06A
Clasificación PCT:
- A61K38/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00).
- A61P37/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Medicamentos para el tratamiento de problemas inmunológicos o alérgicos.
- C07K16/42 C07K 16/00 […] › contra inmunoglobulinas (anticuerpos anti-idiotípicos).
- C07K7/00 C07K […] › Péptidos con 5 a 20 aminoácidos en una secuencia totalmente determinada; Sus derivados.
Clasificación antigua:
- A61K38/00 A61K […] › Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00).
- A61P37/00 A61P […] › Medicamentos para el tratamiento de problemas inmunológicos o alérgicos.
- C07K16/42 C07K 16/00 […] › contra inmunoglobulinas (anticuerpos anti-idiotípicos).
- C07K7/00 C07K […] › Péptidos con 5 a 20 aminoácidos en una secuencia totalmente determinada; Sus derivados.
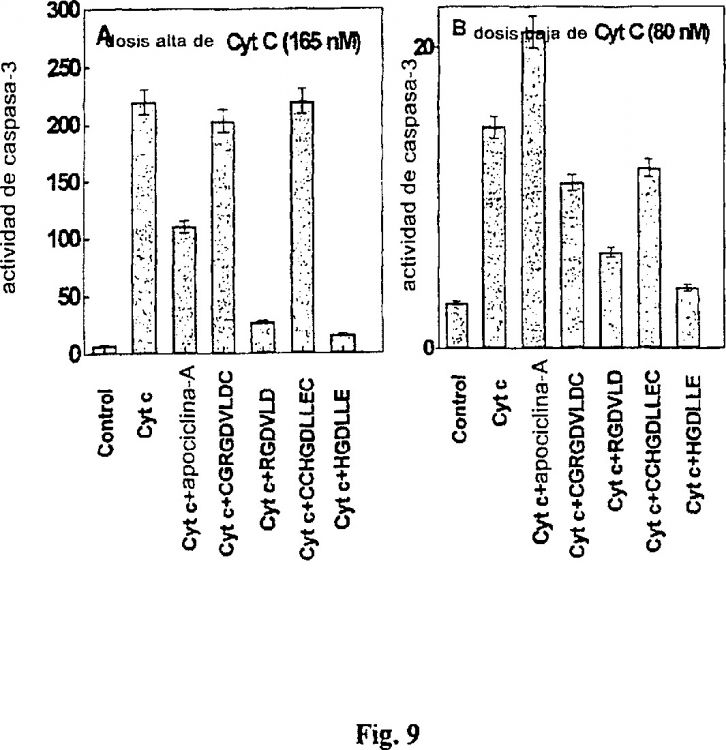
Fragmento de la descripción:
Péptido modulador de la activación de caspasa.
Campo de la invención
La presente invención se refiere a la medicina y a mecanismos de muerte de células humanas y animales. En particular, la invención se refiere a péptidos capaces de inhibir la muerte celular apoptótica inducida por diferentes factores. La invención describe péptidos con dichas actividades y métodos de producción y uso de dichos péptidos.
Antecedentes de la invención
La apoptosis es una forma activa de muerte celular que está implicada en múltiples procesos del desarrollo celular normal, así como en transformaciones de células malignas. El mecanismo de apoptosis está implicado en sucesos biológicos inducidos por diversos tipos de fármacos, citoquinas y factores de crecimiento, estrés oxidativo, radiación, envejecimiento, enfermedades autoinmunes y rechazo inmune en el transplante de órganos. Estudios recientes sobre apoptosis demuestran que se emplean mecanismos moleculares comunes en diversos tipos de apoptosis, inducidos por hormonas, citoquinas, carencia de factor de crecimiento, agentes quimioterapéuticos, radiación ionizante, trastornos inmunológicos, SIDA, cáncer y envejecimiento (Nagata, (1997) Cell 88, 355-365).
La activación similar a una cascada de las proteasas caspasas representa el punto fundamental en la inducción de apoptosis (Cohen, et al. (1997) Biochem. J, 326: 1-16). Se describen dos tipos diferentes de señalización de apoptosis. La fase inicial del desencadenamiento de apoptosis dependiente de receptor incluye la activación de receptores de muerte apropiados mediante ligandos específicos, tales como TNF o FasL, que son actualmente los inductores de apoptosis más estudiados (Wallach et al. (1997). FEBS Letters, 410: 96-106). Después de la activación, los receptores de muerte de la superficie celular, Fas (CD95) o TNFR1, se unen a proteínas adaptadoras citosólicas (FADD, MORT, RIP, TRADD), que, a su vez, reclutan caspasa-8 para activar la cascada de proteasas (caspasas) de la familia de la enzima convertidora de interleuquina-1-ß ICE/CED-3, seguida de la activación de la subfamilia de CPP32/caspasa-3 de cisteína proteasas, cuyos miembros aparecen en el citoplasma celular en forma de precursores latentes, procaspasas (Enari, et al. (1996) Nature 380: 723-726). Los tipos de apoptosis independientes de receptor habitualmente incluyen mecanismos inducibles por el citocromo c de importancia crítica que requieren la formación del complejo terciario del citocromo c, dATP, Apaf-1 y procaspasa-9, que conduce a la activación de la última mediante autoproteolisis y homodimerización, y la posterior activación de la cascada de caspasas (Liu et al. (1996) Cell, 86: 147-157; Pan et. al., (1998) FEBS Letters, 426: 151-154; Slee et al., (1999) J Cell Biol., 144: 281-292).
Los agentes que afectan al control biológico de la apoptosis tienen, por lo tanto, una potencial utilidad terapéutica en numerosas aplicaciones clínicas. Una serie de inhibidores de apoptosis obtenidos de plantas se emplean para seleccionar trastornos patológicos que a menudo acompañan a la quimioterapia, radiación, trastornos inmunes, o SIDA. Estos suplementos contienen generalmente carbohidratos, grasas e hidrolizados de proteínas vegetales, lectinas, y fosfolípidos (US6004579, Barr et al.). Podían emplearse potentes reguladores de apoptosis en el tratamiento de pacientes de cáncer para controlar la terapia con citoquinas, quimioterapia, o radioterapia. Los mecanismos apoptóticos operan en los diversos tipos de trastornos inmunológicos, tales como neoplasias malignas autoinmunes, rechazo inmune en transplante de órganos o anafilaxis, o infecciones víricas por el virus de inmunodeficiencia humana.
La alfa-fetoproteína (AFP) es una glucoproteína fetal asociada a tumores que muestra una amplia gama de actividades biológicas, incluyendo regulación del crecimiento celular, diferenciación de células inmaduras, inmunosupresión de células inmunes activadas, inducción de apoptosis específica de tumores y regulación de señales apoptóticas mediadas por otros factores, así como regulación de diversas expresiones génicas (Deutsch, (1991) Adv. Cancer Res., 56: 253-312; Mizejewsky, (1997) Proc. Soc. Exp. Biol. Med., 215: 333-362). Múltiples pruebas de actividades reguladoras del crecimiento celular, incluyendo actividad supresora de tumores, se han descrito para diversas especies de molécula de AFP de longitud completa (Semenkova et al., (1997) Tumor Biology, 18: 261-274; Semeniuk et al, (1995) Ad Exper. Med. Biol., 383: 255- 269; Sonnenschein et al., (1980) J Natl Cancer Inst., 64: 1141-1146; Soto et al. , (1980) Proc. Natl Acad. Sci USA, 77: 2084-2087; Jacobson et al., (1999) Cancer Research, 50: 415-420), sus fragmentos proteolíticos (Dudich et al., (1999) Biochemistry, 38: 10406-10414) o dominios recombinantes (Festin et al., (1999) Biochim. Biophys. Acta, 1427: 307-314) y péptidos sintéticos (Mesfin et al., (2000) Biochim. Biophys. Acta, 1501: 33-43; Mizejewsky, et al., (1996) Mol. Cell. Endocr., 118: 15-23 (1996). La búsqueda de la ubicación de sitios activos funcionales de la molécula de AFP que sean responsables de sus múltiples actividades ha sido realizada por diversos investigadores. La ubicación de los sitios de unión de ácido araquidónico y estradiol ha tenido éxito (Deutsch, (1991) Adv. Cancer Res., 56: 253-312; Mizejewski, (1997) Proc. Soc. Exp. Biol. Med., 215: 333-362; Nishi et al., (1993) Tumor Biol. 14: 234-243).
Recientemente se demostró, que la AFP realiza su actividad supresora de tumores desencadenando apoptosis mediante la activación de caspasa-3 e independientemente de la señalización de Fas/FasL y TNF/TNFR (Dudich et al., (1999) Eur. J Biochem. 266: 1-13; Semenkova et al., (1997) Tumor Biology, 18: 261-274; Dudich et al. (1998) Tumor Biology, 19: 30-40). Se han descrito múltiples pruebas de la supresión del crecimiento de células tumorales mediada por AFP en la última década, pero el sitio activo de la molécula de AFP que es responsable de la señalización de apoptosis no ha sido identificado.
El ADN y las secuencias de aminoácidos de la AFP humana se han descrito (Morinaga, et. al.,"Primary structures of human alpha-fetoprotein and its mRNA" Proc. Natl. Acad. Sci. USA, 80: 4604-4608 (1983). Péptidos sintéticos, correspondientes al sitio de unión a E2 demostraron poseer actividad supresora de tumores (Patentes de Estados Unidos US5674842; 10/1997 Mizejewsky; US5707963.07/1998 Mizejewsky). Diversas proteínas biológicamente activas comparten una homología de secuencia con AFP (Mizejewsky, (1993) BioEssays, 15: 427-432; Mizejewsky, (1997) Proc. Soc. Exp. Biol. Med., 215: 333-362). Se ha identificado una auténtica homología de AFP con diversas proteínas, implicadas en la señalización de apoptosis, tales como Bcl2, TNFR1, Fas, etc. (Mizejewsky, (2001) Proc. Soc. Exp. Biol. Med). El documento WO 9835981 A1 (Economou, J. et al., 1998) describe el uso de 66 secuencias peptídicas de AFP que son útiles para inmunización contra el cáncer. Uno de los péptidos, A20, era CRGDVLDCL, que a propósito incluye una parte del sitio activo de AFP, descubierto por la presente invención. Sin embargo, no se descubrió ningún efecto especial del péptido CRGDVLDCL y la presente invención sigue siendo la primera capaz de identificar uno de los supuestos sitios biológicamente activos de AFP. Además, los péptidos de la presente invención incluyen un resto cisteína adicional que permite la formación de puentes disulfuro intercatenarios y producir una actividad biológica significativamente más alta que la secuencia CRGDVLDCL.
Un importante sitio de unión a integrina es un tripéptido Arg-Gly-Asp, que está presente en una serie de ligandos de integrina. Las integrinas son glucoproteínas heterodiméricas que median interacciones célula-matriz y célula-célula y tienen un papel activo en los procesos de diferenciación celular, reconocimiento inmune, desarrollo tumoral y crecimiento metastático. Se han identificado regiones de contacto para la secuencia Arg-Gly-Asp en las subunidades de integrina (véase Pasqualini, et al. "A peptide isolated from phage display libraries is a structural and functional mimic of an Arg-Gly-Asp-binding site on integrins". J Cell Biol. (1995) 130: 1189-1196). Los péptidos sintéticos que contienen el motivo Arg-Gly-Asp se usan como inhibidores de interacciones integrina-ligando (D'Souza et al. (1988) Science, 242: 91-93). Se ha descrito que los péptidos sintéticos que contienen el motivo Arg-Gly-Asp son capaces de dirigir...
Reivindicaciones:
1. Un péptido correspondiente al sitio apoptóticamente activo de alfa-fetoproteína humana ubicado en los restos de aminoácidos 251-259 de dicha proteína, que tiene la secuencia de aminoácidos C*C*RGDVLDC*, en la que los restos marcados como asterisco indican posiciones de posibles puentes disulfuro.
2. El péptido de acuerdo con la reivindicación 1, que tiene una estructura lineal.
3. El péptido de acuerdo con la reivindicación 1, que tiene una estructura polimerizada o cíclica.
4. El uso de un péptido de acuerdo con cualquiera de las reivindicaciones 1-3, para preparar una preparación para prevenir in vitro la apoptosis de células cultivadas preparadas para fines científicos o técnicos.
Patentes similares o relacionadas:
Anticuerpos anti-alfa-sinucleína y procedimientos de uso, del 29 de Julio de 2020, de F. HOFFMANN-LA ROCHE AG: Un anticuerpo anti-alfa-sinucleína humana que comprende (a) HVR-H1 que comprende la secuencia de aminoácidos de SEQ ID NO: 21; (b) HVR-H2 que […]
Terapia basada en anticuerpos de la amiloidosis por transtiretina (TTR) y anticuerpos de origen humano para ese propósito, del 22 de Julio de 2020, de Neurimmune Holding AG: Un anticuerpo anti-transtiretina (TTR) de origen humano o un fragmento de unión a antígeno del mismo, que es capaz de unirse a especies de TTR mutadas, mal plegadas, […]
Polipéptidos biparatópicos antagonistas de la señalización WNT en células tumorales, del 15 de Julio de 2020, de Boehringer Ingelheim International GmbH & Co. KG: Un polipéptido que se une específicamente a LRP5 o LRP6, que comprende - un primer dominio variable individual de inmunoglobulina seleccionado del grupo de dominios […]
PTPRS y proteoglicanos en enfermedad autoinmune, del 15 de Julio de 2020, de LA JOLLA INSTITUTE FOR ALLERGY AND IMMUNOLOGY: Una proteína recombinante no enzimática que comprende una secuencia de aminoácidos de un dominio extracelular de PTPRS, donde la proteína comprende tanto el dominio 1 (Ig1) […]
Redirectores de células T específicas de antígenos, del 1 de Julio de 2020, de THE JOHNS HOPKINS UNIVERSITY: Una nanoparticula que comprende en su superficie: (A) un anticuerpo que se une especificamente a un antigeno de celula diana o epitopo del mismo; y (B) un resto […]
Anticuerpos scFv que pasan las capas epitelial y/o endotelial, del 1 de Julio de 2020, de ESBATech, an Alcon Biomedical Research Unit LLC: Un anticuerpo monocatenario (scFv) que comprende: (a) un dominio variable de la cadena ligera (VL) que tiene tres regiones CDR de VL no […]
Moléculas de unión con cadena J modificada, del 24 de Junio de 2020, de IGM BIOSCIENCES, INC: Una molécula de unión que comprende un anticuerpo de IgM, IgA, IgG/IgM o IgG/IgA con una cadena J modificada, donde la cadena J modificada comprende una cadena […]
Terapia de combinación para tratamiento de enfermedad, del 24 de Junio de 2020, de Mereo BioPharma 5, Inc: Un anticuerpo antagonista del ligando 4 tipo delta (DLL4) para su uso en un procedimiento para tratar el cáncer, inhibir el crecimiento tumoral, mejorar […]