METODOS PARA LA ELIMINACION DE AMILOIDE USANDO ANTICUERPOS ANTIAMILOIDE.
El uso de:
a) una dosis terapéuticamente eficaz de al menos un anticuerpo o polipéptido de inmunoglobulina o un fragmento del mismo que se une a fibrilla de amiloide de IgLC humana;
y
b) un vehículo farmacéuticamente aceptable;
para la fabricación de un medicamento para el tratamiento de una enfermedad por deposición de amiloide en un paciente humano
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US99/11200.
Solicitante: THE UNIVERSITY OF TENNESSEE RESEARCH CORPORATION.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 1534 WHITE AVENUE, SUITE 403,KNOXVILLE, TN 37996-1527.
Inventor/es: SOLOMON,ALAN, HRNCIC,RUDI, WALL,JONATHAN,S.
Fecha de Publicación: .
Fecha Concesión Europea: 21 de Abril de 2010.
Clasificación Internacional de Patentes:
- C07K16/18 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › contra materiales animales o humanos.
Clasificación PCT:
- A61K39/395 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Anticuerpos (aglutininas A61K 38/36 ); Inmunoglobulinas; Inmunosuero, p. ej. suero antilinfocitario.
- C07K16/18 C07K 16/00 […] › contra materiales animales o humanos.
Clasificación antigua:
- A61K39/395 A61K 39/00 […] › Anticuerpos (aglutininas A61K 38/36 ); Inmunoglobulinas; Inmunosuero, p. ej. suero antilinfocitario.
- C07K16/18 C07K 16/00 […] › contra materiales animales o humanos.
Fragmento de la descripción:
Métodos para la eliminación de amiloide usando anticuerpos antiamiloide.
Campo técnico
La presente invención se refiere generalmente a composiciones para el uso en el tratamiento de enfermedades relacionadas con el amiloide. Específicamente, la presente invención proporciona usos terapéuticos relacionados con anticuerpos para efectuar la eliminación de fibrillas de amiloide por el propio sistema inmunofagocitario del paciente.
Antecedentes de la invención
Amiloidosis se refiere a la deposición patológica de proteínas en forma de fibrillas birrefringentes verdes congofílicas cuando se tiñen con rojo Congo, bien dispersadas o bien en forma de amiloidomas localizados. Tales depósitos son sintomáticos de varias enfermedades, por ejemplo la enfermedad de Alzheimer, amiloide asociado con la inflamación, diabetes tipo II, encefalopatía espongiforme bovina (BSE, por sus siglas en inglés), enfermedad de Creutzfeld-Jakob (CJD, por sus siglas en inglés), escrapie y amiloidosis primaria.
Las amiloidosis se clasifican generalmente en tres grupos: amiloidosis sistémicas principales, amiloidosis localizadas principales y amiloidosis heterogéneas. Las amiloidosis sistémicas principales incluyen: afecciones inflamatorias crónicas (p. ej., tuberculosis, osteomielitis, etc.); afecciones no infecciosas tales como artritis reumatoide juvenil, espondilitis anquilosante y enfermedad de Crohn, etc.; fiebre mediterránea familiar, discrasia de células plasmáticas (amiloidosis primaria) y diversas polineuropatías y cardiomiopatías familiares. Las amiloidosis localizadas principales incluyen: diálisis crónica habitualmente durante más de 8 años, enfermedad de Alzheimer, síndrome de Down, hemorragia cerebral hereditaria (holandesa) y hemorragia cerebral no traumática de la tercera edad. Las amiloidosis heterogéneas incluyen: polineuropatía familiar (Iowa), amiloidosis familiar (finlandesa), hemorragia cerebral hereditaria (islandesa), CJD, carcinoma medular del tiroides, amiloide auricular y diabetes mellitus (insulinomas). Otras amiloidosis incluyen las mencionadas en Louis W. Heck, "The Amyloid Diseases" en Cecil's Textbook of Medicine 1504-6 (W.B. Saunders & Co., Filadelfia, PA; 1996).
Encefalopatías espongiformes trasmisibles que provocan CJD y enfermedad de Gerstmann-Strässler-Scheinker (GSS) son descritas por B. Chesebro et ál., "Transmissible Spongiform Encephalopathies: A Brief Introduction" en FIELD'S VIROLOGY 2845-49 (3ª Edición; Raven Publishers, Filadelfia, PA; 1996) y en D.C. Gajdusek, "Infectious amyloids: Subacute Spongiform Encephalopathies as Transmissible Cerebral Amyloidoses", 2851-2900 en FIELDS VIROLOGY (1996). Muchas de estas enfermedades probablemente están mediadas por priones, una proteína infecciosa. Véanse S.B. Prusiner, "Prions" en FIELDS VIROLOGY 2901-50 (1996) y las referencias contenidas allí. Las formas hereditarias de amiloidosis se describen en Online Mendelian Inheritance in Man (OMIM) www.ncbi.nlm.nih.gov/htbin-post/Omim/dispmim?. Cada una de las anteriores se incorpora en la presente memoria mediante referencia.
Muy raramente los pacientes con amiloidosis clínicamente probada alcanzan espontáneamente una remisión completa, quizá debido a que las propias fibrillas de amiloide son no inmunogénicas. Se han investigado diversas terapias para la amiloidosis, tales como quimioterapia en altas dosis, esteroides, doxorrubicina yodada y terapia de sustitución con células pluripotenciales. Sin embargo, en solo un tipo de enfermedad amiloidea, la amiloidosis mediterránea familiar, el tratamiento farmacológico (con colchicina) ha resultado ser eficaz.
Se conoce el uso de anticuerpos monoclonales (mAb) para inducir o modular la eliminación inmunológica de una entidad por lo demás no reconocida. Se han usado satisfactoriamente mAb para tratar linfoma no Hodgkins y cáncer de mama, por ejemplo.
Previamente, una variedad de estudios han caracterizado anticuerpos que se unen a proteínas amiloideas o fibrillas de amiloide. Véanse, por ejemplo, las Patentes de EE. UU. Nº 5.714.471, 5.693.478, 5.688.651, 5.652.092, 5.593.846, 5.536.640, 5.385.915, 5.348.963, 5.270.165, 5.262.332, 5.262.303, 5.164.295 y 4.782.014. Además, varias publicaciones han sugerido que podrían usarse anticuerpos antiamiloide para estudiar el avance de la beta-amiloidosis y para diversas opciones terapéuticas. Véanse, por ejemplo, Bellottii et ál., Scand. J. Immunol. (1992) 36(4):607-615; Bellotti et ál, Ren. Fail. (1993) 15(3):365-371; Walker et ál J. Neuropathol. Exp. Neurol. (1994) 53(4):377-383; y Bickel et ál., Bioconjug. Chem. (1994) 5(2):119-125. Sin embargo, no se ha demostrado que ningún anticuerpo terapéutico detenga o invierta la deposición de fibrillas de amiloide en un paciente. Así, existe una necesidad de un método para tratar amiloidosis usando formulaciones de anticuerpo que contengan anticuerpos que se unan a fibrillas de amiloide.
WO 96/25435 divulga métodos in vitro para marcar placas amiloideas presentes en el cerebro de un paciente humano, usando técnicas inmunohistoquímicas que implican anticuerpos monoclonales que se unen a péptido beta-A4.
"Bioconjugate Chem.: volumen 5, páginas 119-125, (1994)" divulga la unión in vitro de anticuerpos monoclonales a capilares cerebrales aislados.
De acuerdo con la presente invención, se proporciona el uso de:
Además, de acuerdo con la presente invención se proporciona una composición farmacéutica que comprende una dosis terapéuticamente eficaz de al menos un anticuerpo o polipéptido de inmunoglobulina o fragmento del mismo, en la que el anticuerpo o polipéptido de inmunoglobulina o fragmento del mismo se une a fibrilla de amiloide de IgLC humana y es eficaz para potenciar la respuesta inmunitaria celular de un paciente para eliminar depósitos de amiloide del paciente.
Breve descripción de los dibujos
Figuras 1A y 1B. Las figuras 1A y 1B son fotografías reproducidas de un ratón Balb/c justo después de que se realice una inyección de amiloide (1A) y 14 días después de la inyección (1B). La zona se inyección estaba afeitada para ilustrar mejor la "joroba" provocada por la inyección del material amiloideo.
Figuras 2A-2B. Las Figuras 2A y 2B son fotografías reproducidas de neutrófilos humanos (núcleos multilobulados) que se adhieren a amiloide humano opsonizado in vitro.
Figuras 3A-3D. Las Figuras 3A-3D son fotografías reproducidas de muestras tisulares cargadas de amiloide teñidas inmunohistoquímicamente (20 aumentos). La Figura 3A es una muestra tisular procedente de un paciente con amiloidosis ?1 teñida con rojo Congo; los depósitos de amiloide, observados bajo luz polarizada, aparecen como partículas de color verde azulado. La Figura 3B es una muestra tisular teñida con fosfatasa alcalina después de marcar con mAb anti-?I (57-18-H12). La Figura 3C es una muestra tisular teñida como en la Figura 3B, pero con mAb anti-?IV (11-1F4). La Figura 3D es una muestra tisular teñida como en la Figura 3B, pero con mAb anti-?VIII (31-8c7).
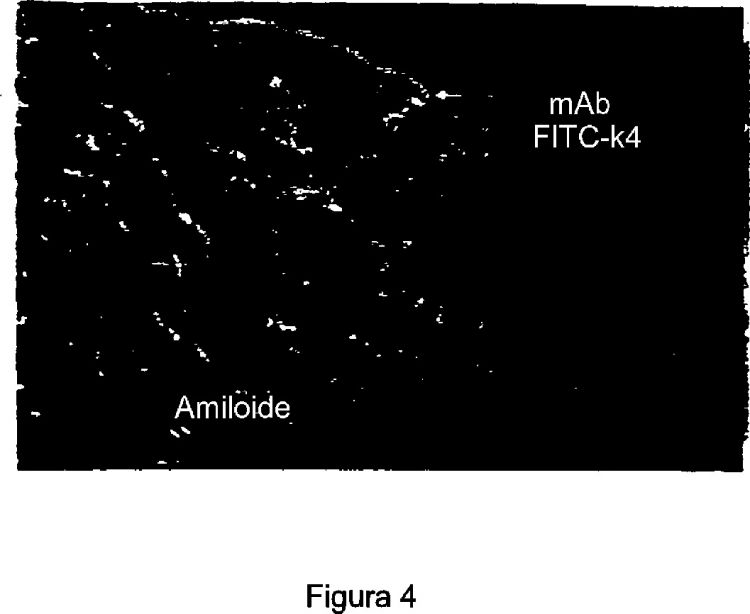
Figura 4. La Figura 4 es una fotografía reproducida que muestra un mAb ?4 fluoresceinado (FITC) unido a amiloide humano implantado en un ratón Balb/c. El mAb se inyectó en el muslo del ratón. El amiloidoma se extirpó 72 horas después de la inyección y se observó usando un microscopio de epifluorescencia (20 aumentos).
Modos para llevar a cabo la invención
La presente invención utiliza polipéptidos de inmunoglobulina para modular y para potenciar la degradación y la eliminación de depósitos no deseados de fibrillas de amiloide en un huésped o paciente. Se prevé que la invención se use, por ejemplo, para tratar a seres humanos que sufren una enfermedad o afección caracterizada por una deposición no deseada de fibrillas de amiloide. Sin pretender limitarse a ningún mecanismo de acción particular, se cree que la administración de péptidos de inmunoglobulina usada en la presente invención opsoniza las fibrillas de amiloide depositadas en un paciente...
Reivindicaciones:
1. El uso de:
para la fabricación de un medicamento para el tratamiento de una enfermedad por deposición de amiloide en un paciente humano.
2. El uso de acuerdo con la reivindicación 1, en el que el anticuerpo o polipéptido de inmunoglobulina o fragmento del mismo se produce contra una cadena ligera de inmunoglobulina.
3. El uso de acuerdo con la reivindicación 1 ó 2, en el que el anticuerpo o polipéptido de inmunoglobulina o fragmento del mismo es un anticuerpo monoclonal.
4. El uso de acuerdo con la reivindicación 3, en el que el anticuerpo monoclonal es un anticuerpo completamente humano.
5. El uso de acuerdo con la reivindicación 3, en el que el anticuerpo monoclonal es un anticuerpo humanizado.
6. El uso de acuerdo con la reivindicación 3, en el que el anticuerpo monoclonal es un anticuerpo quimérico.
7. El uso de acuerdo con la reivindicación 6, en el que el anticuerpo quimérico es un anticuerpo humanizado.
8. El uso de acuerdo con la reivindicación 3, en el que el anticuerpo es un anticuerpo marcado.
9. El uso de acuerdo con la reivindicación 1, en el que el fragmento de anticuerpo o inmunoglobulina es un fragmento Fv, un fragmento Fab, un fragmento F(ab''), un fragmento F(ab')2 o un fragmento SvFv.
10. El uso de acuerdo con la reivindicación 1, en el que el anticuerpo o polipéptido de inmunoglobulina o fragmento es un anticuerpo monocatenario.
11. El uso de acuerdo con la reivindicación 1, en el que el anticuerpo o polipéptido de inmunoglobulina o fragmento tiene reactividad isotípica cruzada.
12. El uso de acuerdo con la reivindicación 1, en el que el anticuerpo o polipéptido de inmunoglobulina o fragmento del mismo se ha producido contra fibrillas de amiloide sintéticas.
13. Una composición que comprende una dosis terapéuticamente eficaz de al menos un anticuerpo o polipéptido de inmunoglobulina o fragmento del mismo que se une a fibrilla de IgLC humana; y
b) un vehículo farmacéuticamente aceptable;
para el uso en el tratamiento de cualquier enfermedad por deposición de amiloide en un paciente humano.
14. La composición de acuerdo con la reivindicación 13, en la que el anticuerpo o polipéptido de inmunoglobulina o fragmento del mismo se produce contra una cadena ligera de inmunoglobulina.
15. La composición de acuerdo con la reivindicación 13 ó 14, en la que el anticuerpo o polipéptido de inmunoglobulina o fragmento del mismo es un anticuerpo monoclonal.
16. La composición de acuerdo con la reivindicación 15, en la que el anticuerpo monoclonal es un anticuerpo completamente humano.
17. La composición de acuerdo con la reivindicación 15, en la que el anticuerpo monoclonal es un anticuerpo humanizado.
18. La composición de acuerdo con la reivindicación 15, en la que el anticuerpo monoclonal es un anticuerpo quimérico.
19. La composición de acuerdo con la reivindicación 18, en la que el anticuerpo quimérico es un anticuerpo humanizado.
20. La composición de acuerdo con la reivindicación 15, en la que el anticuerpo es un anticuerpo marcado.
21. La composición de acuerdo con la reivindicación 13, en la que el fragmento de anticuerpo o inmunoglobulina es un fragmento Fv, un fragmento Fab, un fragmento F(ab''), un fragmento F(ab')2 o un fragmento SvFv.
22. La composición de acuerdo con la reivindicación 13, en la que the anticuerpo o polipéptido de inmunoglobulina o fragmento es un anticuerpo monocatenario.
23. La composición de acuerdo con la reivindicación 13, en la que el anticuerpo o polipéptido de inmunoglobulina o fragmento tiene reactividad isotípica cruzada.
24. La composición de acuerdo con la reivindicación 13, en la que el anticuerpo o polipéptido de inmunoglobulina o fragmento del mismo se ha producido contra fibrillas de amiloide sintéticas.
25. Una composición farmacéutica para el uso en terapia, que comprende una dosis terapéuticamente eficaz de al menos un anticuerpo o polipéptido de inmunoglobulina o un fragmento del mismo, en la que el anticuerpo o polipéptido de inmunoglobulina o fragmento del mismo se une a fibrilla de amiloide de IgLC humana y es eficaz para potenciar la respuesta inmunitaria celular de un paciente para eliminar depósitos de fibrillas de amiloide del paciente.
26. La composición farmacéutica de acuerdo con la reivindicación 25, en la que el anticuerpo o polipéptido de inmunoglobulina o fragmento del mismo es un anticuerpo monoclonal o un fragmento del mismo.
27. La composición farmacéutica de acuerdo con la reivindicación 26, en la que el anticuerpo monoclonal es un anticuerpo completamente humano.
28. La composición farmacéutica de acuerdo con la reivindicación 26, en la que el anticuerpo monoclonal es un anticuerpo humanizado.
29. La composición farmacéutica de acuerdo con la reivindicación 26, en la que el anticuerpo es un anticuerpo marcado.
30. La composición farmacéutica de acuerdo con la reivindicación 25, en la que el fragmento de anticuerpo o inmunoglobulina es un fragmento Fv, un fragmento Fab, un fragmento F(ab''), un fragmento F(ab')2 o un fragmento SvFv.
31. La composición farmacéutica de acuerdo con la reivindicación 25, en la que el anticuerpo o polipéptido de inmunoglobulina o fragmento del mismo es un anticuerpo monocatenario.
32. La composición farmacéutica de acuerdo con la reivindicación 25, en la que el anticuerpo o polipéptido de inmunoglobulina o fragmento del mismo tiene reactividad isotípica cruzada.
33. La composición farmacéutica de acuerdo con una cualquiera de las reivindicaciones 25 a 32, en donde la composición comprende además un vehículo.
Patentes similares o relacionadas:
Anticuerpos anti-alfa-sinucleína y procedimientos de uso, del 29 de Julio de 2020, de F. HOFFMANN-LA ROCHE AG: Un anticuerpo anti-alfa-sinucleína humana que comprende (a) HVR-H1 que comprende la secuencia de aminoácidos de SEQ ID NO: 21; (b) HVR-H2 que […]
Terapia basada en anticuerpos de la amiloidosis por transtiretina (TTR) y anticuerpos de origen humano para ese propósito, del 22 de Julio de 2020, de Neurimmune Holding AG: Un anticuerpo anti-transtiretina (TTR) de origen humano o un fragmento de unión a antígeno del mismo, que es capaz de unirse a especies de TTR mutadas, mal plegadas, […]
Polipéptidos biparatópicos antagonistas de la señalización WNT en células tumorales, del 15 de Julio de 2020, de Boehringer Ingelheim International GmbH & Co. KG: Un polipéptido que se une específicamente a LRP5 o LRP6, que comprende - un primer dominio variable individual de inmunoglobulina seleccionado del grupo de dominios […]
PTPRS y proteoglicanos en enfermedad autoinmune, del 15 de Julio de 2020, de LA JOLLA INSTITUTE FOR ALLERGY AND IMMUNOLOGY: Una proteína recombinante no enzimática que comprende una secuencia de aminoácidos de un dominio extracelular de PTPRS, donde la proteína comprende tanto el dominio 1 (Ig1) […]
Anticuerpos scFv que pasan las capas epitelial y/o endotelial, del 1 de Julio de 2020, de ESBATech, an Alcon Biomedical Research Unit LLC: Un anticuerpo monocatenario (scFv) que comprende: (a) un dominio variable de la cadena ligera (VL) que tiene tres regiones CDR de VL no […]
Redirectores de células T específicas de antígenos, del 1 de Julio de 2020, de THE JOHNS HOPKINS UNIVERSITY: Una nanoparticula que comprende en su superficie: (A) un anticuerpo que se une especificamente a un antigeno de celula diana o epitopo del mismo; y (B) un resto […]
Terapia de combinación para tratamiento de enfermedad, del 24 de Junio de 2020, de Mereo BioPharma 5, Inc: Un anticuerpo antagonista del ligando 4 tipo delta (DLL4) para su uso en un procedimiento para tratar el cáncer, inhibir el crecimiento tumoral, mejorar […]
Formulación anti-IFNAR1 estable, del 24 de Junio de 2020, de ASTRAZENECA AB: Una formulacion de anticuerpo que comprende: a. De 100 mg/ml a 200 mg/ml de anifrolumab; b. Lisina HCl 40 mM a 60 mM; c. Trehalosa […]