INHIBIDORES DE LA ENZIMA O6-ALQUILGUANINA-ADN-METIL-TRANSFERASA PARA EL TRATAMIENTO DEL CANCER.
Inhibidores de la ezcima O{sup,6}-alquilguaninna-ADN-metil-transferasa para el tratamiento del cáncer.
La presente invención se refiere al uso de compuesto derivados de piperadinil-metil-tetrazol -quinolinona como inhibidores de la acción reparadora de la ADN realizada por la enzima O{sup,6}-alquilguanina- ADN-alquiltransferasa y con composiciones farmacéuticas que los contienen, para la preparación de medicamentos coadyuvantes de la terapia antitumoral basada en agentes alquilantes
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P200702958.
Solicitante: CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS (TITULAR AL 51%)
CENTRO NACIONAL DE INVESTIGACIONES ONCOLOGICAS (TITULAR AL 49%).
Nacionalidad solicitante: España.
Provincia: MADRID.
Inventor/es: RAMIREZ ORTIZ,ANGEL, MORREALE DE LEON,ANTONIO JESUS, GIL REDONDO,RUBEN, RUIZ,FEDERICO, FABREGA CLAVERIA,CARME, BRAVO SICILIA,JERONIMO.
Fecha de Solicitud: 7 de Noviembre de 2007.
Fecha de Publicación: .
Fecha de Concesión: 6 de Septiembre de 2010.
Clasificación Internacional de Patentes:
- A61K31/4704 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › 2-Quinolonas, p. ej. carboestirilo.
- C07D401/06 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 401/00 Compuestos heterocíclicos que contienen dos o más heterociclos, que tienen átomos de nitrógeno como únicos heteroátomos del ciclo, siendo al menos un ciclo de seis miembros con solamente un átomo de nitrógeno. › unidos por una cadena de carbono que contiene solamente átomos de carbono alifáticos.
Clasificación PCT:
- A61K31/4704 A61K 31/00 […] › 2-Quinolonas, p. ej. carboestirilo.
- A61P35/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Agentes antineoplásicos.
- C07D401/06 C07D 401/00 […] › unidos por una cadena de carbono que contiene solamente átomos de carbono alifáticos.
Fragmento de la descripción:
Inhibidores de la enzima O6-alquilguanina-ADN-metil-transferasa para el tratamiento del cáncer.
Sector de la técnica
La presente invención se enmarca en el campo de la química médica, y más concretamente en el de compuestos inhibidores de enzimas para uso terapéutico aplicables en particular como adyuvantes del tratamiento del cáncer por quimioterapia, al disminuir los efectos negativos de dicha terapia.
Estado de la técnica
El tratamiento de la mayor parte de los tumores se basa en una aproximación múltiple que incluye la resección quirúrgica y la radioterapia, dirigidas al tumor principal, y la quimioterapia, que actúa en todo el organismo para prevenir y combatir la aparición de tumores en otras localizaciones (metástasis). Los principales compuestos usados en quimioterapia son los agentes alquilantes (ciclofosfamida, mecloretamina), antimetabolitos (6-mercaptopurina, 5-fluoruracilo), alcaloides derivados de plantas (vinblastina, vincristina), y diversas moléculas biológicas (antibióticos antitumorales, enzimas, hormonas, etc.).
Las nitrosoureas y los compuestos relacionados (procarbazina, estreptozina, temozolomida) son similares a los agentes alquilantes y su efectividad terapéutica se atribuye, en buena parte, al potencial citotóxico de las lesiones que inducen en el ADN [1]. Los tejidos tumorales, dada la mayor tasa de proliferación de sus células, sintetizan más ADN, por lo que son los más afectados por estas lesiones. En particular dichos compuestos provocan metilaciones del oxigeno en posición 6 de las moléculas de guanina del ADN, originando O6-metilguanina (O6-mG). La metilación de la guanina en esta posición provoca que se aparee con una timina (T) en vez de con una citosina (C), y también puede provocar entrecruzamientos G-C por lo que la replicación de la cadena con O6-mG origina alteraciones en la nueva cadena de ADN que finalmente producen la inhibición tanto de la replicación como de la transcripción del ADN, conduciendo en ambos casos a muerte celular por apoptosis [1].
Sin embargo las células presentan mecanismos para reparar las lesiones de su ADN producidas en condiciones fisiológicas normales, ya sea por factores medioambientales o por metabolitos generados internamente. En particular la resistencia a los compuestos alquilantes de O6 está mediada por la enzima O6-alquilguanina-ADN-alquiltransferasa (la enzima en humanos es conocida como hAGT, del inglés "human O6-alkylguanine-DNA alkyltransferase"), que transfiere el grupo metilo de la O6-mG a un aminoácido de su centro activo (un cisteína en posición 145), restaurando así la guanina original [1, 2]. La síntesis de la hAGT se encuentra aumentada en la mayoría de las células tumorales, por lo que a menudo los tumores son resistentes a la quimioterapia con agentes alquilantes [3, 4]. Así por ejemplo, la acción de la hAGT es la causa principal de la resistencia a quimioterapia en el glioblastoma, un tipo de tumor maligno que constituye aproximadamente el 50% de los tumores cerebrales.
Se ha estudiado por tanto el uso de inhibidores de la hAGT como coadyuvantes para los tratamientos de quimioterapia, ya que al potenciarse el efecto de los agentes alquilantes podría reducirse su dosis terapéutica, lo que a su vez supondría una disminución de sus efectos secundarios. La O6-benzilguanina (O6-bG) y sus análogos inactivan hAGT in vitro e in vivo [2], pero aunque se ha demostrado en ensayos clínicos que la O6-BG mejora la eficacia de agentes quimio-terapéuticos [5], existen limitaciones considerables para su uso terapéutico: su toxicidad sobre la mielina de las células nerviosas, su escasa solubilidad en agua y su rápida degradación en el plasma celular [6]. Además, la hAGT tiene más afinidad por la O6-mG que por la O6-bG, por lo que se une preferentemente al ADN que presente O6-mG, de modo que su actividad reparadora está más favorecida que la inhibición por O6-bG.
Algunos estudios recientes han mostrado que los oligodesoxirribonucleótidos que contienen O6-bG inactivan más eficazmente a la hAGT [7]. En concreto, se ha demostrado el potencial inhibidor in vitro de moléculas de 11 desoxirribonucleótidos que contienen O6-bG modificadas con enlaces metilfosfonato terminales para protegerlas de la degradación por nucleasas. Sin embargo, en modelos celulares el potencial inhibidor de la hAGT por estas cadenas de desoxirribonucleótidos se redujo en una escala de unas 1000 veces en comparación a lo observado in vitro, sugiriendo que la incorporación de estas moléculas por las células es un factor limitante de su acción terapéutica.
Así pues, los inhibidores de la función reparadora de ADN de la hAGT descritos hasta ahora no son suficientemente efectivos. Los autores de la presente invención aplicaron por tanto la metodología del diseño de fármacos basado en la estructura tridimensional de las dianas terapéuticas para solventar este problema técnico. Para ello analizaron la estructura de la hAGT [8] y se fundamentaron en la hipótesis de que la unión del ADN no comporta un cambio conformacional significativo en esta enzima, al igual que se ha encontrado para la proteína Ada (que también repara alquilaciones del ADN). Esta hipótesis encaja asimismo con el mecanismo de inversión de la base alquilada que se plantea para este tipo de enzimas [9].
La aplicación de esta metodología, en el punto de confluencia entre la Química, la Biología y la Bioinformática ha permitido identificar dos familias de compuestos con gran afinidad por el centro activo de la proteína hAGT y que poseen la capacidad de inhibir su actividad biológica de forma relevante.
Descripción detallada de la invención
La presente invención se relaciona con el uso de derivados de piperadinil-metil-tetrazol-quinolinona como inhibidores de la acción reparadora del ADN realizada por la enzima O6-alquilguanina-ADN-alquiltransferasa y con composiciones farmacéuticas que los contienen, para la preparación de medicamentos coadyuvantes de la terapia antitumoral basada en agentes alquilantes.
El procedimiento para identificar familias de dichos compuestos se inició con el cribado virtual de la base de datos de compuestos químicos (quimioteca) ZINC [10], que contiene más de dos millones de compuestos. En dicho cribado se buscaron candidatos a interaccionar con el centro activo de la hAGT, particularmente compuestos que encajaran en el surco hidrofóbico que presenta la superficie de dicho centro activo y que está definido por los aminoácidos Metionina 134, Prolina 140 y el "lazo" del centro activo (comprendido entre los aminoácidos Valina 155 y Glicina 160, inclusive). La interacción o encaje molecular ("docking") de los compuestos de la quimioteca en dicho surco se analizó virtualmente según el proceso esquematizado en la Figura 1.
La estructura inicial de la hAGT se obtuvo de la base de datos PDB (RCSB Protein Data Bank, disponible en www.rcsb.org/pdb/ [11]). De dicha base se tomó un modelo de la proteína, del que se descartaron las moléculas de agua y ADN que aparecían interaccionando con la misma. A este modelo se le añadieron los átomos de hidrógeno con el programa protonate del paquete AMBER [12], y se le asignaron cargas y radios atómicos a todos los átomos de la proteína utilizando el mismo paquete. A continuación, se caracterizó energéticamente el centro activo mediante la combinación de tres programas propios desarrollados por los inventores:
CGRID [13], genera una malla tridimensional sobre el centro activo de la proteína y permite calcular tanto las interacciones electrostáticas como las de tipo van der Waals entre cada uno de los átomos de centro activo de la proteína con cada uno de los átomos principales (carbono, nitrógeno, oxígeno, azufre, hidrógeno, fósforo, flúor, cloro, bromo, yodo) de las moléculas de la quimioteca utilizada. Los bordes de la malla tridimensional para la hAGT se situaron a un mínimo de distancia de 5 Å de cualquier átomo del nucleótido metilado (tal como la O6-mG) sobre el que actuará el centro activo de la enzima, y el espaciado entre cada punto de la malla fue de 0.5 Å.
CDOCK [13], un programa de análisis del encaje molecular o docking cuya función de asignación de valores se basa en las mallas calculadas con CGRID. Se utilizaron 3 sondas (moléculas prototipo): benceno para detectar zonas hidrofóbicas,...
Reivindicaciones:
1. Uso de un compuesto derivado de piperadinil-metil-tetrazol-quinolinona, de fórmula I
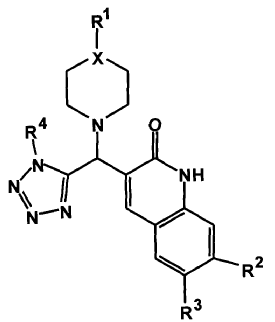
en la que:
- X es un átomo de carbono (C) o nitrógeno (N), indistintamente;
- R1, R2, R3 y R4 son iguales o diferentes y están independientemente seleccionados del grupo constituido por: hidrógeno, alquilo lineal, alquilo ramificado, cicloalquilmetil, cicloalquiletil, aminocarbonilalquil, alquiloxi lineal, alquiloxi ramificado, furilmetil, imidazolilmetil, imidazoliletil, imidazolilpropil, R7, metil-R7, etil-R7, propil-R7, metoxi-R7, etoxi-R7, propoxi-R7, donde R7 es un arilo en el que cada una de sus cinco posiciones restantes está sustituida por un grupo independientemente seleccionado entre hidrógeno, fluor, cloro, bromo, trifluorometilo, hidroxi, alcoxi (alquilóxido de 1 a 4 átomos de C), alquilcarbonil, alquilamino, y sulfonilamino;
o bien un isómero, profármaco, solvato o sal farmacéuticamente aceptables de dicho compuesto, en la elaboración de una composición farmacéutica o medicamento destinado al tratamiento del cáncer.
2. Uso de un compuesto según la reivindicación 1 donde
- X es nitrógeno,
- R1 es 2,5-dimetilfenil,
- R2 es hidrógeno,
- R3 es metoxi,
- R4 es fenil-metil,
compuesto denominado 3-[[4-(2,5-dimetilfenil)-1-piperazinil][1-(fenilmetil)-1H-tetrazol-5-il]metil]-6-metoxi-2 (1H)-quinolinona.
3. Uso de un compuesto según la reivindicación 1 donde
- X es carbono,
- R1 es fenil-metil,
- R2 es metil,
- R3 es hidrógeno,
- R4 es fenil-metil,
compuesto denominado 3-[(4-bencil-1-piperadinil)-(1-bencil-1H-5-tetrazolil)]metil-7-metil-2(1H)quinolinona.
4. Uso de un compuesto según cualquiera de las reivindicaciones 1 a 3, caracterizado porque la composición farmacéutica o medicamento está destinado al tratamiento de un cáncer seleccionado del grupo que comprende: carcinoma de próstata, mama, pulmón, páncreas, esófago, laringe, tiroides, hígado, vejiga urinaria, riñón, útero, cerviz, carcinoma cólorrectal, gástrico, osteosarcoma, sarcoma de partes blandas y angiosarcoma; tumor hematopoyético (incluyendo leucemias y linfomas), neuroblastomas, glioblastomas y astrocitomas, melanoma, carcinoma dérmico de células basales y carcinoma dérmico de células escamosas.
5. Composiciones farmacéuticas y medicamentos útiles para el tratamiento del cáncer por sí solos o en combinación con otras composiciones farmacéuticas o medicamentos, caracterizados porque comprenden al menos:
- un compuesto de fórmula I, o
- un isómero, profármaco, solvato o sal farmacéuticamente aceptables de uno de dichos compuestos.
6. Composiciones farmacéuticas y medicamentos según la reivindicación 8 en la que el compuesto de fórmula I es:
3-[[4-(2,5-dimetilfenil)-1-piperazinil][1-(fenilmetil)-1H-tetrazol-5-il]metil]-6-metoxi-2(1H)-quinolinona, o
3-[(4-bencil-1-piperadinil)-(1-bencil-1H-5-tetrazolil)]metil-7-metil-2(1H)quinolinona.
Patentes similares o relacionadas:
Ureas asimétricas p-sustituidas y usos médicos de las mismas, del 22 de Julio de 2020, de Helsinn Healthcare SA: Un compuesto de Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: una línea discontinua indica un enlace opcional; X es CH; […]
Procedimiento de compuestos antifúngicos, del 22 de Julio de 2020, de NQP 1598, Ltd: Procedimiento para preparar un compuesto de fórmula 5 ó 5*, o una mezcla de los mismos: **(Ver fórmula)** comprendiendo el método: (a) hacer reaccionar un compuesto […]
Derivados de tetrahidroisoquinolina, del 8 de Julio de 2020, de UCB Biopharma SRL: Un compuesto de fórmula (I), o una sal farmacéuticamente aceptable del mismo, **(Ver fórmula)** donde R1, R2 y R3 representan independientemente hidrógeno, halógeno […]
Análogos de indolina y usos de los mismos, del 8 de Julio de 2020, de Oncternal Therapeutics, Inc: Un compuesto que tiene la fórmula (I): **(Ver fórmula)** o un estereoisómero, una sal farmacéuticamente aceptable, o solvato del mismo, donde A se […]
Forma sólida aislada de monohidrocloruro de anamorelina con baja proporción molar de cloruro:anamorelina, del 1 de Julio de 2020, de Helsinn Healthcare SA: Una forma sólida aislada de monohidrocloruro de anamorelina (también denominado 'monoclorhidrato de anamorelina'), de manera que el mencionado monohidrocloruro […]
Derivado de amina cíclica y uso farmacéutico del mismo, del 1 de Julio de 2020, de TORAY INDUSTRIES, INC.: Un derivado de amina cíclica representado por la siguiente fórmula general (I): **(Ver fórmula)** donde R1 representa un grupo alquiloxi que tiene de 1 a 3 átomos […]
Derivados de tetrahidroisoquinolina, del 1 de Julio de 2020, de UCB Biopharma SRL: Un compuesto representado por la fórmula (I-A), o una sal farmacéuticamente aceptable de este, **(Ver fórmula)** En donde R1 es hidrógeno, halógeno, ciano o hidroxi; […]
Lactamas fusionadas con arilo y heteroarilo, del 24 de Junio de 2020, de PFIZER INC.: Un compuesto de fórmula (II-A): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: R1 es alquilo C1-C8, alcoxi C1-C8, halo, […]