INHIBIDORES DE ANGIOGENESIS MULTIFUNCIONALES Y MULTIVALENTES.
Una proteína oligomérica que comprende 2, 3, ó 4 proteínas de fusión,
en la que cada proteína de fusión comprende:
c) un polipéptido (A'') que comprende una región que reconoce y bloquea una región funcionalmente activa de una molécula implicada en el proceso de angiogénesis, siendo dicho polipéptido un anticuerpo que reconoce y bloquea una región funcionalmente activa de una molécula implicada en el proceso de angiogénesis o un fragmento recombinante del mismo que reconoce y bloquea una región funcionalmente activa de una molécula implicada en el proceso de angiogénesis; y
d) un polipéptido (B'') que comprende (i) un dominio de oligomerización, (ii) un péptido o proteína inhibi- dor(a) o modulador(a) del proceso de angiogénesis, y (iii) una región sensible a proteinasas entre dicho dominio de oligomerización y dicho péptido o proteína inhibidor(a) o modulador(a) del proceso de angiogénesis
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2005/011714.
Solicitante: UNIVERSIDAD AUTONOMA DE MADRID.
Nacionalidad solicitante: España.
Inventor/es: ALVAREZ VALLINA,LUIS, SANZ ALCOBER,LAURA, SANCHEZ-AREVALO LOBO,VICTOR JAVIER, CUESTA MARTINEZ,ANGEL, VARGAS NUUEZ,JUAN, COMPTE GRAU,MARTA.
Fecha de Publicación: .
Fecha Concesión Europea: 6 de Enero de 2010.
Clasificación Internacional de Patentes:
- C07K14/515 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Factor angiogénico; Angiogenina.
- C07K16/18 C07K […] › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › contra materiales animales o humanos.
Clasificación PCT:
- C12N15/62 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Secuencias de ADN que codifican proteínas de fusión.
Fragmento de la descripción:
Inhibidores de angiogénesis multifuncionales y multivalentes.
Campo de la invención
La invención se relaciona con proteínas de fusión útiles como inhibidores de angiogénesis multifuncionales y multivalentes que comprenden un polipéptido que reconoce y bloquea una región funcionalmente activa de una molécula implicada en el proceso de angiogénesis y un polipéptido que comprende un dominio de oligomerización y una región funcionalmente activa, inhibidora o moduladora del proceso de angiogénesis, separados por una región sensible a proteinasas. La invención también se refiere a las construcciones génicas y vectores útiles para la producción de dichas proteínas de fusión.
Antecedentes de la invención
La angiogénesis es el proceso biológico que conduce a la formación de nuevos vasos sanguíneos a partir de los preexistentes en un órgano o tejido. La angiogénesis comienza con la descomposición de la membrana basal debido a la acción de las proteinasas secretadas por las células endoteliales, continúa con la migración y proliferación de dichas células endoteliales, para finalizar con la formación del lumen, la membrana basal y el envolvimiento con células periféricas.
En condiciones fisiológicas normales en un adulto sano, no hay angiogénesis con la excepción de los fenómenos asociados con el ciclo menstrual femenino y la cicatrización de heridas. Sin embargo, un desequilibrio en el proceso de la angiogénesis contribuye al desarrollo de desórdenes patológicos, tales como la artritis reumática, retinopatía diabética, psoriasis, bartonelosis, rechazo de órganos trasplantados, hemorragias y neovascularización ocular (uno de los casos más frecuentes de ceguera), la retinopatía diabética, la retinopatía del prematuro, la degeneración macular, el glaucoma neovascular, la oclusión de las venas de la retina, la oclusión arterial de la retina, el pterigium, la rubeosis, la neovasculatura corneal, los tumores sólidos, la hemangioma y la proliferación y metástasis de los tumores, entre otros.
La angiogénesis juega, además, un papel importante en el crecimiento progresivo y dispersión metastásica de los tumores. Un tumor tiene que estimular continuamente el desarrollo de nuevos capilares para poder crecer. Los nuevos vasos generados en el tumor proporcionan a las células malignas una vía por donde pueden entrar en la circulación y establecer metástasis en lugares distantes. Si esta actividad angiogénica pudiera reprimirse o eliminarse, entonces el tumor, aunque presente, no podría desarrollarse.
Por este motivo, diversos grupos de investigadores están trabajando en la búsqueda de compuestos que ejerzan una acción inhibitoria de la angiogénesis (inhibidores de la angiogénesis o agentes antiangiogénicos) útiles como agentes terapéuticos para el tratamiento o prevención de patologías que cursan con el desarrollo de angiogénesis.
En relación con los tumores, se acepta que los tumores no pueden crecer o metastatizar a otro órgano sin la génesis de nuevos vasos sanguíneos, constituyendo el cambio ("switch") angiogénico un acontecimiento temprano en la progresión tumoral. Se han descrito diversas estrategias anti-angiogénicas que interfieren en diferentes niveles de la vía angiogénica: bloqueando la actividad del factor de crecimiento; inhibiendo las proteinasas de la matriz extracelular (MEC); dirigiéndose directamente a las células endoteliales (CE); regulando por exceso los inhibidores endógenos, etc. Los inhibidores endógenos de la angiogénesis han recibido una especial atención en la terapia del cáncer, dado que parece que son agentes no tóxicos y no inmunogénicos. Se han identificado, al menos, 10 inhibidores angiogénicos endógenos [O'Reilly, M.S. et al., Cell, 88: 277-285, 1997], de los cuales, los que mejor se conocen son la angiostatina y la endostatina.
Las endostatinas (ES) son inhibidores de la migración de células endoteliales y de la angiogénesis y se ha demostrado que reducen el crecimiento tumoral en modelos animales. Los mecanismos implicados en dichos efectos no están claro, aunque se ha propuesto que está implicada la unión a los receptores de la superficie celular (integrinas y heparán sulfatos, VEGFR-2), las metaloproteinasas y los componentes de la MEC. Las ES derivan del dominio NC1 de los colágenos XV y XVIII, de donde se liberan proteolíticamente en forma trimérica y además se convierten en endostatinas monoméricas de aproximadamente 20 kDa. En el extremo N-terminal de NC1, hay un dominio de trimerización de aproximadamente 60 residuos conectado con el módulo de ES de 180 residuos aproximadamente mediante una región bisagra flexible que contiene diversos sitios sensibles a proteinasa que liberan endostatina después de la escisión proteolítica.
Boehm et al. [Nature, 390:404 (1997)] describen el empleo, como modelo experimental, de ratones a los que se les habían implantado diversos tumores (carcinoma pulmonar de Lewis, fibrosarcoma y melanoma). En los ratones no tratados con ES, dichos tumores crecieron rápidamente, provocando la muerte del animal. En cambio, los ratones tratados con ES después del desarrollo de tumores, se observó una reducción del volumen tumoral hasta alcanzar un tamaño casi microscópico. El tratamiento cíclico con ES de ratones portadores de tumor produjo una regresión completa de los tumores en modelos animales. Sin embargo, ensayos clínicos que se están llevando a cabo con ES no han reportado una inhibición significativa del crecimiento tumoral y raras veces se ha observado regresión tumoral. Desgraciadamente, este no es un ejemplo aislado y otros ensayos clínicos que incluyen diferentes moléculas anti-angiogénicas también son decepcionantes, a pesar de lo notables que fueron los efectos antitumorales en los modelos animales. En este contexto, parece lógico combinar varios inhibidores de la angiogénesis para el tratamiento de cánceres humanos. Alternativamente, la actividad biológica potenciada (ES + angiostatina) y la acción dirigida hacia el tumor [ES + RGD (arginina-glicina-ácido aspártico)] pueden mejorar potencialmente la inhibición del crecimiento tumoral.
Por otra parte, se ha demostrado el potencial terapéutico de un fragmento Fv de cadena única (scFv) de un anticuerpo anti-laminina (L36) con actividad anti-angiogénica tanto in vivo como in vitro. Los resultados pusieron de manifiesto que la alteración del potencial morfogenético de las matrices asociadas a las células es una forma eficaz de impedir in vivo la formación de vasos sanguíneos asociada al tumor.
A pesar de los esfuerzos realizados hasta la fecha, sigue existiendo la necesidad de desarrollar compuestos inhibidores de la angiogénesis útiles como agentes terapéuticos para el tratamiento o prevención de patologías que cursan con el desarrollo de angiogénesis.
Compendio de la invención
La invención se enfrenta con el problema de proporcionar compuestos con actividad antiangiogénica potencialmente útiles como agentes terapéuticos para la prevención y/o el tratamiento de patologías que cursan con angiogénesis, por ejemplo, psoriasis, artritis reumática, retinopatías, cáncer, etc.
La solución proporcionada por esta invención se basa en unas proteínas de fusión, potencialmente útiles como inhibidores de angiogénesis multifuncionales y multivalentes, que comprenden un (a) polipéptido que comprende una región que reconoce y bloquea una región funcionalmente activa de una molécula implicada en el proceso de angiogénesis y (b) un polipéptido que comprende un dominio de oligomerización y una región funcionalmente activa, inhibidora o moduladora del proceso de angiogénesis, separados por una región sensible a proteinasas.
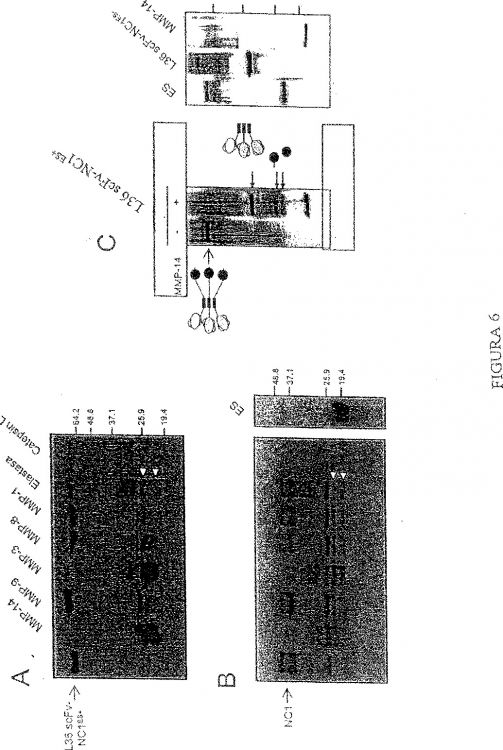
La invención se ilustra mediante la construcción de varias quimeras proteicas. Una de las proteínas de fusión (véase el Ejemplo) comprende el fragmento Fv de cadena única del anticuerpo (scFv) monoclonal L36 anti-laminina y el dominio NC1 de colágeno XVIII que comprende un dominio de trimerización y un dominio de endostatina (ES) unidos por un péptido bisagra que contiene sitios sensibles a proteinasas que liberan ES monomérica tras la escisión proteolítica. Los niveles de proteinasas están aumentados en el microentorno tumoral, por lo que dicha proteína de fusión libera in situ tanto monómeros de ES como trímeros de scFv. Dicha proteína de fusión fue secretada por las células humanas genéticamente modificadas en una forma funcionalmente activa. La forma intacta tiene una masa molecular de 210 kDa aproximadamente, lo que indica...
Reivindicaciones:
1. Una proteína oligomérica que comprende 2, 3, ó 4 proteínas de fusión, en la que cada proteína de fusión comprende:
2. Proteína oligomérica según la reivindicación 1, en la que dicha molécula implicada en el proceso de angiogénesis es una proteína de la matriz extracelular (MEC), un factor angiogénico o un receptor de membrana celular.
3. Proteína oligomérica según la reivindicación 2, en la que dicha molécula implicada en el proceso de angiogénesis es colágeno, un proteoglicano, fibronectina, laminina, tenascina, entactina, trombospondina, factor de crecimiento endotelial vascular (VEGF), receptor 2 de VEFG (VEFGR-2) o una integrina.
4. Proteína oligomérica según la reivindicación 3, en la que dicha laminina es una laminina de mamífero, preferentemente de rata, ratón o ser humano.
5. Proteína oligomérica según cualquiera de las reivindicaciones 1 a 4, en la que dicho polipéptido (A') es un fragmento Fv de cadena única (scFv) de un anticuerpo que reconoce una molécula implicada en el proceso de angiogénesis o un diabody que reconoce dicha molécula implicada en el proceso de angiogénesis.
6. Proteína oligomérica según la reivindicación 1, en la que dicho polipéptido (B') comprende el dominio NC1 de colágeno XV de mamífero o el dominio NC1 de colágeno XVIII de mamífero.
7. Proteína oligomérica según la reivindicación 1, que comprende, entre dichos polipéptidos (A') y (B'), un tercer polipéptido (C') que comprende la secuencia de aminoácidos de un péptido de unión flexible.
8. Proteína oligomérica según la reivindicación 1, siendo dicha proteína oligomérica un trímero constituido por 3 proteínas de fusión, en la que cada proteína de fusión comprende:
9. Una composición farmacéutica que comprende una proteína oligomérica según cualquiera de las reivindicaciones 1 a 8 junto con, al menos, un excipiente farmacéuticamente aceptable.
10. Empleo de una proteína oligomérica según cualquiera de las reivindicaciones 1 a 8, en la elaboración de una composición farmacéutica para prevenir, tratar, impedir o minimizar el desarrollo de angiogénesis.
11. Empleo de una proteína oligomérica según cualquiera de las reivindicaciones 1 a 8, en la elaboración de una composición farmacéutica para el tratamiento o la prevención de patologías que cursan con angiogénesis.
12. Empleo según la reivindicación 11, en la que dicha patología que cursa con angiogénesis comprende cáncer, hemangioma, artritis reumática, psoriasis, bartonelosis, rechazo de órganos trasplantados, hemorragias, neovascularización ocular, retinopatías, degeneración macular, glaucoma neovascular, oclusión de las venas de la retina, oclusión arterial de la retina, pterigium, rubeosis, o neovascularización corneal.
13. Un cassette de expresión que comprende, operativamente unido a una secuencia de control de expresión, una construcción génica que comprende, operativamente unidas, al menos:
en donde el extremo 3' de dicha primera secuencia de ácido nucleico (A) está unido al extremo 5' de dicha segunda secuencia de ácido nucleico (B).
14. Cassette de expresión según la reivindicación 13, en el que dicha molécula implicada en el proceso de angiogénesis es una proteína de la matriz extracelular (MEC), un factor angiogénico o un receptor de membrana celular.
15. Cassette de expresión según la reivindicación 14, en el que dicha molécula implicada en el proceso de angiogénesis es colágeno, un proteoglicano, fibronectina, laminina, tenascina, entactina, trombospondina, factor de crecimiento endotelial vascular (VEGF, receptor 2 de VEFG (VEFGR-2), una integrina.
16. Cassette de expresión según la reivindicación 15, en el que dicha laminina es una laminina de mamífero, preferentemente de rata, ratón o ser humano.
17. Cassette de expresión según la reivindicación 13, en el que dicha primera secuencia de ácido nucleico (A) comprende la secuencia de nucleótidos que codifica un fragmento Fv de cadena única (scFv) de un anticuerpo que reconoce dicha molécula implicada en el proceso de angiogénesis o un diabody que reconoce dicha molécula implicada en el proceso de angiogénesis.
18. Cassette de expresión según la reivindicación 13, en el que dicha segunda secuencia de ácido nucleico (B) comprende la secuencia de nucleótidos que codifica el dominio NC1 de colágeno XV de mamífero o la secuencia de nucleótidos que codifica el dominio NC1 de colágeno XVIII de mamífero, que contiene la secuencia de nucleótidos correspondiente a los dominios de trimerización y endostatina (ES) de dichos dominios NC1, y la secuencia de nucleótidos que codifica los péptidos bisagra de dichos dominios NC1.
19. Cassette de expresión según la reivindicación 13, que comprende, además de dichas secuencias de ácido nucleico (A) y (B), una tercera secuencia de ácido nucleico (C) que contiene la secuencia de nucleótidos que codifica un péptido de unión flexible, en donde el extremo 5' de dicha tercera secuencia de ácido nucleico (C) está unido al extremo 3' de dicha primera secuencia de ácido nucleico (A).
20. Cassette de expresión según la reivindicación 13, en la que dicha primera secuencia de ácido nucleico (A) comprende la secuencia de nucleótidos que codifica un fragmento Fv de cadena única (scFv) de un anticuerpo que reconoce una laminina y dicha segunda secuencia de ácido nucleico (B) comprende la secuencia de nucleótidos que codifica el dominio NC1 de colágeno XVIII de mamífero, que contiene la secuencia de nucleótidos correspondiente al dominio de trimerización y endostatina (ES) de dicho dominio NC1.
21. Un vector recombinante que comprende un cassette de expresión según cualquiera de las reivindicaciones 13 a 20.
22. Una célula hospedadora que comprende un cassette de expresión según cualquiera de las reivindicaciones 13 a 20, o un vector recombinante según la reivindicación 21.
23. Una proteína oligomérica obtenida por expresión de la secuencia de ácido nucleico contenida en un cassette de expresión según cualquiera de las reivindicaciones 13 a 20.
24. Un procedimiento para obtener una proteína oligomérica según cualquiera de las reivindicaciones 1 a 8, que comprende crecer una célula según la reivindicación 22 bajo condiciones que permiten la producción de dicha proteína oligomérica y, si se desea, aislar y purificar dicha proteína oligomérica.
25. Una composición farmacéutica que comprende un vector que comprende un cassette de expresión según cualquiera de las reivindicaciones 13 a 20, junto con, al menos, un excipiente farmacéuticamente aceptable.
26. Empleo de un cassette de expresión según cualquiera de las reivindicaciones 13 a 20, o de un vector según la reivindicación 21, en la elaboración de una composición farmacéutica para prevenir, tratar, impedir o minimizar el desarrollo de angiogénesis.
27. Empleo de un cassette de expresión según cualquiera de las reivindicaciones 13 a 20, o de un vector según la reivindicación 21, en la elaboración de una composición farmacéutica para el tratamiento o la prevención de patologías que cursan con angiogénesis.
28. Empleo según la reivindicación 27, en el que dicha patología que cursa con angiogénesis comprende cáncer, hemangioma, artritis reumática, psoriasis, bartonelosis, rechazo de órganos trasplantados, hemorragias, neovascularización ocular, retinopatías, degeneración macular, glaucoma neovascular, oclusión de las venas de la retina, oclusión arterial de la retina, pterigium, rubeosis, o neovascularización corneal.
Patentes similares o relacionadas:
Proteínas de fusión citolíticas humanas, del 7 de Agosto de 2019, de UNIVERSITY OF CAPE TOWN: Una proteína de fusión citolítica humana (hCFP) recombinante adecuada para inducir apoptosis en células diana humanas que comprende un componente de unión específico […]
Anticuerpo monoclonal para antagonizar e inhibir la unión de factor de crecimiento celular endotelial vascular y su receptor, y secuencia de codificación y uso de este, del 9 de Enero de 2019, de Suzhou Stainwei Biotech Inc: Un anticuerpo monoclonal murino que inhibe de manera antagonista la unión del factor de crecimiento endotelial vascular al receptor de este, caracterizado […]
VNAR CON ACTIVIDAD ANTI-ANGIOGÉNICA EN TUMORES SÓLIDOS DE ANIMALES DE COMPAÑÍA, del 25 de Octubre de 2018, de CENTRO DE INVESTIGACIÓN CIENTÍFICA Y DE EDUCACIÓN SUPERIOR DE ENSENADA, BAJA CALIFORNIA: La presente invención se refiere a una novedosa proteína vNAR de SEQ ID No:1 capaz de inhibir la actividad del VEGF en mamíferos carnívoros de los […]
Proteína de unión a VEGF para el bloqueo de la angiogénesis, del 8 de Noviembre de 2017, de CHILDREN'S MEDICAL CENTER CORPORATION: Una proteína quimérica de unión a VEGF, que comprende una secuencia de aminoácidos de SEQ ID NO: 3.
Péptidos VEGF quiméricos, del 4 de Enero de 2017, de THE OHIO STATE UNIVERSITY RESEARCH FOUNDATION: Péptido quimérico que comprende: (a) al menos un epítopo de VEGF humano constituido por KCECRPKKDRARQENPCG; (b) un epítopo de células […]
Inhibición del PlGF para el tratamiento de la leucemia positiva para el cromosoma Filadelfia, del 22 de Junio de 2016, de VIB VZW: Un anticuerpo o un fragmento del mismo que se une específicamente al factor de crecimiento placentario, y la inhibición de la unión del factor de crecimiento placentario al […]
Péptidos VEGF quiméricos, del 29 de Abril de 2015, de THE OHIO STATE UNIVERSITY RESEARCH FOUNDATION: Péptido quimérico que comprende: a) al menos un epítopo de VEGF humano formado por la secuencia de aminoácidos ITMQIMRIKPHQGQHIGEMSF; b) un epítopo de […]
Polipéptido novedoso que tiene actividad de inducción de la angiogénesis y una actividad antibacteriana y uso del mismo para propósitos médicos, del 16 de Abril de 2014, de ANGES MG, INC.: Un polipéptido cuya secuencia de aminoácidos se muestra en cualquiera de SEQ ID NOs: 1 a 6.