INHIBICION DE LA ACTIVACION DEL COMPLEMENTO C5 PARA EL TRATAMIENTO Y LA PREVENCION DE RECHAZO DE XENOINJERTO RETRASADO O RECHAZO VASCULAR AGUDO.
El uso de un anticuerpo o su fragmento, que se une a C5 y que inhibe la activación de células endoteliales del tipo II,
para la fabricación de un medicamento para la prevención o el tratamiento del rechazo de xenoinjertos
Tipo: Resumen de patente/invención. Número de Solicitud: W0131103US.
Solicitante: TANOX, INC..
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 10301 STELLA LINK, SUITE 110,HOUSTON, TX 77025.
Inventor/es: SUN, BILL, N., C., FUNG,MICHAEL,S.,C.
Fecha de Publicación: .
Fecha Concesión Europea: 25 de Noviembre de 2009.
Clasificación Internacional de Patentes:
- C07K16/18 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › contra materiales animales o humanos.
Clasificación PCT:
- A61K39/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53).
- A61K39/395 A61K […] › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Anticuerpos (aglutininas A61K 38/36 ); Inmunoglobulinas; Inmunosuero, p. ej. suero antilinfocitario.
- C07H21/04 C07 […] › C07H AZUCARES; SUS DERIVADOS; NUCLEOSIDOS; NUCLEOTIDOS; ACIDOS NUCLEICOS (derivados de ácidos aldónicos o sacáricos C07C, C07D; ácidos aldónicos, ácidos sacáricos C07C 59/105, C07C 59/285; cianohidrinas C07C 255/16; glicales C07D; compuestos de constitución indeterminada C07G; polisacáridos, sus derivados C08B; ADN o ARN concerniente a la ingeniería genética, vectores, p. ej. plásmidos o su aislamiento, preparación o purificación C12N 15/00; industria del azúcar C13). › C07H 21/00 Compuestos que contienen al menos dos unidades mononucleótido que tienen cada una grupos fosfato o polifosfato distintos unidos a los radicales sacárido de los grupos nucleósido, p. ej. ácidos nucleicos. › con desoxirribosilo como radical sacárido.
- C07K16/18 C07K 16/00 […] › contra materiales animales o humanos.
- C12N15/12 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Genes que codifican proteínas animales.
- C12N5/12 C12N […] › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › Células fusionadas, p. ej. hibridomas.
Clasificación antigua:
- A61K39/00 A61K […] › Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53).
- A61K39/395 A61K 39/00 […] › Anticuerpos (aglutininas A61K 38/36 ); Inmunoglobulinas; Inmunosuero, p. ej. suero antilinfocitario.
- C07H21/04 C07H 21/00 […] › con desoxirribosilo como radical sacárido.
- C07K16/18 C07K 16/00 […] › contra materiales animales o humanos.
- C12N15/12 C12N 15/00 […] › Genes que codifican proteínas animales.
- C12N5/12 C12N 5/00 […] › Células fusionadas, p. ej. hibridomas.
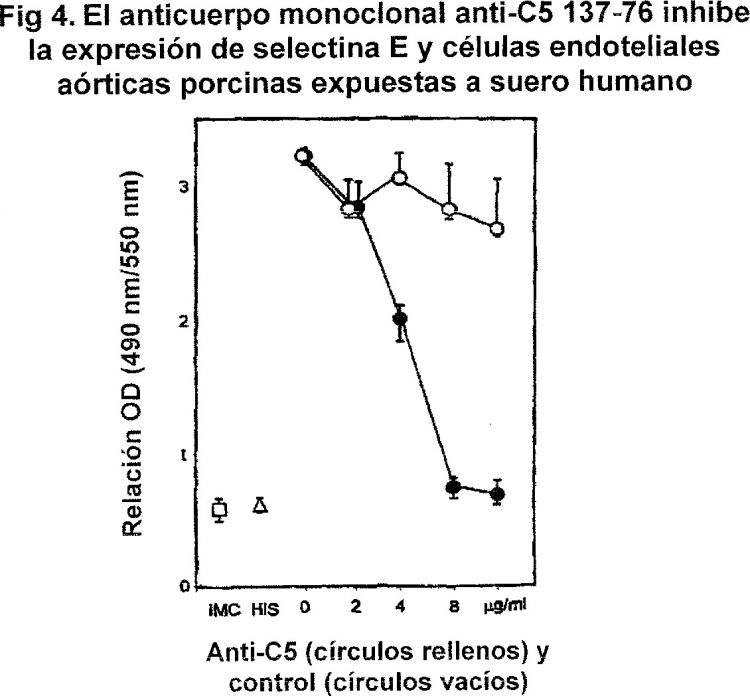
Fragmento de la descripción:
Inhibición de la activación del complemento C5 para el tratamiento y la prevención de rechazo de xenoinjerto retrasado o rechazo vascular agudo.
Antecedentes de la invención
La gran escasez de órganos de donantes ha provocado un interés mundial en la xenotransplantación, es decir, el reemplazo de órganos humanos o tejidos con los de un donante de una especie diferente, tales como cerdos. Los recientes progresos son causa de cierto optimismo, aunque todavía quedan obstáculos que deben ser superados.
Los xenotransplantes han sido clasificados en dos grupos, concordantes y discordantes, según la distancia filogenética entre las especies. Los animales que están evolutivamente cerca y no tienen anticuerpos naturales específicos entre sí son llamados concordantes. Los animales que son filogeneticámente distantes y rechazan órganos de una manera hiperaguda son llamados discordantes. Hay muchas gradaciones en medio y excepciones a la regla.
Los primates no humanos serían la fuente lógica de órganos para los seres humanos porque son los más estrechamente relacionados. Sin embargo, debido a consideraciones del tamaño de los órganos, carencia de disponibilidad y la probabilidad de transmisión de enfermedades infecciosas, la mayor parte de los investigadores han determinado que los primates no son la fuente preferida de órganos. En cambio, los cerdos son la opción más probable como fuente de órganos, debido a su fácil disponibilidad, semejanzas en el tamaño de los órganos, sus características de cría y la semejanza de los sistemas orgánicos respecto a los seres humanos. Sin embargo, los cerdos son una especie discordante respecto a los seres humanos.
Los xenoinjertos son objeto de cuatro mecanismos de rechazo: (1) rechazo hiperagudo mediado por anticuerpos preformados, (2) rechazo precoz o acelerado mediado por anticuerpos inducidos, (3) rechazo de xenoinjerto retrasado o rechazo vascular agudo (DXR/AVR) mediado por células T, y (4) rechazo crónico mediado por mecanismos de células T y células B. La inducción de los cuatro mecanismos puede ser atribuida a un mayor número de antígenos foráneos presentes que en el tejido del aloinjerto (uno de la misma especie, es decir, ser humano). Además, los receptores inhibitorios humanos a menudo no interactúan con otras moléculas MHC de clase I de la especie, permitiendo así la activación de varios mecanismos de rechazo que proceden sin inhibición.
Se ha descrito el trasplante de islotes pancreáticos porcinos y de un hígado de cerdo en pacientes humanos, (Makowka, et al., 1993; Satake, et al., 1993; Tibell, et al., 1993), pero los resultados no fueron positivos. Una mejor inhibición del rechazo de trasplantes con terapia farmacológica puede conducir a mejores resultados.
El rechazo hiperagudo (HAR) de xenoinjertos se inicia por la unión de anticuerpos xeno-reactivos a las células endoteliales del donante seguido de la activación del complemento, predominantemente mediante la ruta clásica. Los cerdos, por ejemplo, expresan un determinante de hidrato de carbono endotelial, gal a (1,3) gal, que no se expresa en seres humanos, y que es considerado un nuevo antígeno del grupo sanguíneo respecto al sistema inmunológico humano. La activación del complemento induce una activación del tipo I de las células endoteliales, un proceso que es rápido e independiente de la síntesis de proteínas. Se caracteriza por la retracción celular reversible, la translocación de selectina P a la superficie apical y la elaboración de diversas sustancias vasoactivas.
Además, se liberan proteoglicanos de sulfato de heparina desde la superficie de las células endoteliales dejando que la célula quede susceptible a daños procoagulantes y mediados por complemento. Las funciones críticas de las células endoteliales se pierden y el resultado final es una hemorragia intersticial, una trombosis difusa y daños del órgano irreversibles que aparecen en los pocos minutos o varias horas después del trasplante. Éstos son los rasgos característicos del HAR. El HAR puede prevenirse reduciendo la actividad del complemento o el nivel de los anticuerpos anti-xenoinjerto que aparecen de forma natural.
Incluso si se reduce o elimina el HAR, el xenoinjerto será rechazado después de unos días por el proceso denominado rechazo de xenoinjerto retrasado o rechazo vascular agudo (DXR/AVR). El DXR/AVR se caracteriza por una activación de las células endoteliales del tipo II, que depende de la síntesis de proteínas. Aunque se piense que DXR/AVR es, en gran parte, independiente del complemento, algunos estudios indican que el complemento todavía puede estar implicado en DXR/AVR. La inhibición del complemento por el receptor del complemento soluble tipo I (sCR1) combinado con la inmunodepresión retrasó la aparición de DXR/AVR de corazones porcinos trasplantados en monos cynomolgus (Davis, EA et al., Trasplantation 62: 1018-23 (1996)). El trasplante de riñones de cerdo que expresan el factor acelerador de la degradación humano respecto a monos cynomolgus también tuvo algún efecto protector contra DXR/AVR (Zaidi A et al. Trasplantation 65: 1584-90 (1998); Loss M et al., Xenotransplantation 7: 186-9 (2000)). La adición de anticuerpos anti-células endoteliales y complemento en dosis sublítica indujo la expresión del factor de tejido (Saadi S et al., J. Exp. Med. 182: 1807-14 (1995)). Las células endoteliales porcinas expuestas a suero humano expresaron el inhibidor del activador de plasminógeno (Kalady MF et al., Mol. Med. 4: 629-37 (1998)) y aumentaron la expresión de varios genes de quimioquina (Selvan RS et al., J. Immunol. 161: 4388-95 (1998)). Se encontró que el aumento de la expresión de varios genes de quimioquina dependía del complemento. Sin embargo, se demostró que un anticuerpo monoclónico anti-C5 era eficaz en la prevención del HAR, pero no del DXR/AVR (Wang, H. et al., Trasplantation 68: 1643-51 (1999)).
Se han descrito otros usos de anticuerpos y ligandos frente a C5 en Fitch et al., Circulation 100: 2499 (1999), que se refieren al uso de un anticuerpo de cadena sencilla específico para C5 humano como inhibidor de la activación del complemento patológica en pacientes que se someten a una derivación cardiopulmonar; documento de EE.UU. Nº 6.074.642, que se refiere al uso de anticuerpos específicos frente a C5 humano para el tratamiento de la glomerulonefritis; documento WO 99/41271, que se refiere a ligandos de ácidos nucleicos de afinidad alta con respecto a las proteínas del sistema del complemento C1q, C3 y C5; y Würzner, et al., 8: 328 (1991), que se refiere al uso de anticuerpos monoclónicos contra C5 o C6 para la inhibición de la formación del complejo del complemento terminal y la lisis de células.
La selectina E (también conocida como ELAM-1, CD62 y CD62E) es una molécula de adhesión celular glicoproteíca de la superficie celular inducible por citoquinas que se encuentra exclusivamente en las células endoteliales. La selectina E media la adhesión de varios leucocitos, incluyendo neutrófilos, monocitos, eosinófilos, linfocitos T citotóxicos, y un subconjunto de células T, frente al endotelio activado (Bevilacqua, et al., Science 243: 1160 (1989); Shimuzu, et al., Nature 349: 799 (1991); Graber, et al., J. Immunol. 145: 819 (1990); Carlos, et al., Blood 77: 2266 (1991); Hakkert, et al., Blood 78: 2721 (1991); y Picker, et al., Nature 349: 796 (1991)). La expresión de selectina E se induce en el endotelio humano en respuesta a las citoquinas IL-1 y TNF, así como lipopolisacáridos bacterianos (LPS), por la sobre-regulación transcripcional (Montgomery, et al., Proc Natl Acad Sci 88: 6523 (1991)).
Se ha identificado el receptor de leucocitos humano para la selectina E humana (Berg, et al., J. Biol. Chem. 23: 14869 (1991) y Tyrrell, et al., Proc Natl Acad Sci 88: 10372 (1991)). Estructuralmente, la selectina E pertenece a una familia de moléculas de adhesión llamadas "selectinas" que también incluyen a la selectina P y la selectina L (véanse las revisiones en Lasky, Science 258: 964 (1992) y Bevilacqua y Nelson, J. Clin. Invest. 91: 379 (1993)). Estas moléculas se caracterizan por propiedades estructurales comunes tales como un dominio tipo lectina del extremo amino-terminal, un dominio del factor de crecimiento...
Reivindicaciones:
1. El uso de un anticuerpo o su fragmento, que se une a C5 y que inhibe la activación de células endoteliales del tipo II, para la fabricación de un medicamento para la prevención o el tratamiento del rechazo de xenoinjertos.
2. El uso de la reivindicación 1, en el que el rechazo del xenoinjerto es un rechazo de xenoinjerto retrasado ("DXR") o un rechazo vascular agudo ("AVR").
3. El uso de la reivindicación 1 o la reivindicación 2, en el que la inhibición de la activación de células endoteliales del tipo II se manifiesta por la supresión de la expresión de selectina E.
4. El uso de cualquiera de las reivindicaciones 1 a 3, en el que el anticuerpo o el fragmento inhiben la lisis de células mediada por el complemento.
5. El uso de cualquiera de las reivindicaciones 1 a 4, en el que el anticuerpo o el fragmento inhiben la formación del complejo terminal del complemento ("TCC").
6. El uso de cualquiera de las reivindicaciones 1 a 5, en el que el anticuerpo o el fragmento inhiben la formación de C5a.
7. El uso de la reivindicación 1 o la reivindicación 2, en el que el anticuerpo o el fragmento se unen al mismo epítopo en C5 que: (i) el anticuerpo monoclónico MAb 137-76 que se obtiene del hibridoma que tiene el número de entrada de depósito de ATCC PTA-2581; o (ii) el anticuerpo monoclónico MAb 137-30 que se obtiene del hibridoma que tiene el número de entrada de depósito de ATCC PTA-2582.
8. El uso de la reivindicación 7, en el que el anticuerpo es un anticuerpo monoclónico MAb 137-76 que se obtiene del hibridoma que tiene el número de entrada de depósito de ATCC PTA-2581 o es el anticuerpo monoclónico MAb 137-30 que se obtiene del hibridoma que tiene el número de entrada de depósito de ATCC PTA-2582.
9. El uso de un anticuerpo de acuerdo con cualquiera de las reivindicaciones 1 a 7, en el que el anticuerpo es un anticuerpo monoclónico, un anticuerpo quimérico, un anticuerpo Delmmunized®, un anticuerpo humanizado o un anticuerpo humano.
10. El uso de un fragmento de anticuerpo de acuerdo con cualquiera de las reivindicaciones 1 a 7, en el que el fragmento de anticuerpo es un Fab, F(ab')2, Fv o fragmento de Fv de cadena sencilla.
11. El uso de la reivindicación 10, en el que el fragmento de anticuerpo es un fragmento quimérico, un fragmento Delmmunized®, un fragmento humanizado o un fragmento humano.
12. Un anticuerpo o su fragmento, que se une a C5 y que inhibe la activación de células endoteliales del tipo II, para uso en la prevención o el tratamiento del rechazo de xenoinjertos.
13. El anticuerpo o el fragmento de la reivindicación 12, en el que el rechazo de xenoinjertos es un rechazo de xenoinjerto retrasado ("DXR") o un rechazo vascular agudo ("AVR").
14. El anticuerpo o el fragmento de la reivindicación 12 o la reivindicación 13, en el que la inhibición de la activación de células endoteliales del tipo II se manifiesta por la supresión de la expresión de selectina E.
15. El anticuerpo o el fragmento de cualquiera de las reivindicaciones 12 a 14, en el que el anticuerpo o el fragmento inhiben la lisis de células mediada por el complemento.
16. El anticuerpo o el fragmento de cualquiera de las reivindicaciones 12 a 15, en el que el anticuerpo o el fragmento inhiben la formación del complejo terminal del complemento ("TCC").
17. El anticuerpo o el fragmento de cualquiera de las reivindicaciones 12 a 16, en el que el anticuerpo o el fragmento inhiben la formación de C5a.
18. El anticuerpo o el fragmento de la reivindicación 12 o la reivindicación 13, en el que el anticuerpo o el fragmento se unen al mismo epítopo en C5 que: (i) el anticuerpo monoclónico MAb 137-76 que se obtiene del hibridoma que tiene el número de entrada de depósito de ATCC PTA-2581; o (ii) el anticuerpo monoclónico MAb 137-30 que se obtiene del hibridoma que tiene el número de entrada de depósito de ATCC PTA-2582.
19. El anticuerpo o el fragmento de la reivindicación 18, en el que el anticuerpo es el anticuerpo monoclónico MAb 137-76 que se obtiene del hibridoma que tiene el número de entrada de depósito de ATCC PTA-2581 o es el anticuerpo monoclónico MAb 137-30 que se obtiene del hibridoma que tiene el número de entrada de depósito de ATCC PTA-2582.
20. El anticuerpo de cualquiera de las reivindicaciones 12 a 18, en el que el anticuerpo es un anticuerpo monoclónico, un anticuerpo quimérico, un anticuerpo Delmmunized®, un anticuerpo humanizado o un anticuerpo humano.
21. El fragmento de anticuerpo de cualquiera de las reivindicaciones 12 a 18, en el que el fragmento de anticuerpo es un Fab, F(ab')2, Fv, o un fragmento de Fv de cadena sencilla.
22. El fragmento del anticuerpo de la reivindicación 21, en el que el fragmento del anticuerpo es un fragmento quimérico, un fragmento Delmmunized®, un fragmento humanizado o un fragmento humano.
Patentes similares o relacionadas:
Anticuerpos anti-alfa-sinucleína y procedimientos de uso, del 29 de Julio de 2020, de F. HOFFMANN-LA ROCHE AG: Un anticuerpo anti-alfa-sinucleína humana que comprende (a) HVR-H1 que comprende la secuencia de aminoácidos de SEQ ID NO: 21; (b) HVR-H2 que […]
Terapia basada en anticuerpos de la amiloidosis por transtiretina (TTR) y anticuerpos de origen humano para ese propósito, del 22 de Julio de 2020, de Neurimmune Holding AG: Un anticuerpo anti-transtiretina (TTR) de origen humano o un fragmento de unión a antígeno del mismo, que es capaz de unirse a especies de TTR mutadas, mal plegadas, […]
PTPRS y proteoglicanos en enfermedad autoinmune, del 15 de Julio de 2020, de LA JOLLA INSTITUTE FOR ALLERGY AND IMMUNOLOGY: Una proteína recombinante no enzimática que comprende una secuencia de aminoácidos de un dominio extracelular de PTPRS, donde la proteína comprende tanto el dominio 1 (Ig1) […]
Polipéptidos biparatópicos antagonistas de la señalización WNT en células tumorales, del 15 de Julio de 2020, de Boehringer Ingelheim International GmbH & Co. KG: Un polipéptido que se une específicamente a LRP5 o LRP6, que comprende - un primer dominio variable individual de inmunoglobulina seleccionado del grupo de dominios […]
Redirectores de células T específicas de antígenos, del 1 de Julio de 2020, de THE JOHNS HOPKINS UNIVERSITY: Una nanoparticula que comprende en su superficie: (A) un anticuerpo que se une especificamente a un antigeno de celula diana o epitopo del mismo; y (B) un resto […]
Anticuerpos scFv que pasan las capas epitelial y/o endotelial, del 1 de Julio de 2020, de ESBATech, an Alcon Biomedical Research Unit LLC: Un anticuerpo monocatenario (scFv) que comprende: (a) un dominio variable de la cadena ligera (VL) que tiene tres regiones CDR de VL no […]
Formulación anti-IFNAR1 estable, del 24 de Junio de 2020, de ASTRAZENECA AB: Una formulacion de anticuerpo que comprende: a. De 100 mg/ml a 200 mg/ml de anifrolumab; b. Lisina HCl 40 mM a 60 mM; c. Trehalosa […]
Un antígeno asociado con artritis reumatoide, del 24 de Junio de 2020, de PHILOGEN S.P.A.: Un conjugado de anticuerpo para su uso en un procedimiento de tratamiento de la artritis reumatoide en un paciente, en el que el conjugado de anticuerpo comprende […]