GLICOFORMAS LIGADAS A O DE FACTOR VII Y METODO DE PRODUCCION DE LAS MISMAS.
Preparación de un polipéptido del factor VII conteniendo un motivo Cys-X1-Ser/Thr-X2-Pro-Cys y donde dicha serina/treonina forma parte de un enlace covalente Glc-O-Ser/Thr,
donde la preparación contiene un modelo de glicosilación ligado a serina/treonina que es uniforme al menos en un 80%
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2005/052024.
Solicitante: NOVO NORDISK HEALTH CARE AG.
Nacionalidad solicitante: Suiza.
Dirección: ANDREASSTRASSE 15,8050 ZURICH.
Inventor/es: KLAUSEN,NIELS KRISTIAN, RASMUSSEN,DANIEL.
Fecha de Publicación: .
Fecha Concesión Europea: 20 de Enero de 2010.
Clasificación Internacional de Patentes:
- C07K14/745 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Factores de coagulación sanguínea o de fibrinolisis.
Clasificación PCT:
- C07K14/745 C07K 14/00 […] › Factores de coagulación sanguínea o de fibrinolisis.
- C12N9/64 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 9/00 Enzimas, p. ej. ligasas (6.); Proenzimas; Composiciones que las contienen (preparaciones para la limpieza de los dientes que contienen enzimas A61K 8/66, A61Q 11/00; preparaciones de uso médico que contienen enzimas A61K 38/43; composiciones detergentes que contienen enzimas C11D ); Procesos para preparar, activar, inhibir, separar o purificar enzimas. › que provienen de tejido animal, p. ej. renina.
- C12P21/00 C12 […] › C12P PROCESOS DE FERMENTACION O PROCESOS QUE UTILIZAN ENZIMAS PARA LA SINTESIS DE UN COMPUESTO QUIMICO DADO O DE UNA COMPOSICION DADA, O PARA LA SEPARACION DE ISOMEROS OPTICOS A PARTIR DE UNA MEZCLA RACEMICA. › Preparación de péptidos o de proteínas (proteína monocelular C12N 1/00).
Clasificación antigua:
- C07K14/745 C07K 14/00 […] › Factores de coagulación sanguínea o de fibrinolisis.
- C12N9/64 C12N 9/00 […] › que provienen de tejido animal, p. ej. renina.
- C12P21/00 C12P […] › Preparación de péptidos o de proteínas (proteína monocelular C12N 1/00).
Fragmento de la descripción:
Glicoformas ligadas a O de factor VII y método de producción de la misma.
Campo de la invención
La presente invención se refiere a las composiciones que comprenden polipéptidos del factor VII que tienen patrones alterados de la glicosilación ligada a O.
Antecedentes de la invención
La actividad biológica de muchas glicoproteínas depende en gran medida de la presencia o ausencia de estructuras particulares de oligosacáridos fijadas a la glicoproteína. El modelo de glicosilación de una glicoproteína terapéutica puede afectar a numerosos aspectos de la eficacia terapéutica, tal como, p. ej, solubilidad, resistencia al ataque proteolítico, inactivación térmica, inmunogenicidad, vida media, bioactividad, biodisponibilidad, y estabilidad.
La glicosilación es una modificación compleja post-transicional que es dependiente de las células. Después de la traducción, las proteínas se transportan al retículo endoplásmico (ER), se glicosilan y se envían al Golgi para el procesamiento adicional y el objetivo posterior y/o la secreción. Durante la glicosilación, se forman bien las glicoproteínas ligadas a N o las ligadas a O.
Las proteínas del suero implicadas en la coagulación o la fibrinólisis, incluyendo, p. ej., el factor VII y el factor IX están demostrando ser útiles para los agentes terapéuticos para tratar una variedad de condiciones patológicas. Por consiguiente, existe una creciente necesidad de formulaciones que comprenden estas proteínas que son farmacéuticamente aceptables y muestran una eficacia clínica uniforme y predeterminada.
Debido a las muchas desventajas de utilizar plasma humano como una fuente de productos farmacéuticos, se prefiere producir estas proteínas en sistemas recombinantes. Las proteínas coagulantes, no obstante, están sujetas a una variedad de modificaciones co- y postraduccionales, incluyendo, p. ej., la glicosilación ligada a asparagina (ligada a N); la glicosilación ligada a serina o treonina (ligada a O); y la ?-carboxilación de residuos de glu. Estas modificaciones pueden ser cualitativamente o cuantitativamente diferentes cuando se utiliza células heterólogas como huéspedes para la producción a gran escala de proteínas. En particular, la producción en células heterólogas frecuentemente resulta en un conjunto diferente de glicoformas, cuyos polipéptidos idénticos tienen estructuras de oligosacáridos diferentes ligadas de manera covalente.
En diferentes sistemas, las variaciones en la estructura del oligosacárido de proteínas terapéuticas han estado ligadas a, entre otras cosas, cambios en la inmunogenicidad y en el espacio in vivo. Así, hay una necesidad en la técnica de composiciones y métodos que proporcionan preparaciones que comprenden el factor VII humano recombinante o el factor VII modificado o polipéptidos relacionados con el factor VII que contienen patrones de glicoformas predeterminados.
Resumen de la invención
La presente invención se refiere a preparaciones que comprenden polipéptidos del factor VII que exhiben patrones glicoformes predeterminados ligados a serina o a treonina. Las preparaciones son al menos aproximadamente el 80% homogéneas con respecto a los glicanos o cadenas de oligosacáridos adjuntos, preferiblemente al menos aproximadamente el 90%, al menos aproximadamente el 95%, o al menos aproximadamente el 98% homologas.
Como se utiliza en este caso, un modelo de glicoforma se refiere a la distribución dentro de la preparación de cadenas de oligosacáridos que tienen estructuras variables que están ligadas covalentemente a un residuo de serina o de treonina localizado en un dominio de tipo EGF en el esqueleto de adición de amino del polipéptido.
En un aspecto, la invención proporciona una preparación de un polipéptido del factor VII que contiene un motivo Cys-X1-Ser/Thr-X2-Pro-Cys y donde dicha serina/treonina forma parte de un enlace covalente Glc-O-Ser/Thr, dicha preparación conteniendo un modelo de glicosilación ligado a serina/treonina, que es al menos uniforme en un 80%.
En una forma de realización de la invención, el modelo de glicosilación es al menos uniforme en un 80%, preferiblemente al menos en un 85%, al menos en un 90%, al menos en un 95%, o al menos uniforme en un 98%.
En una forma de realización, los glicanos ligados a serina/treonina son Xyl-Xyl-Glc-; en otra, los glicanos son Xyl- Glc-; en aún otra, los glicanos son Glc-.
En una forma de realización preferida, la glicoproteína se selecciona del grupo de: factor VII humano, variantes de la secuencia del factor VII. En una forma de realización, la glicoproteína es una variante del factor VII donde la proporción entre la actividad de la variante del factor VII y la actividad del factor VIIa humano nativo (de tipo salvaje FVIIa) es al menos aproximadamente 1,25 cuando se prueba en el "ensayo de hidrólisis in vitro" como se describe en la presente descripción, preferiblemente al menos aproximadamente 2,0, o al menos aproximadamente 4,0.
En otro aspecto, la invención proporciona métodos para la fabricación de preparaciones de polipéptidos del factor VII que contienen motivos Cys-X1-Ser/Thr-X2-Pro-Cys y donde dicha serina/treonina forma parte de un enlace covalente Glc-O-Ser/Thr, dichas preparaciones conteniendo un modelo de glicosilación ligado a serina/treonina que es al menos uniforme en un 80%. Los métodos son útiles para remodelar o alterar el modelo de glicosilación presente en un polipéptido del factor VII en su expresión inicial.
Más particularmente, la presente invención proporciona una metodología enzimática general para la modificación de glicanos (en glicanos particulares ligados a O) de polipéptidos del factor VII, para mejorar o realzar sus propiedades farmacéuticas. Un método implica el tratamiento del polipéptido del factor VII con xilosidasas para eliminar cualquier residuo de xilosa terminal; otros métodos incluyen la fijación de residuos de xilosa a la glucosa expuesta o los residuos de xilosa en el polipéptido del factor VII por el tratamiento con xilosiltransferasas; un tercer método incluye la fijación de residuos de glucosa a residuos de aminoácidos de serina y/o de treonina en el esqueleto del polipéptido del factor VII creando de este modo un polipéptido glicosilado de factor VII.
Breve descripción de los dibujos
La Fig. 1 muestra la glicosilación de la serina 52 del factor VII-wt.
La Fig. 2 muestra un mapeo de la O-glicosilación del factor VII.
La Fig. 3 muestra un esquema de reacción para la fabricación de una preparación de glicoproteínas que exhibe una glicosilación predeterminada ligada a serina/treonina.
La Fig. 4 muestra un cromatograma de primeras fracciones "A" y "B" que muestran el ciclo HIC.
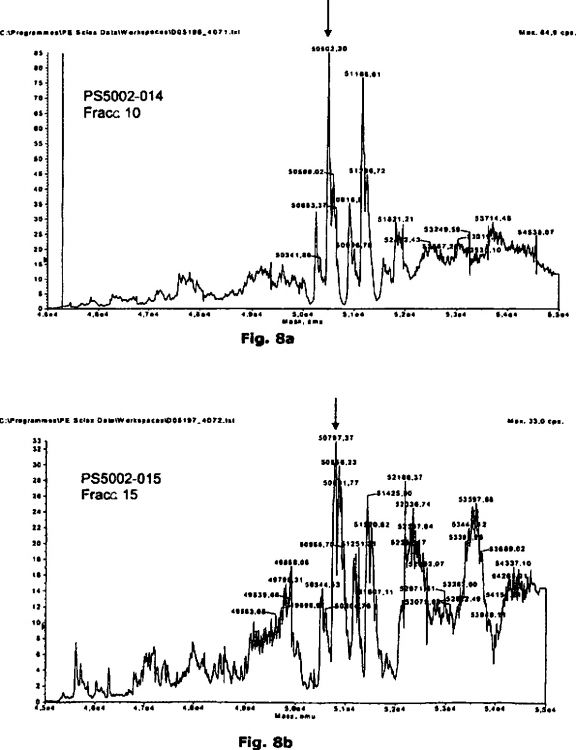
La Fig. 5 muestra un cromatograma obtenido recargando la fracción "A" sobre la columna HIC; Glc-O-Ser52-FVII fue identificado en la fracción del valor máximo, la fracción 10.
La Fig. 6 muestra un cromatograma obtenido recargando la fracción "B" sobre la columna HIC; Xyl-Xyl-Glc-O-Ser52-FVII fue identificado en la fracción del valor máximo, la fracción 15.
La Fig. 7A muestra un mapa del péptido tríptico de la fracción del valor máximo, la fracción 10; la flecha indica el glicopéptido Glc-O-Ser52 O.
La Fig. 7B muestra un mapa del péptido tríptico de la fracción del valor máximo, la fracción 15; la flecha indica el glicopéptido Xyl-Xyl-Glc-O-Ser52 O.
La Fig. 8A muestra un análisis de la masa total de la fracción del valor máximo, la fracción 10; la flecha indica la glicoforma Glc-O-Ser52-rFVIIa O.
La Fig. 8B muestra un análisis de la masa total de la fracción del valor máximo, la fracción 15; la flecha indica la glicoforma Xyl-Xyl-Glc-O-rFVIIa O.
Descripción detallada
Las abreviaturas siguientes se utilizan aquí:
Reivindicaciones:
1. Preparación de un polipéptido del factor VII conteniendo un motivo Cys-X1-Ser/Thr-X2-Pro-Cys y donde dicha serina/treonina forma parte de un enlace covalente Glc-O-Ser/Thr, donde la preparación contiene un modelo de glicosilación ligado a serina/treonina que es uniforme al menos en un 80%.
2. Preparación según la reivindicación 1, donde el modelo de glicosilación es uniforme al menos en un 85%, preferiblemente al menos en un 90%, al menos en un 95%, o al menos uniforme en un 98%.
3. Preparación según la reivindicación 1 o la reivindicación 2, donde el glicano ligado a serina/treonina es Xyl-Xyl-Glc-.
4. Preparación según la reivindicación 1 o la reivindicación 2, donde el glicano ligado a serina/treonina es Xyl-Glc-.
5. Preparación según la reivindicación 1 o la reivindicación 2, donde el glicano ligado a serina/treonina es Glc-.
6. Preparación según cualquiera de las reivindicaciones 1-5, donde la glicoproteína es el factor VII humano.
7. Preparación según cualquiera de las reivindicaciones 1-5, donde la glicoproteína es una variante del factor VII y donde la proporción entre la actividad de la variante del factor VII y la actividad del factor humano VIIa nativo (FVIIa de tipo salvaje) es al menos aproximadamente 1,25 cuando se evalúa en el "ensayo de hidrólisis in vitro" o en el "ensayo de proteólisis in vitro", ambos como se describe en la presente descripción, preferiblemente al menos aproximadamente 2,0, o al menos aproximadamente 4,0.
8. Método para producir una preparación como se describe en las reivindicaciones 1 a 7, donde el glicano ligado a serina/treonina es -Glc; el método comprendiendo las fases de:
9. Método según la reivindicación 8, incluyendo además la fase de aislamiento de la glicoproteína preparada en la fase (b) con una glicosilación de la glucosa-O-serina/treonina.
10. Método según cualquiera de las reivindicaciones 8-9, donde la glicosilación es una glicosilación de la serina.
11. Método según cualquiera de las reivindicaciones 8-10, incluyendo además la fase de análisis de la estructura de los oligosacáridos ligados a los polipéptidos para determinar un modelo de la glicoforma, y, opcionalmente, repetir la fase (b) hasta que el modelo de glicoforma deseado sea conseguido.
12. Método para producir una preparación como se describe en las reivindicaciones 1-7, donde el glicano ligado a serina/treonina es Glc; el método comprendiendo las fases de:
13. Método según la reivindicación 12, incluyendo además la fase de aislamiento de la glicoproteína preparada en la fase (b) con una glicosilación de glucosa-O-serina/treonina.
14. Método según cualquiera de las reivindicaciones 12-13, donde la glicosilación es una glicosilación de la serina.
15. Método según cualquiera de las reivindicaciones 12-14, incluyendo además la fase de análisis de la estructura de los oligosacáridos ligados a los polipéptidos para determinar un modelo de la glicoforma, y, opcionalmente, repetir la fase (b) hasta que el modelo de la glicoforma deseado sea conseguido.
16. Método para producir una preparación como se describe en las reivindicaciones 1-7, donde el glicano ligado a serina/treonina es Xyl- Glc-; el método comprendiendo las fases de:
17. Método según la reivindicación 16, incluyendo además la fase de aislamiento de la glicoproteína preparada en la fase (b) con una glicosilación de xilosa-glucosa-O-serina/treonina.
18. Método según cualquiera de las reivindicaciones 16-17, donde la glicosilación es una glicosilación de la serina.
19. Método según cualquiera de las reivindicaciones 16-18, incluyendo además la fase de análisis de la estructura de los oligosacáridos ligados a los polipéptidos para determinar un modelo de glicoforma, y, opcionalmente, repetición de la fase (b) hasta que el modelo de glicoforma sea conseguido.
20. Método según cualquiera de las reivindicaciones 16-19, incluyendo además la fase de eliminar residuos de xilosa terminales sometiendo la preparación obtenida en la fase (a) al método descrito en las reivindicaciones 8-11 antes de la fase (b).
21. Método para hacer una preparación como se describe en las reivindicaciones 1-7, donde el glicano ligado a serina/treonina es Xyl-Xyl-Glc-; el método comprendiendo las fases de:
22. Método según la reivindicación 21, incluyendo además la fase de aislamiento de la preparación obtenida en la fase (b) antes de someter la preparación a la fase (c).
23. Método según cualquiera de las reivindicaciones 21-22, incluyendo además la fase de aislamiento de la glicoproteína preparada en la fase (c) con una glicosilación de xilosa-xilosa-glucosa-O-serina/treonina.
24. Método según cualquiera de las reivindicaciones 21-23, donde la glicosilación es una glicosilación de la serina.
25. Método según cualquiera de las reivindicaciones 21-24, incluyendo además la fase de análisis de la estructura de los oligosacáridos ligados a los polipéptidos para determinar un modelo de glicoforma, y, opcionalmente, repetición de la fase (b) y/o la fase (c) hasta que el modelo de glicoforma deseado sea conseguido.
26. Método según cualquiera de las reivindicaciones 21-25, incluyendo además la fase de eliminar residuos de xilosa terminales sometiendo la preparación obtenida en la fase (a) al método descrito en las reivindicaciones 8-11 antes de la fase (b).
Patentes similares o relacionadas:
Polipéptidos de unión a IL-17A, del 15 de Julio de 2020, de AFFIBODY AB: Polipéptido de unión a IL-17A, que comprende un motivo de unión BM a IL-17A, cuyo motivo consiste en una secuencia de aminoácidos seleccionada […]
Medios mejorados para la expresión de proteínas recombinantes dependientes de vitamina k, del 6 de Mayo de 2020, de CSL Behring Lengnau AG: Un procedimiento para mejorar la actividad de una proteína recombinante dependiente de vitamina K que comprende las siguientes etapas: a) proporcionar […]
Método para purificar y cuantificar la trombina y sus polipéptidos de degradación, del 25 de Marzo de 2020, de OMRIX BIOPHARMACEUTICALS LTD.: Un método cromatográfico de un solo paso para cuantificar α-trombina en una solución que comprende la α-trombina y al menos uno de un polipéptido de degradación […]
Direccionamiento de factores de coagulación al TLT-1 en plaquetas activadas, del 23 de Octubre de 2019, de NOVO NORDISK HEALTH CARE AG: Una proteína procoagulante que comprende (i) al menos un factor de coagulación, que es un polipéptido de FVII o un polipéptido de FIX, unido covalentemente […]
Sistemas de expresión específica de hígado optimizados para FVIII y FIX, del 23 de Octubre de 2019, de VRIJE UNIVERSITEIT BRUSSEL: Casete de expresión de ácido nucleico que comprende: - una repetición triple dispuesta en tándem de un elemento regulador de ácido nucleico específico de hígado, consistiendo […]
Composición y apósito para tratamiento de heridas, del 14 de Agosto de 2019, de Protege Biomedical, LLC: Una composición para la curación de heridas, que comprende: una mezcla sustancialmente homogénea que comprende una cantidad de mullita, en la que la cantidad de mullita es efectiva […]
 Activación de factor X, del 31 de Julio de 2019, de Baxalta Incorporated: Método para activar el factor de coagulación X (FX) que comprende;
a) poner en contacto una disolución acuosa que comprende FX con un material de […]
Activación de factor X, del 31 de Julio de 2019, de Baxalta Incorporated: Método para activar el factor de coagulación X (FX) que comprende;
a) poner en contacto una disolución acuosa que comprende FX con un material de […]
Métodos y composiciones para proteínas del factor IX modificadas, del 19 de Junio de 2019, de THE UNIVERSITY OF NORTH CAROLINA AT CHAPEL HILL: Una proteína del Factor IX (FIX) aislada que comprende la secuencia de aminoácidos como se expone en la SEQ ID NO: 3, en donde Xaa es leucina.