COMPUESTOS UNIDOS A UN CALIXARENO QUE SE UNEN A FACTORES DE CRECIMIENTO.
Compuesto que se une a un factor de crecimiento según la estructura calixarénica (I):
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2005/003108.
Solicitante: UNIVERSITY OF SOUTH FLORIDA
YALE UNIVERSITY.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: FAO 126, 4202 EAST FOWLER AVENUE,TAMPA, FL 33620-7900.
Inventor/es: SEBTI, SAID, M., HAMILTON, ANDREW, D., JAIN,RISHI.
Fecha de Publicación: .
Fecha Concesión Europea: 10 de Marzo de 2010.
Clasificación Internacional de Patentes:
- A61K47/48H4
- A61K47/48W18
Clasificación PCT:
- A61K47/48
Clasificación antigua:
- A61K47/48

Fragmento de la descripción:
Compuestos unidos a un calixareno que se unen a factores de crecimiento.
Antecedentes de la invención
La capacidad de los tumores para crecer más allá de unos pocos milímetros cúbicos en volumen depende de la formación de nuevos vasos sanguíneos en el microentorno de los tumores (Ferrara, N. Nat Rev Cáncer, 2002, 2:795-803; Kerbel, R.S. Carcinogenesis, 2000, 21:505-15; Carmeliet, P. y Jain, R.K. Nature, 2000, 407:249-57; Yancopoulos, G.D. et al. Nature, 2000, 407:242-8). Este proceso angiogénico es disparado por varios factores de crecimiento claves que son segregados por el tumor. Los factores de crecimiento no sólo se unen a sus receptores en células endoteliales y estimulan su proliferación iniciando la formación de nuevos vasos sanguíneos, sino también se unen a receptores en células accesorias tales como pericitos que mantienen la integridad de los vasos (Ferrara, N. Nat Rev Cáncer, 2002, 2:795-803; Kerbel, R.S. Carcinogenesis, 2000, 21:505-15; Carmeliet, P. y Jain, R.K. Nature, 2000, 407:249-57; Yancopoulos, G.D. et al. Nature, 2000, 407:242-8; Helmlinger, G., et al. Nat Med, 1997, 3:177-82; Holash, J. et al. Science, 1999, 284:1994-8). Entre los factores de crecimiento más estudiados están el factor de crecimiento endotelial vascular (VEGF) y el factor de crecimiento derivado de plaquetas (PDGF). Varios estudios han demostrado la participación de estos dos factores de crecimiento en el proceso angiogénico, desempeñando el VEGF un papel clave principalmente en la iniciación de la formación de nuevos vasos sanguíneos, y estando el PDGF implicado en el mantenimiento de estos vasos (Bergers, G. et al. J Clin Invest, 2003, 111:1287-95; Dvorak, H.F. J Clin Oncol, 2002, 20:4368-80; Ferrara, N. Curr Top Microbiol Immunol, 1999, 237:1-30; Dvorak, H.F. et al. Curr Top Microbiol Immunol, 1999, 237:97-132; Eriksson, U. y Alitalo, K. Curr Top Microbiol Immunol, 1999, 237:41-57).
Esta observación ha alentado un interés en diseñar estrategias para suprimir las funciones de VEGF y PDGF, con el objetivo final de inhibir la angiogénesis y privar de alimento a los tumores. Los enfoques que se han tomado se basaron en seleccionar como dianas las etapas bioquímicas implicadas en el mecanismo de acción de estos factores de crecimiento. Aquellos incluyen inhibir la unión de VEGF y PDGF a sus receptores respectivos usando anticuerpos contra los factores de crecimiento. Uno de estos, AVASTINA, que selecciona como diana a VEGF, ha sido aprobado recientemente para uso clínico en pacientes con cáncer colorrectal metastásico (Zhang, W. et al. Angiogenesis, 2002, 5:35-44; Ferrara, N. Semin Oncol, 2002, 29:10-4). Otro enfoque ha implicado el desarrollo de inhibidores de las actividades de tirosina cinasas de los receptores de PDGF y VEGF, dando como resultado la supresión de las rutas de transducción de señales aguas abajo disparadas por estos factores de crecimiento (Kerbel, R.S. Carcinogenesis, 2000, 21:505-15; Jain, R.K. Semin Oncol, 2002, 29:3-9; Morin, M.J. Oncogene, 2000, 19:6574-83; Miao, R.Q. et al. Blood, 2002, 100:3245-52; Laird, A.D. et al. Cáncer Res, 2000, 60:4152-60; Wedge, S.R. et al. Cáncer Res, 2000, 60:970-5). La mayoría de estos agentes imitan la estructura de ATP, y algunos son potentes agentes antitumorales que actualmente están en ensayos clínicos. Sin embargo, todavía ninguno ha sido aprobado por la FDA.
La aprobación por la FDA de AVASTINA (bevacizumab), que incrementa en 5 meses la supervivencia media de pacientes con cáncer colorrectal metastásico, valida adicionalmente la selección como diana de procesos angiogénicos como una estrategia para tratar cáncer (Ferrara, N. Semin Oncol, 2002, 29:10-4). Sin embargo, es necesario hacer mucho más para explotar completamente este enfoque. Por ejemplo, en otros ensayos clínicos, AVASTINA no pudo prolongar las vidas de pacientes con cáncer de mama metastásico. Una posible explicación para esta actividad inconsistente es que el cáncer de mama metastásico avanzado puede burlar la terapia angiogénica anti-VEGF por medio de otros factores de crecimiento. De hecho, el apoyo para esta sugerencia procede de estudios preclínicos que muestran que el cáncer de mama temprano segrega principalmente VEGF, mientras que el cáncer de mama avanzado segrega factores de crecimiento adicionales (Relf, M. et al. Cáncer Res, 1997, 57:963-9). Además, en un modelo de cáncer pancreático de animal, SU5416, un inhibidor de tirosina cinasa del receptor de VEGF, suprime el desarrollo temprano, pero no tardío, de tumores pancreáticos. De forma más importante en el mismo modelo, el tratamiento con SU6668 (que inhibe tirosina cinasas tanto de receptores de VEGF como de PDGF) indujo la regresión de tumor pancreático avanzado en la etapa tardía de desarrollo (Bergers, G. et al. J Clin Invest, 2003, 111: 1287-95), sugiriendo que el fracaso de la terapia anti-VEGF puede ser debido a su capacidad para inhibir sólo el inicio pero no el mantenimiento de los vasos sanguíneos. Otro apoyo para esta sugerencia procede de un estudio muy reciente en el que AVASTINA inhibió la formación de nuevos vasos sanguíneos, pero fue ineficaz inhibiendo los ya consolidados, en un modelo de animal en el que se transplantaron células de neuroblastoma en riñones de ratón (Huang, J. et al. Proc Natl Acad Sci USA, 2003, 100: 7785-90). Tomado en conjunto, la presente comprensión del proceso de angiogénesis sugiere que la selección simultáneamente como dianas de factores de crecimiento que inician (es decir, VEGF) así como aquellos que mantienen (es decir, PDGF) los vasos sanguíneos puede ser un enfoque más eficaz para la terapia contra el cáncer que la selección de sólo un factor de crecimiento.
Breve sumario de la invención
Un objetivo de la presente invención consiste en diseñar una familia de compuestos que se unen a VEGF y/o PDGF e inhiben la unión de estos factores de crecimiento a sus receptores de las superficies celulares respectivos. Por ejemplo, se encontró que el compuesto GFB204, es un inhibidor potente y selectivo de la estimulación de VEGF y PDGF de su fosforilación y señalización (Erk1/2, Akt y STAT3) de tirosina cinasas receptoras. Este agente farmacológico también inhibió potentemente la migración de células endoteliales y la formación de redes capilares in vitro, así como la formación de vasos sanguíneos in vivo y el crecimiento de tumores humanos en xenoinjertos de ratones atímicos.
Otro objetivo adicional de la presente invención consiste en proporcionar composiciones farmacéuticas de la familia de compuestos citada anteriormente. También se explican métodos para administrar los mismos.
Breve descripción de los dibujos
La Figura 1 muestra estructuras de GFB204 de la presente invención, que tienen grupos de ácido isoftálico acíclicos unidos a un armazón orgánico no peptídico, así como GFB-111.
Las Figuras 2A-2C muestran que GFB204 inhibe la unión de 125I-VEGF y 125I-PDGF pero no de 125I-EGF a sus receptores en fibroblastos de ratón. Se incubaron células Flk-1/NIH 3T3, NIH 3T3 y EGFR/NIH 3T3 con 125I-VEGF, 125I-PDGF y 125I-EGF (50.000 cpm/pocillo) respectivamente, junto con concentraciones crecientes de GFB204. Las células se incubaron a 4ºC durante 0,5 horas, después se lavaron tres veces con PBS y tres veces con tampón de lisis antes de determinar los recuentos de 125I como se describe en Materiales y Métodos. Se usó un exceso de VEGF, PDGF, y EGF fríos para obtener niveles de unión no específica. Las Figuras 2A-2C muestran la unión específica (% de control) para PDGFR, Flk-1, y EGFR, respectivamente.
Las Figuras 2D y 2E ilustran que GFB-204 se une a PDGF y VEGF como se indica mediante el factor de crecimiento triptófano cuando se añaden cantidades crecientes de GFB204 a PDGF y VEGF, respectivamente. La fluorescencia se monitorizó mediante excitación a 295 nm y 228 nm, respectivamente, y emisión a 334 nm.
Las Figuras 3A y 3B muestran el efecto de GFB204 sobre la fosforilación de Erk1, Erk2, Akt, y STAT3 estimulada por el factor de crecimiento. GFB204 inhibe la estimulación por VEGF y PDGF de la fosforilación de tirosina de Flk-1 y la fosforilación de Erk1/Erk2 (Figura 3A). Se trataron células NIH 3T3 o células Flk-1/NIH 3T3 con cantidades crecientes de GFB204 durante 5 minutos antes de la estimulación con PDGFBB (10 ng/ml) o VEGF (50 ng/ml), respectivamente, durante 10 minutos. Las células se lisaron entonces y se procesaron para la transferencia Western mediante SDS-PAGE con un anticuerpo específico para...
Reivindicaciones:
1. Compuesto que se une a un factor de crecimiento según la estructura calixarénica (I):

en la que cada R1 se selecciona independientemente de entre el grupo que consiste en:

y

en la que cada R2 se selecciona independientemente de entre el grupo que consiste en:


2. Compuesto que se une a factores de crecimiento según la reivindicación 1, en el que el compuesto selecciona como dianas a factores de crecimiento derivados de plaquetas, factores de crecimiento endoteliales vasculares, o una mezcla de los mismos.
3. Compuesto que se une a un factor de crecimiento según la reivindicación 1 ó 2, en el que el compuesto es un compuesto según la estructura (I), en la que:
cada R1 es

y cada R2 es

cada R1 es
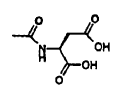
y cada R2 es

cada R1 es
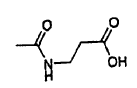
y cada R2 es

cada R1 es

y cada R2 es

cada R1 es

y cada R2 es

cada R1 es

y cada R2 es

cada R1 es

y cada R2 es

cada R1 es

y cada R2 es

cada R1 es

y cada R2 es

cada R1 es

y cada R2 es
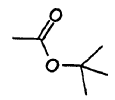
cada R1 es

y cada R2 es

cada R1 es

y cada R2 es

cada R1 es

y cada R2 es

cada R1 es

y cada R2 es

cada R1 es

y cada R2 es

cada R1 es

y cada R2 es

cada R1 es

y cada R2 es

cada R1 es

y cada R2 es

cada R1 es

y cada R2 es

4. Compuesto que se une a un factor de crecimiento según la reivindicación 3, en el que:
cada R1 es

y cada R2 es
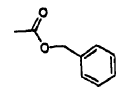
5. Composición farmacéutica que comprende el compuesto que se une a un factor de crecimiento según cualquiera de las reivindicaciones 1 a 4, o una sal farmacéuticamente aceptable del mismo, y un vehículo farmacéuticamente aceptable.
6. Compuesto que se une a un factor de crecimiento según cualquiera de las reivindicaciones 1 a 4, o una sal farmacéuticamente aceptable del mismo, para uso en terapia.
7. Uso de un compuesto que se une a un factor de crecimiento según cualquiera de las reivindicaciones 1 a 4, o una sal farmacéuticamente aceptable del mismo, en la preparación de un medicamento para el tratamiento de una enfermedad que comprende exceso de proliferación celular, exceso de angiogénesis, un tumor, cáncer, o una combinación de los mismos.
8. Método in vitro para inhibir la unión de factores de crecimiento a las células, para inhibir la fosforilación estimulada por factores de crecimiento, para inhibir la angiogénesis, para inhibir el crecimiento de cánceres y de tumores, o una combinación de los mismos, que comprende la etapa de: poner en contacto el compuesto que se une a un factor de crecimiento según la reivindicación 1, o una sal farmacéuticamente aceptable.
9. Método in vitro según la reivindicación 8, en el que se inhibe la fosforilación de Erk1, Erk2, Akt, o STAT3.
Patentes similares o relacionadas:
 INHIBIDORES DUALES ANTITROMBÓTICOS ANTICOAGULANTES QUE COMPRENDEN UNA MARCA DE BIOTINA, del 27 de Junio de 2011, de N. V. ORGANON: Un compuesto antitrombótico de fórmula I oligosacárido-espaciador-antagonista de GpIIb/IIIa (I), donde el oligosacárido es un residuo de pentasacárido cargado […]
INHIBIDORES DUALES ANTITROMBÓTICOS ANTICOAGULANTES QUE COMPRENDEN UNA MARCA DE BIOTINA, del 27 de Junio de 2011, de N. V. ORGANON: Un compuesto antitrombótico de fórmula I oligosacárido-espaciador-antagonista de GpIIb/IIIa (I), donde el oligosacárido es un residuo de pentasacárido cargado […]
 FORMAS MODIFICADAS DE AGENTES FARMACOLÓGICAMENTE ACTIVOS Y SUS USOS, del 30 de Marzo de 2011, de MEDINOX, INC: Un compuesto de fórmula **Fórmula** en el que: X es -CH2CH2- y R es -CH3, -C6H5, -mC6H4NO2 ó -CH2CH2OH; ó X es -CH2CH2CH2- y R es -CH3 ó -ONa; ó X es -CH2CH2CH2CH2- y R -CH3 ó […]
FORMAS MODIFICADAS DE AGENTES FARMACOLÓGICAMENTE ACTIVOS Y SUS USOS, del 30 de Marzo de 2011, de MEDINOX, INC: Un compuesto de fórmula **Fórmula** en el que: X es -CH2CH2- y R es -CH3, -C6H5, -mC6H4NO2 ó -CH2CH2OH; ó X es -CH2CH2CH2- y R es -CH3 ó -ONa; ó X es -CH2CH2CH2CH2- y R -CH3 ó […]
 MOLECULAS BIFUNCIONALES Y TERAPIAS BASADAS EN LAS MISMAS, del 22 de Octubre de 2010, de THE BOARD OF TRUSTEES OF THE LELAND STANFORD JUNIOR UNIVERSITY: Molécula bifuncional de origen no natural de menos de aproximadamente 5000 dalton que consiste en un resto de fármaco y un ligando de proteína presentadora, […]
MOLECULAS BIFUNCIONALES Y TERAPIAS BASADAS EN LAS MISMAS, del 22 de Octubre de 2010, de THE BOARD OF TRUSTEES OF THE LELAND STANFORD JUNIOR UNIVERSITY: Molécula bifuncional de origen no natural de menos de aproximadamente 5000 dalton que consiste en un resto de fármaco y un ligando de proteína presentadora, […]
USO DE CONJUGADOS DE ACIDO BILIAR O SAL BILIAR CON ACIDO GRASO, del 19 de Noviembre de 2009, de GALMED INTERNATIONAL LTD.: Un conjugado de ácido biliar o sal biliar con ácido graso de fórmula general II W- X - G en la que G es un radical de ácido biliar o sal biliar, que, si se desea, está conjugado […]
NANOPARTÍCULAS CON REVESTIMIENTO METÁLICO PARA SU USO EN EL TRATAMIENTO DE DERMATITIS ENZIMÁTICA, del 7 de Junio de 2011, de MCNEIL-PPC, INC.: Un material compuesto que comprende: (a) una nanopartícula exfoliada que tiene una superficie y (b) un metal seleccionado de los Grupos 3 a 12, aluminio y magnesio, en el […]
 METODO DE PRODUCCION DE UNA PREPARACION CATIONICA DE LIPOSOMAS QUE COMPRENDE UN COMPUESTO LIPOFILO, del 15 de Enero de 2010, de MEDIGENE AG: Un método para producir una preparación catiónica de liposomas que comprende al menos un compuesto anfifílico seleccionado de lípidos catiónicos en una […]
METODO DE PRODUCCION DE UNA PREPARACION CATIONICA DE LIPOSOMAS QUE COMPRENDE UN COMPUESTO LIPOFILO, del 15 de Enero de 2010, de MEDIGENE AG: Un método para producir una preparación catiónica de liposomas que comprende al menos un compuesto anfifílico seleccionado de lípidos catiónicos en una […]
Derivativos del ácido siálico para la derivatización y conjugación de proteínas, del 20 de Diciembre de 2019, de LIPOXEN TECHNOLOGIES LIMITED: Un procedimiento de producción de un derivativo aldehído de un ácido siálico en el que un material de partida que tiene una unidad de ácido siálico en el […]
GELES DE QUITOSANO(A) CONTENIENDO NANOPARTICULAS METALICAS DE COBRE, PLATA Y ANTIBIOTICOS (CIPROFLOXACINO, CEFOTAXIME, GENTAMICINA Y CLOXACILINA), del 12 de Diciembre de 2019, de CARDENAS Y CIA LTDA: En la presente invención se describen geles de quitosano (poli-beta-glucosamina) con propiedades bactericidas y fungicidas en mezcla con nanopartículas […]