FORMAS MODIFICADAS DE AGENTES FARMACOLÓGICAMENTE ACTIVOS Y SUS USOS.
Un compuesto de fórmula **Fórmula** en el que: X es -CH2CH2- y R es -CH3,
-C6H5, -mC6H4NO2 ó -CH2CH2OH; ó X es -CH2CH2CH2- y R es -CH3 ó -ONa; ó X es -CH2CH2CH2CH2- y R -CH3 ó -ONa; ó X es -(CH2)2-O- y R es -pC6H4-Me; ó X es -(CH2)3-O- y R es -CH3 ó -CF3; ó X es -(CH2)4-O- y R es -CH3, -CH2CH3, -C6H5, -mCF3-C6H5 ó -pCH3-OC6H5; ó X es -(CH2)5-O- y R es -CH3 ó -pNO2-C6H5; ó X es -(CH2)6-O- y R es -CH3; ó X es -(CH2)3-NH- y R es -CH3, -pC6H4-Me, -oC6H4-NO2; ó X es -(CH2)4-NH- y R es -CH3; ó X es -(CH2)5-NH- y R es -pC6H4-CH3; ó X es -(CH2)6-NH- y R es -CH3; ó X es -(CH2)6-NH- y R es -pC6H4-CH3 ó X es (CH2)3O, (CH2)4O, (CH2)5O ó (CH2)6O y R es -pC6H4-CH3; ó X es (CH2CH2)2OO y R es -pC6H4-CH3; ó X es -X1-O- y R es -pC6H4-CH3; donde X1 es**Fórmula**
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2001/019750.
Solicitante: MEDINOX, INC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: SUITE 201 11575 SORRENTO VALLEY ROAD SAN DIEGO, CA 92121 ESTADOS UNIDOS DE AMERICA.
Inventor/es: WANG,TINGMIN, LAI,Ching-San.
Fecha de Publicación: .
Fecha Solicitud PCT: 19 de Junio de 2001.
Clasificación Internacional de Patentes:
- A61K47/48H4
- A61K47/48H4H
- A61K47/48H4S
Clasificación PCT:
- A61K31/18 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Sulfamidas (compuestos que contienen un grupo para N-benceno-sulfonil-N A61K 31/63).
- A61K47/48
- A61P29/02 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 29/00 Agentes analgésicos, antipiréticos o antiinflamatorios que no actúan sobre el sistema nervioso central, p. ej. agentes antirreumáticos; Antiinflamatorios no esteroideos (AINEs). › sin efecto antiinflamatorio.
- C07C219/18 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07C COMPUESTOS ACICLICOS O CARBOCICLICOS (compuestos macromoleculares C08; producción de compuestos orgánicos por electrolisiso electroforesis C25B 3/00, C25B 7/00). › C07C 219/00 Compuestos que contienen grupos amino e hidroxi esterificados unidos a la misma estructura carbonada. › siendo saturada la estructura carbonada y conteniendo ciclos.
- C07C69/76 C07C […] › C07C 69/00 Esteres de ácidos carboxílicos; Esteres del ácido carbónico o del ácido halofórmico. › Esteres de ácidos carboxílicos en los que un grupo carboxilo esterificado está unido a un átomo de carbono de un ciclo aromático de seis miembros.
Clasificación antigua:
- A61K A61 […] › PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D).
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
Fragmento de la descripción:
CAMPO DE LA INVENCIÓN
La presente invención se refiere a una forma modificada de naproxeno y a unos métodos para la preparación y el uso de la misma. En un aspecto concreto de la invención, los compuestos se proporcionan para el 5 tratamiento de patologías, reduciendo así la aparición de efectos secundarios causados por el naproxeno.
ANTECEDENTES DE LA INVENCIÓN
A pesar de la llegada de tecnología farmacéutica moderna, muchos fármacos aún poseen una toxicidad adversa que a menudo limita el potencial terapéutico de los mismos. Por ejemplo, a pesar de que los fármacos antiinflamatorios no esteroideos (NSAIDs) son una clase de compuestos que son ampliamente utilizados para el 10 tratamiento de la inflamación, el dolor y la fiebre, los NSAIDs (p. ej. naproxeno, aspirina, ibuprofeno y ketoprofeno) pueden causar úlceras gastrointestinales, un efecto secundario que sigue siendo la principal limitación al uso de los NSAIDs (véase, por ejemplo, J. L. Wallace, en Gastroenterol. 112:10001016 (1997); A. H. Soll et al., en Ann Intern Med. 114:307319 (1991); y J. Bjarnason et al., en Gastroenterol. 104:18321847 (1993)).
Hay dos efectos ulcerogénicos principales de los NSAIDs: (1) efectos irritantes en el epitelio del tracto 15 gastrointestinal y (2) supresión de la síntesis de prostaglandinas gastrointestinales. En los últimos años, se han intentado diseñar numerosas estrategias y desarrollar nuevos NSAIDs que reduzcan el daño para el tracto gastrointestinal. Sin embargo, estos esfuerzos han sido en gran medida infructuosos. Por ejemplo, las formulaciones de liberación lenta o de recubrimiento entérico, diseñadas para reducir las propiedades irritantes tópicas de los NSAIDs han demostrado ser ineficaces en términos de reducir la incidencia de los efectos secundarios clínicamente significativos, 20 incluyendo la perforación y el sangrado (véase, por ejemplo, D. Y. Graham et al., en Clin. Pharmacol. Ther. 38:6570 (1985); y J. L. Carson, et al., en Arch. Intern. Med., 147:10541059 (1987)).
Es bien sabido que la aspirina y otros NSAIDs ejercen sus efectos farmacológicos a través de la inhibición no selectiva de las enzimas ciclooxigenasa (COX), bloqueando así la síntesis de prostaglandinas (véase, por ejemplo, J. R. Van en Nature, 231:232235 (1971)). Existen dos tipos de enzimas COX, es decir, COX1 y COX2. COX1 se expresa 25 constitutivamente en muchos tejidos, incluyendo el estómago, el riñón y las plaquetas, mientras que COX2 se expresa sólo en el sitio de la inflamación (véase, por ejemplo, S. Kargan et al. en Gastroenterol., 111:445454 (1996)). Las prostaglandinas derivadas de COX1 son responsables de muchos de los efectos fisiológicos, incluyendo el mantenimiento de la integridad de la mucosa gástrica.
Se han hecho muchos intentos para desarrollar NSAIDs que inhiban sólo la COX2, sin afectar la actividad 30 de COX1 (véase, por ejemplo, J.A. Mitchell et al., en Proc. Natl. Acad. Sci. USA 90:1169311697 (1993); y E.A. Meade et al., en J. Biol. Chem., 268:66106614 (1993)). Hay varios NSAIDs actualmente en el mercado (p. ej. rofecoxib y celecoxib) que muestran selectividad marcada para la COX2 (véase, por ejemplo, E. R. Meade, supra.; K. Glaser et al., en EUR. J. Pharmacol. 281:107111 (1995) y Kaplan-Machlis, B., y Klostermeyer, BS en Ann Pharmacother. 33:979-88, (1999)). Estos fármacos parece que han reducido la toxicidad gastrointestinal con respecto a otros NSAIDs del mercado. 35
En base a mejorar los datos clínicos así como los experimentales, el desarrollo de inhibidores de COX2 altamente selectivos parece ser una buena estrategia para desarrollar una nueva generación de fármacos antiinflamatorios. Sin embargo, las funciones fisiológicas de COX1 y COX2 no siempre están bien definidas. Por lo tanto, existe una posibilidad de que las prostaglandinas producidas como resultado de la expresión de COX1 también puedan contribuir a la inflamación, al dolor y a la fiebre. Por otra parte, las prostaglandinas producidas por COX2 han 40 demostrado desempeñar funciones fisiológicas importantes, que incluyen la iniciación y el mantenimiento del trabajo de parto y la regulación de la resorción ósea (véase, por ejemplo, D. M. Slater et al., en Am. J. Obstet. Gynecol., 172:7782 (1995); y Y. Onoe et al., en J. Immunol. 156:758764 (1996)), por lo tanto la inhibición de esta vía puede no ser siempre beneficiosa. Teniendo en cuenta estos puntos, los inhibidores de COX2 altamente selectivos pueden producir efectos secundarios adicionales más allá de los observados con los NSAIDs estándar, por lo tanto tales inhibidores pueden no 45 ser altamente deseables.
Bouchard et al. Drug metabolism and disposition (1993) vol. 21, nº 2, páginas 293-298; Malmoud et al. Carcinogenesis (1998) vol. 19, nº 1, páginas 87-91; y Giuliano et al., Br. J. of Pharmacology (1999), vol. 126, nº 8, páginas de 1824-1830 aluden al sulfuro de sulindac.
Malmstrom et at., Clinical Therapeutics (1999) vol. 21, nº 10, páginas 168-1663 compara el alivio del dolor 50 de los inhibidores de COX2 Rofecoxib y Celecoxib con el ibuprofeno.
Por consiguiente, existe todavía la necesidad en la técnica de formas modificadas de los NSAIDs que reduzcan la incidencia de efectos secundarios, con respecto a la incidencia de efectos secundarios causados por tales agentes farmacológicamente activos en la forma sin modificar.
55
BREVE DESCRIPCIÓN DE LA INVENCIÓN
De acuerdo con la presente invención, se proporciona una nueva clase de naproxeno NSAID modificado que causa una incidencia mucho menor de efectos secundarios que la observada por lo general con la forma sin modificar debido a los efectos protectores proporcionados por la modificación del NSAID.
Existe una serie de ventajas proporcionadas por el naproxeno modificado de acuerdo con la invención 5 que incluyen una o más de las siguientes:
(i) reducción de los efectos irritantes (p. ej., la irritación por contacto) del naproxeno,
(ii) mejora de la transferencia del fármaco a los tejidos como resultado de una disminución de las cargas netas de naproxeno, reduciendo así la cantidad de material que debe ser administrada para lograr una dosis efectiva, y
(iii) reducción de la concentración máxima (Cmax) lograda tras la administración a un sujeto con respecto al 10 naproxeno sin modificar, manteniendo una concentración terapéuticamente eficaz del naproxeno en el plasma del sujeto.
De acuerdo con la presente invención, el clivaje del naproxeno NSAID modificado a partir del grupo modificado anexado al mismo libera el agente farmacéuticamente activo.
BREVE DESCRIPCIÓN DE LAS FIGURAS 15
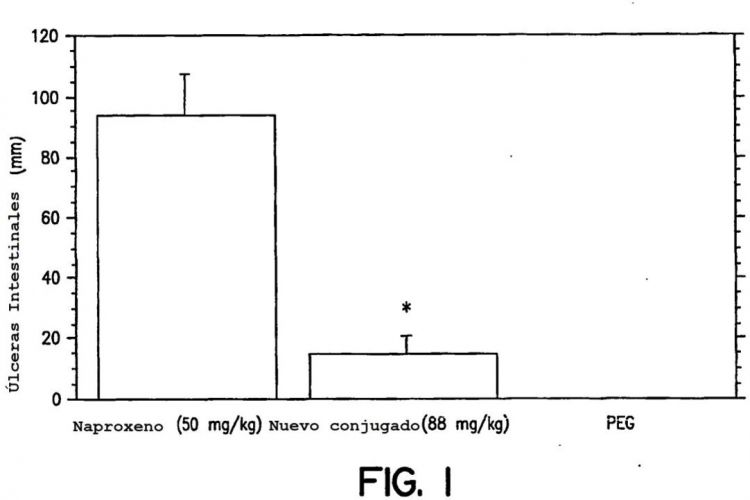
La figura 1 ilustra la longitud total de úlceras intestinales medida después de tres dosis diarias de NSAIDs en ratas Sprague-Dawley macho no sometidas a ayuno (150-200 g) tratadas con el excipiente, naproxeno, o una composición equimolar de la invención (compuesto 19). *P < 0,05 mediante la prueba t no apareada.
La figura 2 ilustra la longitud total de úlceras intestinales medida después de 14 dosis diarias de NSAID en ratas Sprague-Dawley macho no sometidas a ayuno (150-200 g) tratadas con el excipiente (barra 7), tres dosis de 20 naproxeno (barra 1: 50 mg/kg, barra 2: 45 mg/kg, barra 3: 40 mg/kg), o tres dosis equimolares de la composición de la invención (compuesto 19) (barras 4-6). *P < 0,05 mediante prueba t no apareada vs. la dosis de naproxeno correspondiente.
La figura 3 ilustra la inhibición de los aumentos de volumen de pata en las patas no inyectadas de ratas macho de Lewis en las que la artritis fue inducida por inyección intradérmica de un adyuvante en la almohadilla plantar. 25 Las ratas fueron inyectadas en el día 0 y tratadas una vez al día desde los días 8 a 15 con el excipiente, naproxeno (10 mg/kg), o la composición de la invención (compuesto 19) en dosis equivalentes. Los volúmenes de pata se midieron con un pletismómetro en los días 5 y 15. Círculos cerrados = naproxeno; cuadrados = composición de la invención.
La Figura 4 compara los perfiles de concentración-tiempo en plasma del naproxeno (n = 4, media ± d.s.) tras la administración oral de naproxeno (círculos abiertos) a 2 mg/kg y naproxeno modificado (triángulos abiertos) a una 30 dosis equivalente de 2 mg/kg con respecto al naproxeno en las ratas. En instantes en el tiempo predeterminados, se recogieron muestras de sangre y se centrifugaron para obtener las muestras de plasma. Los niveles...
Reivindicaciones:
1. Un compuesto de fórmula
**(Ver fórmula)**
5
en el que:
X es -CH2CH2- y R es -CH3, -C6H5, -mC6H4NO2 ó -CH2CH2OH; ó 10
X es -CH2CH2CH2- y R es -CH3 ó -ONa; ó
X es -CH2CH2CH2CH2- y R -CH3 ó -ONa; ó
X es –(CH2)2-O- y R es -pC6H4-Me; ó
X es –(CH2)3-O- y R es -CH3 ó -CF3; ó
X es –(CH2)4-O- y R es -CH3, -CH2CH3, -C6H5, -mCF3-C6H5 ó -pCH3-OC6H5; ó 15
X es -(CH2)5-O- y R es -CH3 ó -pNO2-C6H5; ó
X es -(CH2)6-O- y R es -CH3; ó
X es -(CH2)3-NH- y R es -CH3, -pC6H4-Me, -oC6H4-NO2; ó
X es -(CH2)4-NH- y R es -CH3; ó
X es -(CH2)5-NH- y R es -pC6H4-CH3; ó 20
X es -(CH2)6-NH- y R es -CH3; ó
X es -(CH2)6-NH- y R es -pC6H4-CH3 ó
X es (CH2)3O, (CH2)4O, (CH2)5O ó (CH2)6O y R es -pC6H4-CH3; ó
X es (CH2CH2)2OO y R es –pC6H4-CH3; ó
X es -X1-O- y R es -pC6H4-CH3; donde X1 es 25
**(Ver fórmula)**
ó 30
**(Ver fórmula)**
2. El compuesto según se reivindica en la reivindicación 1 en el que:
X es -CH2CH2- y R es CH3. 35
3. El compuesto según se reivindica en la reivindicación 1 de fórmula
**(Ver fórmula)**
5
en el que R es -CH3 ó –C6H5.
4. El compuesto según se reivindica en la reivindicación 3 en el que R es -CH3.
5. Una composición farmacéutica que comprende un compuesto según se reivindica en cualquiera de las reivindicaciones 1 a 4 junto con un excipiente farmacéuticamente aceptable. 10
6. La composición según se reivindica en la reivindicación 5 en la que dicha composición farmacéutica se formula para la administración oral.
7. La composición farmacéutica según se reivindica en cualquiera de las reivindicaciones 5 y 6 en la que dicha composición es una pastilla.
8. Un compuestos según se reivindica en cualquiera de las reivindicaciones 1 a 4 para su uso como medicamento. 15
9. El compuesto de cualquiera de las reivindicaciones 1 a 4 para su uso en el tratamiento de la inflamación o la analgesia.
10. El compuesto de cualquiera de las reivindicaciones 1 a 4 para el uso en el tratamiento del shock séptico, shock hemorrágico, shock anafiláctico, síndrome del shock tóxico, isquemia, isquemia cerebral, administración de citoquinas, sobreexpresión de citoquinas, úlceras, enfermedad inflamatoria del intestino, diabetes, artritis, asma, enfermedad de 20 Alzheimer, enfermedad de Parkinson, esclerosis múltiple, cirrosis, rechazo de aloinjertos, encefalomielitis, meningitis, pancreatitis, peritonitis, vasculitis, coriomeningitis linfocítica, glomerulonefritis, uveítis, ileítis, inflamación, quemadura, infección, hemodiálisis, síndrome de fatiga crónica, ictus, cánceres, derivación cardiopulmonar, lesiones isquémicas/por reperfusión, gastritis, síndrome de dificultad respiratoria del adulto, caquexia, miocarditis, trastornos autoinmunes, eccema, psoriasis, insuficiencia cardíaca, cardiopatía, arterioesclerosis, dermatitis, urticaria, lupus eritematoso 25 sistémico, SIDA, demencia por SIDA, trastorno neurodegenerativo crónico, dolor, priapismo, fibrosis quística, esclerosis lateral amiotrófica, esquizofrenia, depresión, síndrome premenstrual, ansiedad, adicción, dolor de cabeza, migraña, enfermedad de Huntington, epilepsia, trastornos neurodegenerativos, trastornos de la motilidad gastrointestinal, obesidad, hiperfagia, tumores sólidos, malaria, cánceres hematológicos, miofibrosis, lesión pulmonar, enfermedad de injerto contra huésped, lesión en la cabeza, traumatismo del SNC, hepatitis, fallo renal, enfermedad hepática, lesión 30 pulmonar inducida por fármacos, miastenia grave (MG), enfermedades oftálmicas, post angioplastia, restenosis, angina, o enfermedad arterial coronaria, en concreto donde dicha artritis sea artritis reumatoide u osteoartritis, y/o dicho dolor sea dolor crónico o dolor postoperatorio.
11. Uso de un compuesto según se reivindica en cualquiera de las reivindicaciones 1 a 4 en la fabricación de un medicamento para el tratamiento de la inflamación o la analgesia. 35
12. Uso de un compuesto según se reivindica en cualquiera de las reivindicaciones 1 a 4 en la fabricación de un medicamento para tratar el shock séptico, shock hemorrágico, shock anafiláctico, síndrome del shock tóxico, isquemia, isquemia cerebral, administración de citoquinas, sobreexpresión de citoquinas, úlceras, enfermedad inflamatoria del intestino, diabetes, artritis, asma, enfermedad de Alzheimer, enfermedad de Parkinson, esclerosis múltiple, cirrosis, rechazo de aloinjertos, encefalomielitis, meningitis, pancreatitis, peritonitis, vasculitis, coriomeningitis linfocítica, 40 glomerulonefritis, uveítis, ileítis, inflamación, quemadura, infección, hemodiálisis, síndrome de fatiga crónica, ictus, cánceres, derivación cardiopulmonar, lesiones isquémicas/por reperfusión, gastritis, síndrome de dificultad respiratoria del adulto, caquexia, miocarditis, trastornos autoinmunes, eccema, psoriasis, insuficiencia cardíaca, cardiopatía, arterioesclerosis, dermatitis, urticaria, lupus eritematoso sistémico, SIDA, demencia por SIDA, trastorno neurodegenerativo crónico, dolor, priapismo, fibrosis quística, esclerosis lateral amiotrófica, esquizofrenia, depresión, 45 síndrome premenstrual, ansiedad, adicción, dolor de cabeza, migraña, enfermedad de Huntington, epilepsia, trastornos neurodegenerativos, trastornos de la motilidad gastrointestinal, obesidad, hiperfagia, tumores sólidos, malaria, cánceres hematológicos, miofibrosis, lesión pulmonar, enfermedad de injerto contra huésped, lesión en la cabeza, traumatismo del SNC, hepatitis, fallo renal, enfermedad hepática, lesión pulmonar inducida por fármacos, miastenia grave (MG), enfermedades oftálmicas, post angioplastia, restenosis, angina, o enfermedad arterial coronaria, en concreto donde 50 dicha artritis sea artritis reumatoide u osteoartritis, y/o dicho dolor sea dolor crónico o dolor postoperatorio.
Patentes similares o relacionadas:
 INHIBIDORES DUALES ANTITROMBÓTICOS ANTICOAGULANTES QUE COMPRENDEN UNA MARCA DE BIOTINA, del 27 de Junio de 2011, de N. V. ORGANON: Un compuesto antitrombótico de fórmula I oligosacárido-espaciador-antagonista de GpIIb/IIIa (I), donde el oligosacárido es un residuo de pentasacárido cargado […]
INHIBIDORES DUALES ANTITROMBÓTICOS ANTICOAGULANTES QUE COMPRENDEN UNA MARCA DE BIOTINA, del 27 de Junio de 2011, de N. V. ORGANON: Un compuesto antitrombótico de fórmula I oligosacárido-espaciador-antagonista de GpIIb/IIIa (I), donde el oligosacárido es un residuo de pentasacárido cargado […]
 MOLECULAS BIFUNCIONALES Y TERAPIAS BASADAS EN LAS MISMAS, del 22 de Octubre de 2010, de THE BOARD OF TRUSTEES OF THE LELAND STANFORD JUNIOR UNIVERSITY: Molécula bifuncional de origen no natural de menos de aproximadamente 5000 dalton que consiste en un resto de fármaco y un ligando de proteína presentadora, […]
MOLECULAS BIFUNCIONALES Y TERAPIAS BASADAS EN LAS MISMAS, del 22 de Octubre de 2010, de THE BOARD OF TRUSTEES OF THE LELAND STANFORD JUNIOR UNIVERSITY: Molécula bifuncional de origen no natural de menos de aproximadamente 5000 dalton que consiste en un resto de fármaco y un ligando de proteína presentadora, […]
 COMPUESTOS UNIDOS A UN CALIXARENO QUE SE UNEN A FACTORES DE CRECIMIENTO, del 27 de Mayo de 2010, de UNIVERSITY OF SOUTH FLORIDA
YALE UNIVERSITY: Compuesto que se une a un factor de crecimiento según la estructura calixarénica (I):
COMPUESTOS UNIDOS A UN CALIXARENO QUE SE UNEN A FACTORES DE CRECIMIENTO, del 27 de Mayo de 2010, de UNIVERSITY OF SOUTH FLORIDA
YALE UNIVERSITY: Compuesto que se une a un factor de crecimiento según la estructura calixarénica (I):
USO DE CONJUGADOS DE ACIDO BILIAR O SAL BILIAR CON ACIDO GRASO, del 19 de Noviembre de 2009, de GALMED INTERNATIONAL LTD.: Un conjugado de ácido biliar o sal biliar con ácido graso de fórmula general II W- X - G en la que G es un radical de ácido biliar o sal biliar, que, si se desea, está conjugado […]
 TERAPIA CON PROFARMACO ENZIMATICO PARA LA REPARACION DE UNA ARTICULACION PROSTETICA, del 22 de Junio de 2010, de INNOVATA LIMITED
ACADEMISCH ZIEKENHUIS LEIDEN: Uso de un producto que comprende una combinación de:
a)al menos un vector, que comprende un polinucleótido aislado que codifica una enzima capaz […]
TERAPIA CON PROFARMACO ENZIMATICO PARA LA REPARACION DE UNA ARTICULACION PROSTETICA, del 22 de Junio de 2010, de INNOVATA LIMITED
ACADEMISCH ZIEKENHUIS LEIDEN: Uso de un producto que comprende una combinación de:
a)al menos un vector, que comprende un polinucleótido aislado que codifica una enzima capaz […]
 METODO DE TRATAMIENTO QUE UTILIZA CONJUGADOS LIGANDO-INMUNOGENO, del 6 de Mayo de 2010, de PURDUE RESEARCH FOUNDATION: Composición farmacéutica en una forma de dosificación parenteral que comprende cantidades terapéuticamente eficaces de un conjugado ligando-inmunógeno, en el que […]
METODO DE TRATAMIENTO QUE UTILIZA CONJUGADOS LIGANDO-INMUNOGENO, del 6 de Mayo de 2010, de PURDUE RESEARCH FOUNDATION: Composición farmacéutica en una forma de dosificación parenteral que comprende cantidades terapéuticamente eficaces de un conjugado ligando-inmunógeno, en el que […]
PROFARMACOS CONJUGADOS DE ANALOGOS DE CC-1065, del 2 de Noviembre de 2010, de IMMUNOGEN, INC.: Un profármaco que comprende un análogo de un fármaco citotóxico que contiene seco-ciclopropabenzoindol seleccionado entre el grupo que consiste 5 en análogos […]
Derivativos del ácido siálico para la derivatización y conjugación de proteínas, del 20 de Diciembre de 2019, de LIPOXEN TECHNOLOGIES LIMITED: Un procedimiento de producción de un derivativo aldehído de un ácido siálico en el que un material de partida que tiene una unidad de ácido siálico en el […]