COMPOSICIONES FARMACEUTICAS DE VALATOGRAST Y PROCESO PARA SU PREPARACION.
Una composición en una forma de dosificación unitaria que contiene
a) de 50 mg a 400 mg del clorhidrato del éster 2-(dietilamino)etílico de la N-(2-cloro-6-metilbenzoil)-4-[(2,
6-diclorobenzoil)amino]-L-fenilalanina y en una base de % en peso b) del 5 al 40% de poloxámero 188, c) del 0 al 20% de ProSolv® SMCC50 y d) del 0% al 60% de lactosa anhidra
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2007/050144.
Solicitante: F. HOFFMANN-LA ROCHE AG.
Nacionalidad solicitante: Suiza.
Dirección: GRENZACHERSTRASSE 124,4070 BASEL.
Inventor/es: SHAH, NAVNIT, HARGOVINDAS, SANDHU, HARPREET K., CHATTERJI,ASHISH.
Fecha de Publicación: .
Fecha Concesión Europea: 31 de Marzo de 2010.
Clasificación Internacional de Patentes:
- A61K31/223 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › de alfa aminoácidos.
- A61K9/16H4B
- A61K9/16H6D
- A61K9/16H6F
- A61K9/20H4B
- A61K9/20H6D
- A61K9/20H6F2
- A61K9/50H4
- A61K9/50H6D
- A61K9/50H6F2
Clasificación PCT:
- A61K31/223 A61K 31/00 […] › de alfa aminoácidos.
- A61K9/00 A61K […] › Preparaciones medicinales caracterizadas por un aspecto particular.
- A61K9/16 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Aglomerados; Granulados; Microbolitas.
- A61K9/20 A61K 9/00 […] › Píldoras, pastillas o comprimidos.
- A61K9/50 A61K 9/00 […] › Microcápsulas (A61K 9/52 tiene prioridad).
Fragmento de la descripción:
Composiciones farmacéuticas de valatograst y proceso para su preparación.
La presente invención se refiere a una nueva formulación que, como ingrediente activo, tiene la sal clorhidrato del éster 2-(dietilamino)etilo de la N-(2-cloro-6-metilbenzoil)-4-[(2,6-diclorobenzoil)amino]-L-fenilalanina, que a continuación se llamará R411. El R411 tiene actividad en el tratamiento del asma.
El R411 está disponible en forma cristalina y tiene propiedades físico-químicas dependientes del Ph en el intervalo fisiológico, es decir, la solubilidad, la estabilidad y la permeabilidad.
Además del efecto del Ph, la solubilidad del R411 depende también del tipo y concentración del contra-ion.
El R411, que tiene un enlace éster, es también propenso a la hidrólisis básica (a Ph>6). Las propiedades físico-químicas dependientes del Ph y una permeabilidad limitada (58x10-6 cm2/s) hacen que este compuesto tenga una biodisponibilidad oral baja y variable. La biodisponibilidad en diversas especies animales se sitúa entre el 6% (en monos) y el 20% (en ratas y perros).
Las bases débiles con propiedades físico-químicas dependientes del Ph plantean retos únicos a los científicos formuladores. En el caso de fármacos con solubilidad y biodisponibilidad limitadas por la velocidad de disolución, el reto puede ser significativo. Las estrategias generales aplicadas para mejorar la biodisponibilidad incluyen la reducción del tamaño de partícula del fármaco, el uso de codisolventes y complejantes, la dispersión de fármaco en matrices hidrófilas, el uso de sistemas de entrega de fármaco de base lípida, por ejemplo los sistemas de autoemulsión del fármaco, las microemulsiones, los sistemas micelares, la dispersión sólida y la dispersión molecular, y se han descrito en varios artículos y patentes de la bibliografía técnica, p.ej., Choi y col., Drug Dev. Ind. Pharm., vol. 29(10), 1085-1094, 2003; Yueksel y col., Eur. J. Pharm. and Biopharm., vol. 56(3), 453-459, 2003 y la patente US 6,632,455.
El reto de biodisponibilidad que plantea el R411 se debe no solo a su baja solubilidad, sino también a su estabilidad limitada en los jugos gastrointestinales. Por lo tanto, se requieren ensayos de formulación que permitan soslayar ambos problemas. En la bibliografía técnica se ha documento el uso de poloxámeros para mejorar la biodisponibilidad basadas en una mejor solubilidad (Reddy y col., J. Pharm. Sci, vol. 65, 115-118 y 1753-1758, 1976 y Geneidi y col., Pharm. Ind., 42, 315, 1980). No obstante, en la bibliografía técnica no se menciona que el poloxámero puede mejorar la biodisponibilidad a pesar de la disolución más lenta. Tampoco se menciona su efecto en la estabilidad química del fármaco o la mejora que el fármaco pueda producir en el perfil de efectos en los alimentos. Estos hallazgos forman la base de nuestra invención.
Se describe el uso de desecantes internos para mejorar la estabilidad de los fármacos sensibles a la humedad. Las isotermas de adsorción-desorción de la lactosa anhidra indican que esta forma de lactosa tiene tendencia a absorber humedad cuando la concentración de esta última es elevada. Debido a esta atracción de humedad se considera que la lactosa anhidra no es favorable para formular fármacos sensibles a la humedad (Patel y col., Int. J. Pharm., vol. 264, 35-43, Is: 1-2, 2003 y Eur, J. Pharm. and Biopharm., vol. 46, 177-182, Is: 2, 1998). Contrariamente a los datos de la bibliografía técnica, la inclusión de lactosa anhidra en la formulación del R411 ha demostrado ser beneficiosa para la inestabilidad en la interviene la humedad.
El uso del ProSolv como auxiliar de compresión es bien aceptado. Igualmente se ha aceptado su superioridad sobre la mezcla física de sus componentes individuales, celulosa microcristalina y dióxido de silicio coloidal (Drug Dev. Ind. Pharm., vol. 30, 103-109, Is: 1, 2004). Sin embargo, su capacidad de influir en la estabilidad de la disolución, especialmente de modo favorable, es un hallazgo sorprendente y se considera otra mejora en la formula- ción.
Finalmente se incluye también el uso de un método de procesado. Las mezclas del poloxámero R411 pueden procesarse de varias maneras. Sin embargo, para sacar el máximo provecho de su perspectiva de biodisponibilidad es preferida la mezcla íntima por métodos tales como la granulación de masa fundida y la extrusión de masa fundida. La utilidad de varias de estas técnicas se ha descrito en la bibliografía técnica. Se ha documentado también su superioridad con respecto a otros métodos de granulación para productos sensibles a la humedad (Passerini y col., Eur. J. Pharm. Sci., vol. 15, 71-78, Is: 1, 2002). Sin embargo, la bibliografía técnica limita su ventaja solamente a la estabilidad química inicial, mientras que en el caso de la formulación del R411, su ventaja se observa durante un período prolongado de tiempo en forma de estabilidad de disolución, que no es obvia.
La presente invención proporciona una composición farmacéutica, en forma de dosificación oral, del R411 con mejores características farmacocinéticas, es decir, mayor biodisponibilidad y efecto reducido sobre el alimento. La composición contiene de 50 mg a 400 mg de R411 en una dosificación unitaria junto con el poloxámero 188 (Lutrol® F68) fabricado por métodos de granulación de masa fundida o de extrusión de masa fundida. Se ha descrito también el uso de excipientes secundarios, tales como el ProSolv® SMCC50 y la lactosa anhidra para mejorar la estabi- lidad.
La presente invención proporciona una composición farmacéutica para la administración oral del R411 que contiene de 50 mg a 400 mg de R411, y del 5 al 40% de poloxámero 188, del 1 al 20% de ProSolv® SMCC50 y del 20 al 60% de lactosa anhidra, porcentajes referidos al peso.
Una composición preferida contiene 300-400 mg de R411, del 10 al 25% de poloxámero 188, del 2 al 4% ProSolv® SMCC50 y del 30 al 50% de lactosa anhidra.
Una composición especialmente preferida en los que respecta a los excipientes clave se presenta seguidamente:

Pueden añadirse otros excipientes, tales como desintegrantes, lubricantes y cargas de relleno, si fueran necesarios, para mejorar la fabricación y/o propiedades de la forma de dosificación, que ya son conocidos de la técnica anterior. El poloxámero 188 (Lutrol® F68) es copolímero de bloques de óxido de etileno y óxido de propileno y figura en la lista de la monografía NF como poloxámero 188. Los poloxámeros están disponibles en un amplio intervalo de pesos moleculares, puntos de fusión y carácter hidrófilo y se utilizan habitualmente en las formulaciones farmacéuticas como agentes humectantes para mejorar la biodisponibilidad. Los suministra la empresa BASF (NJ, USA). El Lutrol® F68empleado en esta invención tiene un peso molecular en torno a 8400 daltones, punto de fusión de 52º-54ºC, un equilibrio hidrófilo-lipófilo (HLB, hidrophilic-lipophilic balance) de 18-29 y un tamaño medio de partícula comprendido entre 1 micra y 500 micras. Su utilización con el R411 en la formulación proporciona una situación única, ya que proporciona una matriz de disolución más lenta que la tableta convencional y a pesar de ello proporciona una biodisponibilidad mayor que un fármaco que tiene una solubilidad y estabilidad desfavorables en el intestino pequeño. Además, esta composición farmacéutica minimiza el efecto de la comida en las propiedades farmacocinéticas del producto. La forma física preferida del poloxámero 188 es un material dividido en partículas finas, con el fin de lograr una mezcla íntima. Los demás tensioactivos no iónicos que son una opción secundaria son el TPGS de la vitamina E (Eastman Kodak), Gelucire 44/14, Gelucire 50/13 (Gattefosse, NJ), Solutol HS15, poloxámero 407, poloxámero 338, Lutrol F77, Cremophor RH40 (BASF, NJ), dipalmitato de sucrosa y diestearato de sucrosa (Croda, NJ).
La lactosa anhidra se suministra en las empresas Cary Biosciences (IL, USA) o DMV International (Holanda). Se utiliza habitualmente como carga de relleno, auxiliar de compresión y vehículo de principios farmacéuticamente activos. Debido a su carácter higroscópico, no se recomienda para el uso en materiales sensibles a la humedad, sin embargo, en este caso concreto, su carácter higroscópico imparte una mejor estabilidad a la disolución, puesto que actúa como capturador de humedad.
El ProSolv® SMCC es un excipiente...
Reivindicaciones:
1. Una composición en una forma de dosificación unitaria que contiene
a) de 50 mg a 400 mg del clorhidrato del éster 2-(dietilamino)etílico de la N-(2-cloro-6-metilbenzoil)-4-[(2,6-diclorobenzoil)amino]-L-fenilalanina y en una base de % en peso b) del 5 al 40% de poloxámero 188, c) del 0 al 20% de ProSolv® SMCC50 y d) del 0% al 60% de lactosa anhidra.
2. La composición de la reivindicación 1 que contiene a) de 300 l 400 mg de clorhidrato del éster 2-(dietilamino)etílico de la N-(2-cloro-6-metilbenzoil)-4-[(2,6-diclorobenzoil)amino]-L-fenilalanina, b) del 10 al 25% de poloxámero 188, c) del 2 al 4% de ProSolv® SMCC50 y d) del 30 al 50% de lactosa anhidra.
3. La composición de la reivindicación 1, dicha composición se fabrica por un proceso de granulación de masa fundida caliente o por un proceso de extrusión de masa fundida caliente.
4. Una tableta recubierta con una película, que tiene una composición que consta de

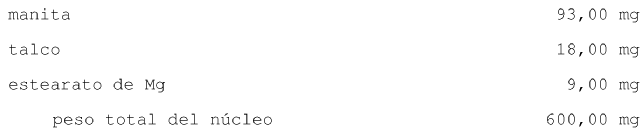
5. Una tableta recubierta con una película, que tiene una composición que consta de

6. Una composición que contiene


7. Una composición que contiene

8. Una composición que contiene

Patentes similares o relacionadas:
Composiciones para tratar drogadicción y mejorar el comportamiento relacionado con la adicción, del 30 de Octubre de 2019, de SK Biopharmaceuticals Co., Ltd: Una composición para uso en el tratamiento de una drogadicción que comprende una cantidad terapéuticamente eficaz de un compuesto de carbamato, o una sal o éster […]
Métodos para tratar el síndrome de fibromialgia, del 22 de Mayo de 2019, de SK Biopharmaceuticals Co., Ltd: Compuesto que tiene la fórmula estructural o sal farmacéuticamente aceptable del mismo para su uso en el tratamiento de síntomas asociados con síndrome de fibromialgia […]
Compuestos para tratar el bloqueo de la remielinización en enfermedades asociadas con la expresión de la proteína de envoltura HERV-W, del 26 de Abril de 2019, de Geneuro SA: Una composición farmacéutica que comprende al menos un ligando anti-Env de MSRV/HERV-W y al menos un fármaco inhibitorio de radicales de Óxido Nítrico, […]
COMPUESTOS CON PROPIEDADES TERAPÉUTICAS Y SU MÉTODO DE PRODUCCIÓN, del 17 de Abril de 2019, de MARCOS CONTRERAS, María Luisa: Compuestos con propiedades terapéuticas y su método de producción. Esta invención se refiere a compuestos de estructura A con propiedades antioxidantes, antiinflamatorias, […]
Transferrina para su utilización en el tratamiento de trastornos neurodegenerativos asociados al factor inducible por hipoxia (HIF), del 12 de Diciembre de 2018, de GRIFOLS WORLDWIDE OPERATIONS LIMITED: Composición que comprende una mezcla de apotransferrina (ApoTf) y holotransferrina (HoloTf) para su utilización en el tratamiento de un trastorno […]
Teobromina en combinación con un expectorante o oun mucolítico para uso en terapia, del 21 de Marzo de 2018, de InFirst Healthcare Limited: Un agente que consiste en teobromina y guaifenesina como agentes activos para uso como una preparación combinada en terapia para tos.
Compuestos de carbamato para el tratamiento del trastorno bipolar, del 4 de Octubre de 2017, de SK Biopharmaceuticals Co., Ltd: Una composición farmacéutica para su uso en el tratamiento de un episodio depresivo y un episodio maníaco del trastorno bipolar o para disminuir, inhibir o eliminar los síntomas […]
Composición farmacéutica que comprende (1R,4R)-6''-fluor-N,N-dimetil-4-fenil-4'',9''-dihidro-3''H-espiro[ciclohexano-1,1''-pirano-[3,4,b]indol]-4-amina y paracetamol o propacetamol, del 13 de Septiembre de 2017, de GRUNENTHAL GMBH: Composición farmacéutica que comprende: (a) un primer ingrediente farmacológicamente activo seleccionado entre el compuesto según la fórmula general (I) […]