AGONISTAS DE APOLIPOPROTEINA A-I Y SU USO PARA TRATAR TRASTORNOS DE DISLIPIDEMIA.
Un agonista de ApoA-I multimérico que presenta al menos aproximadamente 38% de activación de LCAT comparado con ApoA-I humana y que tiene la fórmula (III) estructural:
X-Nya-X(ya-1)-(Nyb-X(yb-1))p (III) o una sal farmacéuticamente aceptable del mismo, en la que: cada x es independientemente HH-(LLm-HH)-nLLm-HH; cada HH es independientemente un péptido o análogo de péptido que comprende: (i) un péptido o análogo de péptido de 15 a 29 residuos que forma una hélice anfipática en presencia de lípidos y que comprende la fórmula (I) estructural: Z1-X1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-X12-X13-X14-X15-X16-X17-X18-X19-X20-X21-X22-X23-Z2 o una sal farmacéuticamente aceptable del mismo, en la que: X1 es Pro (P), Ala (A), Gly (G), Gln (Q), Asn (N), Asp (D) o D-Pro (p); X2 es un residuo alifático; X3 es Leu (L) o Phe (F); X4 es un residuo ácido; X5 es Leu (L) o Phe (F); X6 es Leu (L) o Phe (F); X7 es un residuo hidrófilo; X8 es un residuo ácido o básico; X9 es Leu (L) o Gly (G); X10 es Leu (L), Trp (W) o Gly (G); X11 es un residuo hidrófilo; X12 es un residuo hidrófilo; X13 es Gly (G) o un residuo alifático; X14 es Leu (L), Trp (W), Gly (G) o Nal; X15 es un residuo hidrófilo; X16 es un residuo hidrófobo; X17 es un residuo hidrófobo; X18 es Gln (Q), Asn (N) o un residuo básico; X19 es Gln (Q), Asn (N) o un residuo básico; X20 es un residuo básico; X21 es un residuo alifático; X22 es un residuo básico; X23 está ausente o es un residuo básico; Z1 es H2N- o RC(O)NH-; Z2 es -C(O)NRR, -C(O)OR o -C(O)OH o una sal del mismo; cada R es independientemente -H, alquilo (C1-C6), alquenilo (C1-C6), alquinilo (C1-C6), arilo (C5-C20), alcarilo (C6-C26), heteroarilo de 5-20 miembros, alq-heteroarilo de 6-26 miembros, o un péptido o análogo de péptido de 1 a 7 residuos; cada "-" entre los residuos Xn designa independientemente un enlace amida, un enlace amida sustituido, un isóstero de una amida o un mimético de amida; o (ii) una forma delecionada de la fórmula (I) estructural en la que al menos uno y hasta ocho de los residuos X1, X2, X3, X4, X5, X6, X7, X8, X9, X10, X11, X12, X13, X14, X15, X16, X17, X18, X19, X20, X21 y X22 están delecionados; o (iii) una forma alterada de la fórmula (I) estructural en la que al menos uno de los residuos X1, X2, X3, X4, X5, X6, X7, X8, X9, X10, X11, X12, X13, X14, X15, X16, X17, X18, X19, X20, X21, X22 o X23 está sustituido de manera conservativa por otro residuo; cada LL es independientemente un ligador bifuncional; cada m es independientemente un número entero desde 0 hasta 1; cada n es independientemente un número entero desde 0 hasta 8; Nya y Nyb son cada uno independientemente un resto de unión multifuncional en los que ya e yb representan el número de grupos funcionales en Nya y Nyb, respectivamente; cada ya o yb es independientemente un número entero desde 3 hasta 8; p es un número entero desde 0 hasta 7; y cada "-" designa independientemente un enlace covalente
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E06018390.
Solicitante: DASSEUX, JEAN-LOUIS
SEKUL, RENATE
BUTTNER, KLAUS
CORNUT, ISABELLE
METZ, GUNTHER
DUFOURCQ, JEAN.
Nacionalidad solicitante: Francia.
Dirección: 7 CHEMIN DE VENTENAC,31130 VIELLE-TOULOUSE.
Inventor/es: DASSEUX, JEAN-LOUIS, SEKUL, RENATE, BUTTNER, KLAUS, CORNUT, ISABELLE, METZ, GUNTHER, DUFOURCQ, JEAN.
Fecha de Publicación: .
Fecha Solicitud PCT: 28 de Septiembre de 1998.
Fecha Concesión Europea: 29 de Julio de 2009.
Clasificación Internacional de Patentes:
- C07K14/775 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Apolipopéptidos.
- C07K7/08A
Clasificación PCT:
- A61K38/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00).
- C07K14/00 C07K […] › Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados.
- C07K7/00 C07K […] › Péptidos con 5 a 20 aminoácidos en una secuencia totalmente determinada; Sus derivados.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Finlandia, Chipre.
Fragmento de la descripción:
Agonistas de apolipoproteína A-I y su uso para tratar trastornos de dislipidemia.
1. Introducción
La invención se refiere a composiciones de agonistas de la apolipoproteína A-I (ApoA-I) para tratar trastornos asociados con dislipoproteinemia, incluyendo hipercolesterolemia, enfermedad cardiovascular, aterosclerosis, reestenosis y otros trastornos tales como choque septicémico.
2. Antecedentes de la invención
El colesterol circulante se porta por lipoproteínas plasmáticas, partículas de composición compleja de lípido y proteína que transportan lípidos en la sangre. Las lipoproteínas de baja densidad (LDL) y las lipoproteínas de alta densidad (HDL) son los principales portadores de colesterol. Se cree que las LDL son responsables del envío de colesterol desde el hígado (en el que se sintetiza u obtiene de fuentes de la dieta) hasta tejidos extrahepáticos en el cuerpo. La expresión "transporte inverso de colesterol" describe el transporte de colesterol desde tejidos extrahepáticos hasta el hígado, en el que se cataboliza y elimina. Se cree que las partículas de HDL plasmáticas desempeñan un papel principal en el proceso de transporte inverso, actuando como eliminadores de colesterol tisular.
La evidencia que conecta un elevado colesterol sérico con la cardiopatía coronaria es abrumadora. Por ejemplo, la aterosclerosis es una enfermedad lentamente progresiva caracterizada por la acumulación de colesterol dentro de la pared arterial. Una evidencia convincente apoya el concepto de que los lípidos depositados en lesiones ateroscleróticas derivan principalmente de LDL plasmáticas; por tanto, las LDL se conocen popularmente como el colesterol "malo". En cambio, los niveles séricos de HDL se correlacionan de manera inversa con la cardiopatía coronaria, de hecho, elevados niveles séricos de HDL se consideran como un factor de riesgo negativo. Se supone que los niveles elevados de HDL plasmática no sólo protegen frente a la arteriopatía coronaria, si no que inducen realmente la regresión de las placas ateroscleróticas (por ejemplo, véase Badimon y otros, 1992, Circulation 86 (Supl. III): 86-94). Por tanto, las HDL se conocen popularmente como el colesterol "bueno".
2.1. Transporte de colesterol
El sistema de transporte de grasas puede dividirse en dos rutas: una exógena para el colesterol y los triglicéridos absorbidos a partir del intestino y una endógena para el colesterol y los triglicéridos que entran en el torrente circulatorio a partir del hígado y otros tejidos no hepáticos.
En la ruta exógena, las grasas de la dieta se empaquetan para dar partículas de lipoproteínas denominadas quilomicrones, que entran en el torrente circulatorio y envían sus triglicéridos hasta el tejido adiposo (para almacenamiento) y hasta el músculo (para su oxidación para suministrar energía). El resto de los quilomicrones, que contienen ésteres de colesterilo, se elimina de la circulación mediante un receptor específico que se encuentra sólo en células del hígado. Este colesterol está entonces disponible de nuevo para el metabolismo celular o para su reciclaje hasta tejidos extrahepáticos como lipoproteínas plasmáticas.
En la ruta endógena, el hígado secreta una partícula de lipoproteínas grande, de muy baja densidad (VLDL) en el torrente circulatorio. El núcleo de las VLDL consiste principalmente en triglicéridos sintetizados en el hígado, con una cantidad menor de ésteres de colesterilo (o bien sintetizados en el hígado o bien reciclados de los quilomicrones). Están presentes dos proteínas predominantes sobre la superficie de las VLDL, la apoproteína B-100 y la apoproteína E. Cuando una VLDL alcanza los capilares del tejido adiposo o del músculo, se extraen sus triglicéridos, dando como resultado un nuevo tipo de partícula, de tamaño disminuido y enriquecida en ésteres de colesterilo, pero que conserva sus dos apoproteínas, denominada lipoproteína de densidad intermedia (IDL).
En seres humanos, aproximadamente la mitad de las partículas de IDL se eliminan de la circulación rápidamente (en el plazo de seis horas de su formación), debido a que se unen fuertemente a las células hepáticas que extraen su colesterol para fabricar nuevas VLDL y ácidos biliares. Las partículas de IDL que no son captadas por el hígado permanecen en la circulación durante más tiempo. Con el tiempo, la apoproteína E se disocia de las partículas circulantes, convirtiéndolas en LDL que tienen la apoproteína B-100 como su única proteína.
Principalmente, el hígado capta y degrada la mayor parte del colesterol en ácidos biliares, que son los productos finales del metabolismo del colesterol. La captación de las partículas que contienen colesterol está mediada por receptores de LDL, que están presentes en elevadas concentraciones en los hepatocitos. El receptor de LDL se une tanto a la apoproteína E como a la apoproteína B-100, y es responsable de la unión y eliminación tanto de las IDL como de las LDL de la circulación. Sin embargo, la afinidad de la apoproteína E por el receptor de LDL es mayor que la de la apoproteína B-100. Como resultado, las partículas de LDL tienen una vida útil de circulación mucho más larga que las partículas de IDL -las LDL circulan durante un promedio de dos días y medio antes de su unión a los receptores de LDL en el hígado y otros tejidos-. Niveles séricos elevados de LDL (el colesterol "malo") están asociados de manera positiva con la cardiopatía coronaria. Por ejemplo, en la aterosclerosis, el colesterol derivado de LDL circulantes se acumula en las paredes de las arterias, lo que conduce a la formación de placas voluminosas que inhiben el flujo de sangre hasta que finalmente se forma un coágulo, obstruyendo la arteria provocando un infarto de miocardio o accidente cerebrovascular.
En última instancia, la cantidad de colesterol intracelular liberada de las LSL controla el metabolismo del colesterol celular. La acumulación de colesterol celular derivado de las VLDL y LDL controla tres procesos: en primer lugar, reduce la síntesis de colesterol celular desactivando la síntesis de la HMGCoA reductasa -una enzima clave en la ruta biosintética del colesterol-. En segundo lugar, el colesterol derivado de LDL entrante promueve el almacenamiento de colesterol activando la ACAT -la enzima celular que convierte el colesterol en ésteres de colesterilo que se depositan en gotitas de almacenamiento-. En tercer lugar, la acumulación de colesterol dentro de la célula dirige un mecanismo de retroalimentación que inhibe la síntesis celular de nuevos receptores de LDL. Las células, por tanto, ajustan su complemento de receptores de LDL de modo que introducen suficiente colesterol para cumplir sus necesidades metabólicas, sin sobrecarga. (Para una revisión, véase Brown & Goldstein, In, The Pharmacological Basis Of Therapeutics, 8ª ed., Goodman & Gilman, Pergamon Press, NY, 1990, Cap. 36, págs. 874-896).
2.2. Transporte inverso de colesterol
En resumen, las células periféricas (no hepáticas) obtienen su colesterol a partir de una combinación de síntesis local y la captación de esterol preformado de las VLDL y LDL. En cambio, el transporte inverso de colesterol (TIC) es la ruta mediante la cual el colesterol de células periféricas puede devolverse al hígado para su reciclaje hasta tejidos extrahepáticos, o su excreción en el intestino en la bilis, o bien en forma modificada o bien oxidada como ácidos biliares. La ruta del TIC representa el único medio de eliminar colesterol de la mayoría de los tejidos extrahepáticos, y es crucial para mantener la estructura y función de la mayoría de las células en el cuerpo.
El TIC consiste principalmente en tres etapas: (a) salida de colesterol, la eliminación inicial del colesterol a partir de diversos grupos de células periféricas; (b) esterificación del colesterol mediante la acción de la lecitina:colesterol acetiltransferasa (LCAT), impidiendo una reentrada del colesterol que ha salido en las células; y (c) captación/envío del éster de colesterilo-HDL hasta las células hepáticas. La ruta del TIC está mediada por las HDL. HDL es un término genérico para partículas de lipoproteínas que se caracterizan por su alta densidad. Los constituyentes lipídicos principales de los complejos de HDL son diversos fosfolípidos, colesterol (éster) y triglicéridos. Los componentes de apolipoproteína más destacados son A-I y A-II, que determinan las características funcionales de las HDL; además se han observado cantidades menores de apoliproteína C-I, C-II, C-III, D, E, J, etc. Las HDL pueden existir en...
Reivindicaciones:
1. Un agonista de ApoA-I multimérico que presenta al menos aproximadamente 38% de activación de LCAT comparado con ApoA-I humana y que tiene la fórmula (III) estructural:
o una sal farmacéuticamente aceptable del mismo, en la que:
cada x es independientemente HH-(LLm-HH)-nLLm-HH;
cada HH es independientemente un péptido o análogo de péptido que
comprende:
(i) un péptido o análogo de péptido de 15 a 29 residuos que forma una hélice a anfipática en presencia de lípidos y que comprende la fórmula (I) estructural:
o una sal farmacéuticamente aceptable del mismo, en la que:
X1 es Pro (P), Ala (A), Gly (G), Gln (Q), Asn (N), Asp (D) o D-Pro (p);
X2 es un residuo alifático;
X3 es Leu (L) o Phe (F);
X4 es un residuo ácido;
X5 es Leu (L) o Phe (F);
X6 es Leu (L) o Phe (F);
X7 es un residuo hidrófilo;
X8 es un residuo ácido o básico;
X9 es Leu (L) o Gly (G);
X10 es Leu (L), Trp (W) o Gly (G);
X11 es un residuo hidrófilo;
X12 es un residuo hidrófilo;
X13 es Gly (G) o un residuo alifático;
X14 es Leu (L), Trp (W), Gly (G) o Nal;
X15 es un residuo hidrófilo;
X16 es un residuo hidrófobo;
X17 es un residuo hidrófobo;
X18 es Gln (Q), Asn (N) o un residuo básico;
X19 es Gln (Q), Asn (N) o un residuo básico;
X20 es un residuo básico;
X21 es un residuo alifático;
X22 es un residuo básico;
X23 está ausente o es un residuo básico;
Z1 es H2N- o RC(O)NH-;
Z2 es -C(O)NRR, -C(O)OR o -C(O)OH o una sal del mismo;
cada R es independientemente -H, alquilo (C1-C6), alquenilo (C1-C6), alquinilo (C1-C6), arilo (C5-C20), alcarilo (C6-C26), heteroarilo de 5-20 miembros, alq-heteroarilo de 6-26 miembros, o un péptido o análogo de péptido de 1 a 7 residuos;
cada "-" entre los residuos Xn designa independientemente un enlace amida, un enlace amida sustituido, un isóstero de una amida o un mimético de amida; o
(ii) una forma delecionada de la fórmula (I) estructural en la que al menos uno y hasta ocho de los residuos X1, X2, X3, X4, X5, X6, X7, X8, X9, X10, X11, X12, X13, X14, X15, X16, X17, X18, X19, X20, X21 y X22 están delecionados; o
(iii) una forma alterada de la fórmula (I) estructural en la que al menos uno de los residuos X1, X2, X3, X4, X5, X6, X7, X8, X9, X10, X11, X12, X13, X14, X15, X16, X17, X18, X19, X20, X21, X22 o X23 está sustituido de manera conservativa por otro residuo;
cada LL es independientemente un ligador bifuncional;
cada m es independientemente un número entero desde 0 hasta 1;
cada n es independientemente un número entero desde 0 hasta 8;
Nya y Nyb son cada uno independientemente un resto de unión multifuncional en los que ya e yb representan el número de grupos funcionales en Nya y Nyb, respectivamente;
cada ya o yb es independientemente un número entero desde 3 hasta 8;
p es un número entero desde 0 hasta 7; y
cada "-" designa independientemente un enlace covalente.
2. El agonista de ApoA-I multimérico de la reivindicación 1 que tiene la fórmula estructural (IV) o (V):
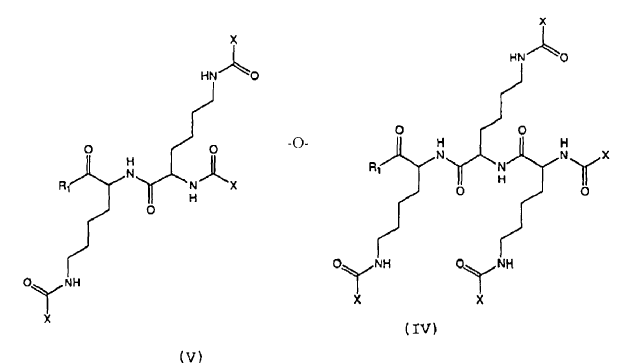
o una sal farmacéuticamente aceptable del mismo, en el que:
cada X es como se define en la reivindicación 1;
R1 es -OR o -NRR; y
cada R es independientemente -H, alquilo (C1-C6), alquenilo (C1-C6), alquinilo (C1-C6); arilo (C5-C20) alcarilo (C6-C26), heteroarilo de 5-20 miembros o alqheteroarilo de 6-26 miembros.
3. El agonista de ApoA-I multimérico de la reivindicación 1 ó 2 en el que el ligador bifuncional es escindible.
4. El agonista multimérico de ApoA-I de la reivindicación 1 ó 2 en el que n es 0.
5. El agonista de ApoA-I multimérico de la reivindicación 4 en el que m es 0.
6. El agonista multimérico de ApoA-I de la reivindicación 1 ó 2 en el que cada HH es independientemente un péptido de 22-23 residuos o un análogo peptídico de fórmula estructural (I), en el que el "-" entre residuos designa -C(O)NH-;
Z1 es H2N-; y
Z2 es -C(O)OR o una sal del mismo.
7. El agonista de ApoA-I multimérico de la reivindicación 1 ó 2 en el que cada HH es independientemente un péptido de 22-23 residuos o un análogo peptídico de fórmula estructural (I), en el que el "-" entre residuos designa -C(O)NH-;
Z1 es H2N-; y
Z2 es -C(O)OR o una sal del mismo; y
X1 es Pro (P), Ala (A), Gly (G), Gln (Q), Asn (N), Asp (D) o D-Pro (p);
X2 es Ala (A), Val (V) o Leu (L);
X3 es Leu (L) o Phe (F);
X4 es Asp (D) o Glu (E);
X5 es Leu (L) o Phe (F);
X6 es Leu (L) o Phe (F);
X7 es Lys (K), Arg (R) u Orn;
X8 es Asp (D) o Gly (E);
X9 es Leu (L) o Gly (G);
X10 es Leu (L), Trp (W) o Gly (G);
X11 es Asn (N) o Gln (Q);
X12 es Glu (E) o Asp (D);
X13 es Leu (L), Gly (G) o Aib;
X14 es Leu, Nal, Trp (W) o Gly (G);
X15 es Asp (D) o Glu (E);
X16 es Ala (A), Nal, Trp (W), Leu (L), Phe (F) o Gly (G);
X17 es Leu (L), Gly (G) o Nal;
X18 es Gln (Q), Asn (N), Lys (K) u Orn;
X19 es Gln (Q), Asn (N), Lys (K) u Orn;
X20 es Lys (K) u Orn;
X21 es Leu (L);
X22 es Lys (K) u Orn; y
X23 está ausente o es Lys (K).
8. El agonista de ApoA-I multimérico de la reivindicación 1 ó 2 en el que cada HH es independientemente un péptido seleccionado del grupo constituido por:
| péptido 1 | PVLDLFRELLNELLEZLKQKLK | (SEQ ID NO:1) |
| péptido 2 | GVLDLFRELLNELLEALKQKLKK | (SEQ ID NO:2) |
| péptido 3 | PVLDLFRELLNELLEWLKQKLK | (SEQ ID NO:3) |
| péptido 4 | PVLDLFRELLNELLEALKQKLK | (SEQ ID NO:4) |
| péptido 5 | pVLDLFRELLNELLEALKQKLKK | (SEQ ID NO:5) |
| péptido 6 | PVLDLFRELLNEXLEALKQKLK | (SEQ ID NO:6) |
| péptido 7 | PVLDLFKELLNELLEALKQKLK | (SEQ ID NO:7) |
| péptido 8 | PVLDLFRELLNEGLEALKQKLK | (SEQ ID NO:8) |
| péptido 9 | PVLDLFRELGNELLEALKQKLK | (SEQ ID NO:9) |
| péptido 10 | PVLDLFRELLNELLEAZKQKLK | (SEQ ID NO:10) |
| péptido 11 | PVLDLFKELLQELLEALKQKLK | (SEQ ID NO:11) |
| péptido 12 | PVLDLFRELLNELLEAGKQKLK | (SEQ ID NO:12) |
| péptido 13 | GVLDLFRELLNEGLEALKQKLK | (SEQ ID NO:13) |
| péptido 14 | PVLDLFRELLNELLEALOQOLO | (SEQ ID NO:14) |
| péptido 15 | PVLDLFRELWNELLEALKQKLK | (SEQ ID NO:15) |
| péptido 16 | PVLDLLRELLNELLEALKQKLK | (SEQ ID NO:16) |
| péptido 17 | PVLELFKELLQELLEALKQKLK | (SEQ ID NO:17) |
| péptido 18 | GVLDLFRELLNELLEALKQKLK | (SEQ ID NO:18) |
| péptido 19 | pVLDLFRELLNEGLEALKQKLK | (SEQ ID NO:19) |
| péptido 20 | PVLDLFREGLNELLEALKQKLK | (SEQ ID NO: 20) |
| péptido 21 | pVLDLFRELLNELLEALKQKLK | (SEQ ID NO:21) |
| péptido 22 | PVLDLFRELLNELLEGLKQKLK | (SEQ ID NO:22) |
| péptido 23 | PLLELFKELLQELLEALKQKLK | (SEQ ID NO:23) |
| péptido 24 | PVLDLFRELLNELLEALQKKLK | (SEQ ID NO:24) |
| péptido 25 | PVLDFFRELLNEXLEALKQKLK | (SEQ ID NO:25) |
| péptido 26 | PVLDLFRELLNELLELLKQKLK | (SEQ ID NO:26) |
| péptido 27 | PVLDLFRELLNELZEALKQKLK | (SEQ ID NO:27) |
| péptido 28 | PVLDLFRELLNELWEALKQKLK | (SEQ ID NO:28) |
| péptido 29 | AVLDLFRELLNELLEALKQKLK | (SEQ ID NO:29) |
| péptido 123 | QVLDLFRELLNELLEALKQKLK | (SEQ ID NO:123) |
| péptido 124 | PVLDLFOELLNELLEALOQOLO | (SEQ ID NO:124) |
| péptido 125 | NVLDLFRELLNELLEALKQKLK | (SEQ ID NO:125) |
| péptido 126 | PVLDLFRELLNELGEALKQKLK | (SEQ ID NO:126) |
| péptido 127 | PVLDLFRELLNELLELLKQKLK | (SEQ ID NO:127) |
| péptido 128 | PVLDLFRELLNELLEFLKQKLK | (SEQ ID NO:128) |
| péptido 129 | PVLELFNDLLRELLEALQKKLK | (SEQ ID NO:129) |
| péptido 130 | PVLELFNDLLRELLEALKQKLK | (SEQ ID NO:130) |
| péptido 131 | PVLELFKELLNELLDALRQKLK | (SEQ ID NO:131) |
| péptido 132 | PVLDLFRELLENLLEALQKKLK | (SEQ ID NO:132) |
| péptido 133 | PVLELFERLLEDLLQALNKKLK | (SEQ ID NO:133) |
| péptido 134 | PVLELFERLLEDLLKALNQKLK | (SEQ ID NO:134) |
| péptido 135 | DVLDLFRELLNELLEALKQKLK | (SEQ ID NO:135) |
| péptido 136 | PALELFKDLLQELLEALKQKLK | (SEQ ID NO:136) |
| péptido 137 | PVLDLFRELLNEGLEAZKQKLK | (SEQ ID NO:137) |
| péptido 138 | PVLDLFRELLNEGLEWLKQKLK | (SEQ ID NO:138) |
| péptido 139 | PVLDLFRELWNEGLEALKQKLK | (SEQ ID NO:139) |
| péptido 140 | PVLDLFRELLNEGLEALOQOLO | (SEQ ID NO:140) |
| péptido 141 | PVLOFFRELLNEGLEALKQKLK | (SEQ ID NO:141) |
| péptido 142 | PVLELFRELLNEGLEALKQKLK | (SEQ ID NO:142) |
y las formas aciladas en el extremo N-terminal y/o amidadas o esterificadas en el extremo C-terminal de los mismos, en los que X es Aib; Z es Nal; y O es Orn.
9. Un complejo de agonista de ApoA-I-lípido que comprende un agonista de ApoA-I y un lípido, en el que el agonista de ApoA-I es un agonista de ApoA-I multimérico de acuerdo con la la reivindicación 1, o un agonista de ApoA-I multimérico de acuerdo con la reivindicación 2.
10. El complejo de agonista de ApoA-I-lípido de la reivindicación 9 en el que el lípido es esfingomielina.
11. El complejo de agonista de ApoA-I-lípido de la reivindicación 9 en la forma de un polvo liofilizado.
12. El complejo de agonista de ApoA-I-lípido de la reivindicación 9 que está en la forma de una solución.
13. Una composición farmacéutica que comprende un agonista de ApoA-I y un transportador, excipiente o diluyente farmacéuticamente aceptable, en el que el agonista de ApoA-I es un agonista de ApoA-I multimérico de acuerdo con la reivindicación 1, o un agonista de de ApoA-I multimérico de acuerdo con la reivindicación 2.
14. La composición farmacéutica de la reivindicación 13, en la que el agonista de ApoA-I está en la forma de un complejo de agonista de ApoA-I-lípido, comprendiendo dicho complejo el agonista de ApoA-I y un lípido.
15. La composición farmacéutica de la reivindicación 14 en la que el complejo de agonista de ApoA-I-lípido está en la forma de un polvo liofilizado.
Patentes similares o relacionadas:
Tratamiento de las enfermedades relacionadas con la apolipoproteína a1 por inhibición del transcrito antisentido natural a la apolipoproteína a1, del 17 de Octubre de 2019, de CuRNA, Inc: Un oligonucleótido que se dirige a un transcrito antisentido natural de apolipoproteína A1 para su uso como un compuesto terapéutico, donde el oligonucleótido […]
Método para concentrar péptidos APOA-I-miméticos expresados de manera transgénica en las plantas, del 7 de Agosto de 2019, de THE REGENTS OF THE UNIVERSITY OF CALIFORNIA: Un método para concentrar péptidos miméticos de apoA-I transgénicos expresados en una planta de tomate transgénica, comprendiendo dicho método: […]
 Miméticos de apolipoproteína y usos de los mismos, del 31 de Julio de 2019, de UAB RESEARCH FOUNDATION: Un péptido que mimetiza la apolipoproteína-E para el uso en el tratamiento de la arteriosclerosis, en donde el régimen de dosificación comprende al menos un ciclo de tratamiento […]
Miméticos de apolipoproteína y usos de los mismos, del 31 de Julio de 2019, de UAB RESEARCH FOUNDATION: Un péptido que mimetiza la apolipoproteína-E para el uso en el tratamiento de la arteriosclerosis, en donde el régimen de dosificación comprende al menos un ciclo de tratamiento […]
Complejos de lipoproteínas y fabricación y usos de los mismos, del 21 de Junio de 2019, de Cerenis Therapeutics Holding SA: Composición que comprende una población de complejos de lipoproteínas, comprendiendo cada una (a) una fracción lipídica que comprende al menos […]
Complejos de lipoproteínas y fabricación y usos de los mismos, del 12 de Junio de 2019, de Cerenis Therapeutics Holding SA: Procedimiento para preparar complejos de lipoproteínas, que comprende: (a) enfriar una suspensión de partida que comprende un componente lipídico y un componente […]
Modulación de enfermedad por ingeniería genética de plantas, del 8 de Mayo de 2019, de THE REGENTS OF THE UNIVERSITY OF CALIFORNIA: Una planta de tomate transgénica que comprende células que expresan un péptido del que uno o más dominios comprenden la secuencia de aminoácidos DWLKAFYDKFFEKFKEFF […]
Anticuerpos anti-clusterina y fragmentos de unión a antígeno y su uso para reducir el volumen tumoral, del 8 de Mayo de 2019, de ALETHIA BIOTHERAPEUTICS INC: Un anticuerpo humanizado o fragmento de unión a antígeno del mismo que puede unirse específicamente a clusterina, comprendiendo el anticuerpo […]
Formulación de lipoproteína de alta densidad reconstituida, del 16 de Enero de 2019, de CSL LIMITED: Una formulación de lipoproteína de alta densidad reconstituida (rHDL) que contiene una apolipoproteína, un lípido y un estabilizante de la liofilización, en la que la relación […]