ADZIMAS Y USOS DE LAS MISMAS.
Una proteína de fusión que comprende:
(a) un dominio catalítico de mesotripsina que cataliza la proteolisis de un sustrato diana;
y
(b) un resto que elige diana que se une al sustrato diana
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2005/006976.
Solicitante: BRISTOL-MYERS SQUIBB COMPANY.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: ROUTE 206 AND PROVINCE LINE ROAD,PRINCETON NJ 08543-4000.
Inventor/es: LEE, FRANK, D., WONG, GORDON, G., AFEYAN,NOUBAR,B, DAS GUPTA,RUCHIRA, BAYNES,BRIAN, CAMPHAUSEN,RAY.
Fecha de Publicación: .
Fecha Concesión Europea: 5 de Mayo de 2010.
Clasificación Internacional de Patentes:
- C12N15/62 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Secuencias de ADN que codifican proteínas de fusión.
- C12N9/76 C12N […] › C12N 9/00 Enzimas, p. ej. ligasas (6.); Proenzimas; Composiciones que las contienen (preparaciones para la limpieza de los dientes que contienen enzimas A61K 8/66, A61Q 11/00; preparaciones de uso médico que contienen enzimas A61K 38/43; composiciones detergentes que contienen enzimas C11D ); Procesos para preparar, activar, inhibir, separar o purificar enzimas. › Tripsina; Quimotripsina.
Clasificación PCT:
- A61K38/48 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › que actúan sobre enlaces peptídicos (3.4).
- C07K19/00 C […] › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › Péptidos híbridos (Inmoglobulinas híbridas compuestas solamente de inmoglobulinas C07K 16/46).
- C12N1/16 C12N […] › C12N 1/00 Microorganismos, p.ej. protozoos; Composiciones que los contienen (preparaciones de uso médico que contienen material de protozoos, bacterias o virus A61K 35/66, de algas A61K 36/02, de hongos A61K 36/06; preparación de composiciones de uso médico que contienen antígenos o anticuerpos bacterianos, p. ej. vacunas bacterianas, A61K 39/00 ); Procesos de cultivo o conservación de microorganismos, o de composiciones que los contienen; Procesos de preparación o aislamiento de una composición que contiene un microorganismo; Sus medios de cultivo. › Levaduras; Sus medios de cultivo.
- C12N1/20 C12N 1/00 […] › Bacterias; Sus medios de cultivo.
- C12N15/52 C12N 15/00 […] › Genes que codifican enzimas o proenzimas.
- C12N15/62 C12N 15/00 […] › Secuencias de ADN que codifican proteínas de fusión.
- C12N5/10 C12N […] › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › Células modificadas por introducción de material genético extraño, p. ej. células transformadas por virus.
- C12N9/76 C12N 9/00 […] › Tripsina; Quimotripsina.
Clasificación antigua:
- A61K38/48 A61K 38/00 […] › que actúan sobre enlaces peptídicos (3.4).
- C07K19/00 C07K […] › Péptidos híbridos (Inmoglobulinas híbridas compuestas solamente de inmoglobulinas C07K 16/46).
- C12N1/16 C12N 1/00 […] › Levaduras; Sus medios de cultivo.
- C12N1/20 C12N 1/00 […] › Bacterias; Sus medios de cultivo.
- C12N15/52 C12N 15/00 […] › Genes que codifican enzimas o proenzimas.
- C12N15/62 C12N 15/00 […] › Secuencias de ADN que codifican proteínas de fusión.
- C12N5/10 C12N 5/00 […] › Células modificadas por introducción de material genético extraño, p. ej. células transformadas por virus.
- C12N9/76 C12N 9/00 […] › Tripsina; Quimotripsina.
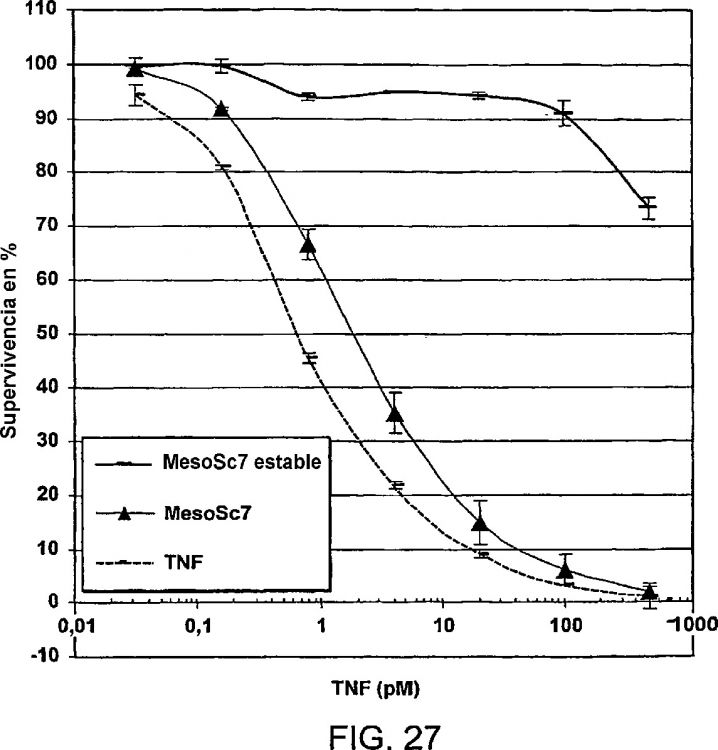
Fragmento de la descripción:
Adzimas y usos de las mismas.
Antecedentes de la invención
La presente invención se refiere a constructos de proteínas sintéticos útiles en la modulación de una variedad de moléculas elegidas como diana in situ. En aspectos particulares, se refiere a una familia de constructos que emplean partes moleculares ligadas que eligen como diana y modulan la actividad de una biomolécula catalíticamente para inducir un efecto terapéutico.
Muchas enfermedades están causadas, o se asocian a biomoléculas, tanto libres en disolución en fluidos corporales como expuestas a fluidos corporales extracelulares tales como proteínas unidas a la membrana y polisacáridos, tales como citocinas o factores de crecimiento, y se reconoce ampliamente que es posible desarrollar terapias para tales enfermedades modulando la actividad de la biomolécula.
Por ejemplo, la sobreproducción de TNF-a y/o TNF-ß está íntimamente ligada al desarrollo de muchas enfermedades que incluyen choque séptico, síndrome disneico del adulto, artritis reumatoide, trastornos autoinmunitarios selectivos, enfermedad de injerto-huésped tras trasplante de médula ósea y caquexia. Otras enfermedades asociadas a la producción excesiva de TNF-a y/o TNF-ß incluyen choque hemorrágico, asma y síndrome de diálisis posrenal. La multiplicidad de acciones de TNF-a y TNF-ß puede atribuirse al hecho de que las acciones de TNF-a y/o TNF-ß dan como resultado la activación de múltiples rutas de transducción de señales, cinasas, factores de transcripción, además de una matriz inusualmente grande de genes celulares. (Walajtys-Rode, Elizbieta, Kosmos (Warsaw), 44, 451-464, 1995, C.A. 124: 199735a, 1995). El TNFa también se ha ligado al desarrollo de trastornos autoinmunitarios.
Las terapias actuales para combatir los anteriores trastornos incluyen la administración de un agente de unión tal como un anticuerpo o receptor soluble que se une a y así inhibe una biomolécula elegida como diana que produce o está asociada a la enfermedad. Sin embargo, hay muchos inconvenientes asociados a esta solución. Por ejemplo, los agentes de unión, por su propia naturaleza, sólo pueden inhibir la(s) biomolécula(s) a las que están unidos y no pueden ni inactivar catalíticamente una serie de biomoléculas ni alterar químicamente la(s) biomolécula(s) unida(s). Por esta razón es probable que frecuentemente se necesiten dosis relativamente grandes de agentes de unión para lograr eficacia terapéutica, exponiéndose el sujeto a efectos secundarios peligrosos y frecuentemente tóxicos. Además, la producción de tales cantidades grandes de anticuerpos y otros agentes de unión es cara.
El documento WO 02/097042 describe proteínas de fusión que comprenden (i) una porción de proteína inductora de apoptosis que puede ser una proteasa y (ii) una porción que elige células como diana.
La identificación y expresión de la mesotripsina (mesotripsinógeno) humana que codifica ADNc, una isoforma de tripsina (tripsinógeno) con resistencia a inhibidores, se describe en Cornelio N.M. Nyaruhucha, Makoto Kito y Shin-Ichi Fukuoka, The Journal of Biological Chemistry, vol. 272, 10573-10578, 1997.
Los agentes terapéuticos elegidos como diana con mayor eficacia que los agentes terapéuticos de unión tradicionales serían una mejora deseable.
Resumen de la invención
La presente invención se refiere a proteínas de fusión que comprenden:
En ciertos aspectos, las proteínas de fusión de la invención son una nueva clase de constructos de proteínas manipulados denominados en el presente documento "adzimas", además de procedimientos y composiciones relacionados con el uso y la producción de adzimas. En general, las adzimas son constructos de proteínas quiméricas que se unen a uno o más dominios catalíticos con uno o más restos que eligen diana (o "direcciones"). Los dominios catalíticos y los restos que eligen diana no necesitan ser entidades separadas. En ciertas realizaciones, los restos que eligen diana/direcciones se introducen dentro de los dominios catalíticos. Un dominio catalítico de una adzima tiene un sitio enzimáticamente activo que cataliza una reacción que convierte un sustrato preseleccionado (la "diana" o "sustrato elegido como diana") en uno o más productos tales como por escisión, modificaciones químicas (transformaciones) o isomerización. Tales productos pueden tener una actividad alterada respecto al sustrato teniendo opcionalmente una actividad aumentada o disminuida que es cualitativamente diferente.
La invención se basa parcialmente en el descubrimiento inesperado que cuando se diseñan adzimas, pueden alterarse ciertas propiedades cinéticas de la adzima final para lograr un equilibrio entre la selectividad óptima y la potencia óptima de la adzima. Más específicamente, se determina que a medida que la enzima o dominio catalítico de una adzima llega a ser más potente, la adzima global pierde rápidamente su selectividad frente a un panel de sustratos diferentes comprometiendo por tanto la utilidad global de la adzima. Por otra parte, si va a lograrse una selectividad máxima sin considerar la potencia, la potencia puede aproximarse rápidamente a la de un agente de unión estequiométrico, por ejemplo, el dominio de dirección o resto que elige diana, y de nuevo se compromete la utilidad global de la adzima. Por tanto, hay una relación entre la potencia y la selectividad de una adzima. El equilibrio óptimo se logra cuando la eficiencia catalítica del dominio de enzima (kcatES/KMES) es igual a koffAS/[S]ef. Tal equilibrio puede lograse más eficientemente ajustando [S]ef, tal como ajustando la longitud del ligador entre el dominio catalítico y el resto que elige diana.
La adzima de la presente invención comprende el dominio catalítico de mesotripsina, o sus fragmentos funcionales, derivados, variantes o mutantes estabilizantes con semivida más larga y/o potencia aumentada. Por tanto, la invención proporciona una adzima que comprende: (a) dominio catalítico de mesotripsina que cataliza la proteolisis de un sustrato diana; y (b) un resto que elige diana que se une al sustrato diana. En una realización, el dominio catalítico de mesotripsina está posicionado en el extremo N respecto al dominio de dirección. En una realización, el dominio catalítico de mesotripsina comprende un polipéptido que tiene una secuencia de aminoácidos que es al menos aproximadamente el 70%, 80%, 85%, 90% o aproximadamente el 97% o más idéntica a una secuencia de aminoácidos de un polipéptido de mesotripsina humano. En una realización, el dominio catalítico de mesotripsina comprende una secuencia de aminoácidos de SEQ ID NO: 45. En una realización, el dominio catalítico de mesotripsina comprende una secuencia de aminoácidos que se diferencia de SEQ ID NO: 45 sólo en uno o más cambios de aminoácidos conservativos.
Una adzima preferida adicional de la presente invención comprende un resto que elige diana que es un andamiaje de polipéptido, preferentemente un andamiaje similar a inmunoglobulina, que ha sido manipulado para unirse al sustrato elegido como diana. Ejemplos de tales restos que eligen diana incluyen aquellos que se basan en el dominio de fibronectina tipo III.
Por tanto, en ciertos aspectos, la invención proporciona adzimas que comprenden un dominio catalítico de mesotripsina y un resto que elige diana, en las que el dominio catalítico cataliza una reacción química que convierte un sustrato en uno o más productos y en las que el resto que elige diana se une reversiblemente a un sitio de dirección que está tanto en el sustrato como en proximidad funcional con el sustrato. Preferentemente, el resto que elige diana se une reversiblemente al sitio de dirección. Opcionalmente, dicho resto que elige diana y dicho dominio catalítico son heterólogos entre sí. Generalmente, dicho resto que elige diana, cuando se proporciona por separado, se une al sustrato, y dicho dominio catalítico, cuando se proporciona por separado, cataliza la reacción química que convierte dicho sustrato en uno o más productos.
En ciertas realizaciones, un dominio catalítico y un dominio que elige diana de la adzima se unen por un ligador de polipéptido para formar una proteína de fusión. Una proteína de fusión puede generarse en una variedad de...
Reivindicaciones:
1. Una proteína de fusión que comprende:
2. La proteína de fusión de la reivindicación 1, en la que la proteína de fusión es una proteína de fusión de cotraducción codificada por un ácido nucleico recombinante.
3. La proteína de fusión de la reivindicación 1, en la que el resto que elige diana está directamente ligado al dominio catalítico de mesotripsina sin ligador.
4. La proteína de fusión de la reivindicación 1, en la que el resto que elige diana está ligado al dominio catalítico de mesotripsina por un péptido sin estructurar.
5. La proteína de fusión de la reivindicación 4, en la que el péptido sin estructurar comprende una pluralidad de aminoácidos de glicina y serina y tiene una longitud de entre 15 y 50 aminoácidos.
6. La proteína de fusión de la reivindicación 4, en la que el péptido sin estructurar comprende una o más repeticiones de ligador de polipéptido flexible Ser4Gly o SerGly4 o GlySer4 o Gly4Ser.
7. La proteína de fusión de la reivindicación 1, en la que el dominio catalítico de mesotripsina está posicionado en el extremo N respecto al resto que elige diana.
8. La proteína de fusión de la reivindicación 1, en la que el dominio catalítico de mesotripsina comprende un polipéptido que tiene una secuencia de aminoácidos que es al menos el 85% idéntica a una secuencia de aminoácidos de un polipéptido de mesotripsina humano.
9. La proteína de fusión de la reivindicación 8, en la que el dominio catalítico de mesotripsina comprende una secuencia de aminoácidos de SEQ ID NO: 45.
10. La proteína de fusión de la reivindicación 8, en la que el dominio catalítico de mesotripsina comprende una secuencia de aminoácidos que se diferencia de la SEQ ID NO: 45 sólo en uno o más cambios de aminoácidos conservativos.
11. La proteína de fusión de la reivindicación 1, en la que el resto que elige diana comprende un anticuerpo o un sitio de unión a antígeno del mismo.
12. La proteína de fusión de la reivindicación 1, en la que el resto que elige diana se selecciona del grupo que está constituido por un anticuerpo monoclonal, un Fab y F(ab)2, un scFv, un diacuerpo, una región variable de cadena pesada y una región variable de cadena ligera.
13. La proteína de fusión de la reivindicación 1, en la que el resto que elige diana comprende un andamiaje similar a inmunoglobulina.
14. La proteína de fusión de la reivindicación 13, en la que el andamiaje similar a inmunoglobulina es un andamiaje FN3.
15. La proteína de fusión de la reivindicación 1, en la que el resto que elige diana comprende un andamiaje seleccionado del grupo que está constituido por: anticalinas, Affibodies, knottinas, tendamistat, GST P1-1/A1-1, lectinas, transferrina, tetranectinas y proteínas de unión triméricas.
16. La proteína de fusión de la reivindicación 1, en la que la proteína de fusión es resistente a proteolisis autocatalizada.
17. La proteína de fusión de la reivindicación 16, en la que la proteína de fusión es resistente a proteolisis autocatalizada a una concentración que es aproximadamente igual a la concentración de la proteína de fusión en una disolución que va a administrarse a un sujeto.
18. La proteína de fusión de la reivindicación 1, en la que dicho sustrato es un ligando de receptor, y dicho resto que elige diana incluye un dominio de unión a ligando de un receptor afín de dicho ligando.
19. La proteína de fusión de la reivindicación 1, en la que dicho sustrato es una hormona de polipéptido, un factor de crecimiento y/o una citocina.
20. La proteína de fusión de la reivindicación 1, en la que el dominio catalítico de mesotripsina se deriva de una mesotripsina estabilizada, dicha mesotripsina estabilizada comprende uno o más cambios de secuencias de aminoácidos en sitios potencialmente autoproteolíticos, en la que dicho cambios no disminuyen la actividad catalítica de dicha mesotripsina.
21. La proteína de fusión de la reivindicación 20, en la que dichos sitios potencialmente autoproteolíticos comprenden Arg o Lys.
22. La proteína de fusión de la reivindicación 21, en la que dichos sitios potencialmente autoproteolíticos comprenden uno o más de: K98, R122, K159 y K193.
23. La proteína de fusión de la reivindicación 22, en la que dichos cambios comprenden uno o más de: K98Q, R122H, K159Q y K193A.
24. La proteína de fusión de la reivindicación 20, en la que la actividad aparente de la mesotripsina estabilizada es al menos aproximadamente 3 veces superior a la de la mesotripsina natural.
25. La proteína de fusión de la reivindicación 20 que conserva sustancialmente la misma actividad durante un periodo de al menos aproximadamente 2 días, preferentemente aproximadamente 3, 4, 5, 6, 10 o más días.
26. La proteína de fusión de una cualquiera de las reivindicaciones 1 a 7, en la que el resto que elige diana se basa en un andamiaje FN3.
27. Una proteína de fusión para inhibir la actividad de un polipéptido sustrato, siendo la proteína de fusión una fusión de complejo de inmunoglobulina que comprende: una primera proteína de fusión unida a una segunda proteína de fusión, en la que la primera proteína de fusión comprende una porción constante de una cadena pesada de inmunoglobulina y un dominio catalítico de mesotripsina que cataliza la escisión proteolítica de al menos un enlace peptídico del polipéptido sustrato, y en la que la segunda proteína de fusión comprende una porción constante de una cadena pesada de inmunoglobulina y un dominio que elige diana que se une a un sitio de dirección sobre dicho polipéptido sustrato, en la que dicho dominio que elige diana y dicho dominio de proteasa son discretos y heterólogos entre sí.
28. Un polinucleótido que codifica la proteína de fusión de una cualquiera de las reivindicaciones 1 a 27.
29. Un vector que comprende el polinucleótido de la reivindicación 28.
30. Una célula huésped que comprende la proteína de fusión de una cualquiera de las reivindicaciones 1 a 27, el polinucleótido de la reivindicación 28 o el vector de la reivindicación 29.
31. Una preparación farmacéutica que comprende la proteína de fusión de una cualquiera de las reivindicaciones 1 a 27 y un vehículo farmacéuticamente eficaz.
32. La preparación farmacéutica de la reivindicación 31 formulada de forma que se inhibe la proteolisis autocatalítica de la proteína de fusión.
33. La preparación farmacéutica de la reivindicación 32 que comprende además un inhibidor reversible de dicho dominio de proteasa.
Patentes similares o relacionadas:
Cadena ligera de enteroquinasa modificada, del 22 de Julio de 2020, de NOVO NORDISK A/S: Un análogo de la cadena ligera de la enteroquinasa bovina que comprende una secuencia de aminoácidos establecida en la SEQ ID NO: 1, en donde dicho análogo comprende […]
Detección de interacciones proteína a proteína, del 15 de Julio de 2020, de THE GOVERNING COUNCIL OF THE UNIVERSITY OF TORONTO: Un método para medir cuantitativamente la fuerza y la afinidad de una interacción entre una primera proteína de membrana o parte de la misma y una […]
Métodos y composiciones para ingeniería genómica, del 3 de Junio de 2020, de Sangamo Therapeutics, Inc: Una pareja de nucleasas de dedo de zinc (ZFN) que comprende una ZFN izquierda y una ZFN derecha, comprendiendo cada ZFN un dominio de escisión […]
Métodos y composiciones para escisión dirigida y recombinación, del 20 de Mayo de 2020, de Sangamo Therapeutics, Inc: Un método in vitro para la escisión selectiva de un gen HLA clase I, un gen HLA que codifica una proteína de clase 1 del Complejo de Histocompatibilidad Mayor (MHC) […]
Antígenos de coagulasa estafilocócica y métodos para su uso, del 13 de Mayo de 2020, de UNIVERSITY OF CHICAGO: Una composición inmunógena que comprende al menos dos dominios 1-2 de coagulasa estafilocócica diferentes, en donde cada uno de los al menos dos dominios […]
Reconocimiento de unión a diana celular mediante un agente bioactivo usando transferencia de energía de resonancia de bioluminiscencia intracelular, del 6 de Mayo de 2020, de PROMEGA CORPORATION: Un sistema de ensayo que comprende: (a) una biblioteca de agentes bioactivos, cada uno de los cuales está fijado a un fluoróforo; (b) una diana celular fusionada a […]
Etiqueta de epítopo y método de detección, captura y/o purificación de polipéptidos etiquetados, del 15 de Abril de 2020, de ChromoTek GmbH: Péptido epítopo aislado que tiene de 12 a 25 aminoácidos, en donde la secuencia de aminoácidos comprende una secuencia según se define en SEQ ID NO: 32 (X1X2RX4X5AX7SX9WX11X12), […]
Utilización diagnóstica de un polipéptido de fusión que comprende una proteína vírica y un enzima MGMT, del 15 de Abril de 2020, de INSTITUT PASTEUR: Utilización in vitro de un polipéptido de fusión que comprende una proteína vírica y i) el enzima 6-metilguanina-ADN-metiltransferasa (MGMT, EC 2.1.1.63) o un homólogo […]