USO DE ESTRIOL EN LA PREPARACION DE UNA FORMULACION FARMACEUTICA PARAEL TRATAMIENTO DE ATROFIA VAGINAL EN MUJERES CON RIESGO DE POTOLOGIATUMORAL.
Uso de estriol en la preparación de una formulación farmacéutica para el tratamiento de atrofia vaginal en mujeres con riesgo de patología tumoral.
Uso de estriol en la preparación de formulaciones farmacéuticas de administración vaginal para la prevención y/o el tratamiento de la atrofia urogenital por déficit estrogénico estando dichas formulaciones caracterizadas por su capacidad de autolimitar la absorción de estriol
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P200802384.
Solicitante: ITALFARMACO, S.A..
Nacionalidad solicitante: España.
Provincia: MADRID.
Inventor/es: MOSCOSO DEL PRADO,JAIME, ACEBRON FERNANDEZ,ALVARO, BLANCO LOUSAME,DOLORES, NIETO MAGRO,CONCEPCION.
Fecha de Solicitud: 7 de Agosto de 2008.
Fecha de Publicación: .
Fecha de Concesión: 18 de Abril de 2011.
Clasificación Internacional de Patentes:
- A61K31/565 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › no sustituidos en posición 17 beta por un átomo de carbono, p. ej. estrano, estradiol.
Clasificación PCT:
- A61K31/565 A61K 31/00 […] › no sustituidos en posición 17 beta por un átomo de carbono, p. ej. estrano, estradiol.
- A61P15/02 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 15/00 Medicamentos para el tratamiento de trastornos genitales o sexuales (para trastornos de las hormonas sexuales A61P 5/24 ); Anticonceptivos. › para patologías de la vagina.
PDF original: ES-2344673_A1.pdf
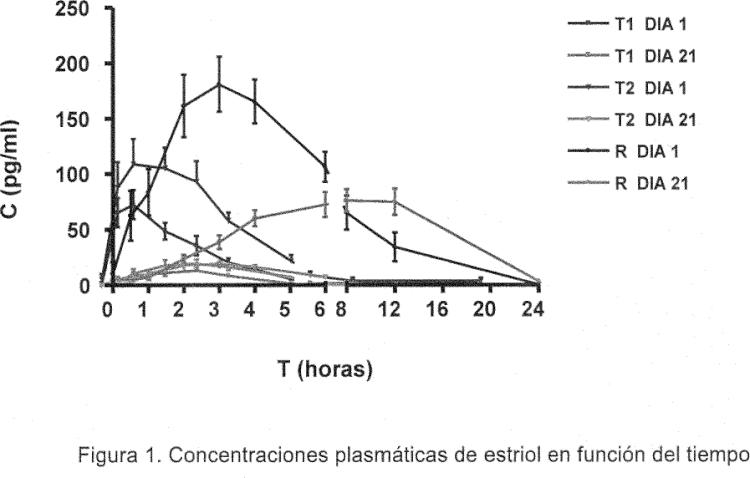
Fragmento de la descripción:
Uso de estriol en la preparación de una formulación farmacéutica para el tratamiento de atrofia vaginal en mujeres con riesgo de patología tumoral.
Esta invención se refiere a un método para tratar o prevenir la atrofia urogenital por déficit estrogénico que comprende administrar por vía vaginal formulaciones farmacéuticas de estriol caracterizadas por constituir un sistema capaz de autolimitar la absorción de estriol.
Esta invención se refiere también a un método para prevenir el riesgo de desarrollar tumores hormono-dependientes a nivel sistémico asociado a la terapia estrogénica que comprende administrar por vía vaginal una formulación de estriol caracterizada por constituir un sistema capaz de autolimitar la absorción de estriol.
Estado de la técnica
Los estrógenos y otras hormonas sexuales femeninas se producen principalmente en los ovarios y actúan a lo largo de la vida sobre distintos tejidos y órganos. Las células de estos órganos, entre los que destacan la mama y el útero, poseen receptores para los estrógenos y para otras hormonas. Las hormonas estrogénicas ejercen su acción uniéndose a dichos receptores y poniendo en marcha distintos procesos fisiológicos o patológicos. Entre otras funciones fisiológicas, son las responsables del desarrollo y las modificaciones que la mama y el útero sufren en los distintos periodos de la vida (pubertad, embarazo, lactancia, menopausia). Los estrógenos pueden intervenir también en procesos patológicos, estimulando el crecimiento y desarrollo de algunos tumores malignos (por ejemplo cáncer de mama, de endometrio, de colon, melanomas) y benignos (por ejemplo miomas, adenomas hepáticos), tanto en mujeres premenopáusicas como posmenopáusicas.
El tratamiento médico de los tumores que expresan receptores estrogénicos suele incluir la supresión de la producción de estrógenos o la neutralización de sus efectos. Por ejemplo, la terapia hormonal de carcinomas de mama consiste en la administración de fármacos que bloquean la acción de las hormonas que estimulan la proliferación de las células cancerosas (modificando su comportamiento sobre las células mamarias o impidiendo su producción). Se les da a aquellas pacientes que tienen receptores hormonales positivos, las cuales constituyen un 60-70% del total de las mujeres diagnosticadas con cáncer de mama. Se ha observado que este tipo de terapia reduce las recidivas de la enfermedad y prolonga la supervivencia. En pacientes con enfermedad avanzada reduce los síntomas provocados por el tumor, mejora la calidad de vida y produce remisión de las metástasis. Se suele utilizar en combinación con otros tratamientos como cirugía, radioterapia o quimioterapia, en forma de terapia adyuvante o neoadyuvante.
A modo de ejemplo, se pueden mencionar diferentes tipos de terapia antiestrogénica para el cáncer de mama.
Los moduladores selectivos de los receptores estrogénicos (o SERMs, antes llamados antiestrógenos) inhiben selectivamente los receptores estrogénicos de las células mamarias. Tamoxifeno y toremifeno son dos SERMs actualmente utilizados en el tratamiento de carcinoma mamario. Raloxifeno, y otros fármacos de esta familia también están en fase de investigación para esta indicación
Los inhibidores de los receptores estrogénicos (o antagonistas estrogénicos puros) se unen a dichos receptores y los degradan, impidiendo que el estrógeno se una a ellos. El primer fármaco perteneciente a esta subfamilia que ha sido autorizado para el tratamiento del cáncer de mama es el fulvestrant.
Los inhibidores de la aromatasa (por ejemplo anastrozol, letrozol y exemestano) impiden que esta enzima actúe sobre la grasa corporal produciendo estrógenos y, por lo tanto, disminuyen sus niveles en sangre. Los análogos de la hormona liberadora de la hormona luteinizante (o LHRH agonistas, por ejemplo buserelina y goserelina) reducen los niveles de estrógenos y otras hormonas sexuales inhibiendo el eje hipotálamo-hipofisiario-gonadal. Los efectos de este tratamiento son similares a los que se producirían si se extirparan quirúrgicamente los ovarios, con la ventaja de que sus efectos son reversibles una vez que se suspende la medicación.
La extirpación quirúrgica de los ovarios o la eliminación de su función por radioterapia (ablación ovárica) consigue reducir los niveles de estrógenos eliminando la producción ovárica pero, puesto que es un tratamiento irreversible, se emplea cada vez menos.
Al reducir drásticamente los niveles de estrógenos, cualquiera de estos tratamientos antiestrogénicos (para el cáncer de mama u otros tumores estrógeno-dependientes) produce una menopausia -definitiva o temporal, reversible o irreversible- que puede producir una serie de efectos indeseados en la paciente. En particular puede causar atrofia urogenital por déficit estrogénico la que, debido a la duración habitual de estos tratamientos, se puede prolongar durante años. En algunos casos esta atrofia es severa y repercute de forma muy negativa en la calidad de vida de la paciente.
A pesar de que la terapia estrogénica suele ser muy eficaz en la reversión de la atrofia urogenital por déficit hormonal, no se recomienda su uso en pacientes pre o posmenopáusicas en tratamiento antiestrogénico por un tumor estrógeno-dependiente debido al riesgo asociado de estimular el desarrollo de estos tumores.
Por el mismo motivo, la terapia estrogénica de la atrofia urogenital tampoco se recomienda en mujeres posmenopáusicas que tienen probabilidad elevada de padecer un tumor estrógeno-dependiente.
La atrofia urogenital por déficit estrogénico no siempre requiere un tratamiento sistémico de los síntomas mediante la terapia de reemplazo hormonal por vía oral. Una alternativa preferida es la administración de estrógenos por vía vaginal. Sin embargo, esta vía no está exenta de riesgos puesto que las hormonas estrogénicas administradas localmente pueden absorberse y pasar a nivel sistémico aumentando el riesgo de desarrollar tumores hormono-dependientes (benignos o malignos), en particular tumores con receptores estrogénicos positivos.
El estriol es uno de los estrógenos utilizados en el tratamiento de la atrofia urogenital, en particular por vía vaginal. Las formulaciones vaginales de estriol actualmente comercializadas se suelen administrar en una dosis de 0,5 mg/día (500 μg/día) durante las primeras 2-3 semanas de tratamiento, seguida de una dosis de 0,5 mg 2 o 3 veces/semana pero, por los riesgos que conllevaría, no se recomienda su administración en mujeres que han estado o están en tratamiento por un tumor estrógeno-dependiente o que tienen riesgo elevado de desarrollar tumores estrógeno-dependientes.
En consecuencia, el alivio de la atrofia urogenital por déficit estrogénico en mujeres que han sufrido o que están en tratamiento por un tumor estrógeno-dependiente o que tienen probabilidad elevada de desarrollar un tumor estrógeno-dependiente es una cuestión aún sin resolver.
Resumen de la invención
Los inventores de la presente han encontrado que, sorprendentemente, ciertas formulaciones vaginales de estriol constituyen un sistema capaz de autolimitar la absorción de estriol.
Han visto que, al comenzar el tratamiento con las formulaciones de la presente invención, cuando el epitelio vaginal está atrófico, se produce una absorción baja de estriol que se manifiesta en un área bajo la curva (AUC) concentración plasmática de estriol versus tiempo menor de 1000 pg/mlxh, preferiblemente menor de 750 pg/mlxh. Una vez que la administración repetida de estas formulaciones ha conseguido revertir la atrofia vaginal, hecho que sorprendentemente ocurre a los pocos días (entre los 3 y 15 días, mayoritariamente entre los 7 y 10 días) de iniciado el tratamiento, la absorción de estriol es insignificante y el área bajo la curva ha descendido de forma significativa respecto a la inicial, pasando a ser menor de 500 pg/ml x h, preferiblemente menor de 250 pg/ml x h. Por lo tanto, las formulaciones de la presente invención pueden ser utilizadas sin riesgo o con riesgo significativamente reducido para el tratamiento o la prevención de la atrofia urogenital en mujeres con probabilidad elevada de desarrollar tumores estrógeno-dependientes o en mujeres que están en tratamiento por padecer un tumor estrógeno-dependiente.
Los inventores de la presente han visto también que, sorprendentemente, al hacer el tratamiento de la atrofia vaginal con las formulaciones comercialmente disponibles la... [Seguir leyendo]
Reivindicaciones:
1. Uso de estriol en la preparación de una formulación farmacéutica de administración vaginal para la prevención o el tratamiento de la atrofia urogenital por déficit estrogénico caracterizada por su capacidad de autolimitar la absorción de estriol.
2. Uso de acuerdo con la reivindicación 1 en el que la formulación farmacéutica proporciona un área bajo la curva de concentración plasmática de estriol en función del tiempo menor de 750 pg/ml x h después de la administración de dosis diarias repetidas durante un tiempo entre 1 y 4 semanas.
3. Uso de acuerdo con la reivindicación 2 en el que la formulación farmacéutica proporciona un área bajo la curva menor de 500 pg/ml x h.
4. Uso de acuerdo con la reivindicación 3 en el que la formulación farmacéutica proporciona un área bajo la curva menor de 300 pg/ml x h.
5. Uso de acuerdo con la reivindicación 4 en el que la formulación farmacéutica proporciona un área bajo la curva menor de 150 pg/ml x h después de la administración de dosis diarias repetidas durante un tiempo entre 2 y 3 semanas.
6. Uso de acuerdo con la reivindicación 1 en el que la formulación farmacéutica proporciona niveles plasmáticos de estriol menores de 50 pg/ml después de la administración diaria repetida durante un tiempo entre 1 y 4 semanas.
7. Uso de acuerdo con la reivindicación 6 en el que la formulación farmacéutica proporciona niveles plasmáticos de estriol menores de 30 pg/ml después de la administración diaria repetida durante un tiempo entre 2 y 3 semanas.
8. Uso de estriol de acuerdo con las reivindicaciones anteriores en la prevención o el tratamiento de la atrofia urogenital por déficit estrogénico en mujeres con elevada probabilidad de desarrollar un tumor estrógeno-dependiente.
9. Uso de estriol de acuerdo con las reivindicaciones 1 a 7 en la prevención o el tratamiento de la atrofia urogenital por déficit estrogénico en mujeres que padecen o han padecido un tumor estrógeno-dependiente en tratamiento con al menos un fármaco que inhibe la producción o interfiere con la acción de los estrógenos en el organismo.
10. Uso de acuerdo con la reivindicación 9 en el que el fármaco es un modulador selectivo de receptores estrogénicos.
11. Uso de acuerdo con la reivindicación 9 en el que el fármaco es un inhibidor de receptores estrogénicos.
12. Uso de acuerdo con la reivindicación 9 en el que el que el fármaco es un inhibidor de la aromatasa.
13. Uso de acuerdo con la reivindicación 9 en el que el fármaco es un análogo de la hormona liberadora de la hormona luteinizante.
14. Uso de estriol de acuerdo con las reivindicaciones 1 a 7 en la prevención o el tratamiento de la atrofia urogenital por déficit estrogénico en mujeres que han sido sometidas a ablación ovárica.
15. Uso de acuerdo con las reivindicaciones anteriores en el que la formulación farmacéutica permite administrar una dosis de estriol menor o igual de 0,3 mg/día.
16. Uso de acuerdo con la reivindicación 15 en el que la dosis de estriol es menor o igual de 0,1 mg/día.
17. Uso de acuerdo con la reivindicación 16 en el que la dosis de estriol está entre 0,002 y 0,07 mg/día.
18. Uso de acuerdo con la reivindicación 17 en el que la dosis de estriol está entre 0,01 y 0,05 mg/día.
19. Uso de estriol en la preparación de una formulación farmacéutica de administración vaginal para la prevención del riesgo de desarrollar tumores hormono-dependientes a nivel sistémico asociado a la terapia estrogénica, estando dicha formulación caracterizada por su capacidad de autolimitar la absorción de estriol.
Patentes similares o relacionadas:
Unidad de dosificación orodispersable que contiene un componente de estetrol, del 29 de Abril de 2020, de Estetra SPRL: Una unidad de dosificación farmacéutica sólida orodispersable que tiene un peso entre 30 y 1.000 mg, y dicha unidad de dosificación consiste […]
Suministro transdérmico, del 8 de Abril de 2020, de AGILE THERAPEUTICS, INC: Un método anticonceptivo, que comprende: (A) aplicar de manera consecutiva múltiples dispositivos de tratamiento de suministro de hormonas transdérmico a la piel […]
Sistema de administración de fármacos por vía transmucosa oral, del 1 de Abril de 2020, de Abon Pharmaceuticals, LLC: Una forma de dosificación transmucosa oral que comprende (a) un vehículo primario monofásico que comprende (i) un agente de inhibición […]
Un dispositivo intravaginal, y un método para reducir la velocidad de difusión de ingredientes activos en dicho dispositivo intravaginal, del 11 de Marzo de 2020, de Qpharma AB: Un anillo intravaginal (1,1',1'') que comprende al menos un primer ingrediente farmacéuticamente activo y al menos una primera capa hecha de al menos un primer material […]
Composiciones de fulvestrant y métodos de uso, del 25 de Diciembre de 2019, de SHIMODA BIOTECH (PTY) LTD: Una formulación que comprende a) una ciclodextrina; y b) un compuesto de la fórmula (I): **(Ver fórmula)** o una sal del mismo o hidrato del anterior; y c) un vehículo […]
Antagonistas de CYP2J2 en el tratamiento del dolor, del 2 de Octubre de 2019, de FRAUNHOFER-GESELLSCHAFT ZUR FORDERUNG DER ANGEWANDTEN FORSCHUNG E.V.: Un antagonista selectivo de la citocromo P450 epoxigenasa 2J2 (CYP2J2) para uso en la prevención o tratamiento del dolor neuropático periférico inducido por quimioterapia […]
Composiciones y métodos de administración dérmica, del 2 de Octubre de 2019, de AGILE THERAPEUTICS, INC: Una composición para la administración transdérmica de levonorgestrel, que comprende: a) un portador que comprende un adhesivo sensible […]
Uso de un estrógeno en la fabricación de una composición que contiene estrógeno para el tratamiento de la vaginitis atrófica, del 27 de Septiembre de 2019, de NOVO NORDISK HEALTH CARE AG: Uso de un estrogeno en la preparacion de una composicion que contiene estrogeno para el tratamiento de la vaginitis atrofica en mujeres, donde se administra de aproximadamente […]