Terapia de combinación para tratar trastornos de deficiencia de proteínas.
Un método para mejorar la estabilidad in vitro o para aumentar la vida útil in vitro de una α
-galactosidasa A de tipo salvaje humana recombinante purificada en una formulación que tiene un pH entre 7,0 y 7,5 para la administración parenteral a un ser humano, poniendo en contacto la α-galactosidasa A en un soporte farmacéuticamente aceptable con 1-desoxigalactonojirimicina en una cantidad eficaz para aumentar la estabilidad in vitro o para aumentar la vida útil de la α-galactosidasa A purificada, en donde la α-galactosidasa A no es una α-galactosidasa A mutante que esté incorrectamente plegada en una conformación biológicamente inactiva.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2004/002973.
Solicitante: THE MOUNT SINAI SCHOOL OF MEDICINE OF NEW YORK UNIVERSITY.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: ONE GUSTAVE L. LEVY PLACE NEW YORK, NY 10029 ESTADOS UNIDOS DE AMERICA.
Inventor/es: FAN,JIAN-QIANG.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K38/47 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › que actúan sobre compuestos glicosílicos (3.2), p. ej. celulosas, lactasas.
- C12N9/24 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 9/00 Enzimas, p. ej. ligasas (6.); Proenzimas; Composiciones que las contienen (preparaciones para la limpieza de los dientes que contienen enzimas A61K 8/66, A61Q 11/00; preparaciones de uso médico que contienen enzimas A61K 38/43; composiciones detergentes que contienen enzimas C11D ); Procesos para preparar, activar, inhibir, separar o purificar enzimas. › actúan sobre compuestos glicosílicos (3.2).
- C12N9/40 C12N 9/00 […] › actúan sobre los enlaces alfa-galactosa-glicósido, p. ej. alfa-galactosidasa.
- C12N9/99 C12N 9/00 […] › Inactivación de enzimas por tratamiento químico.
PDF original: ES-2531478_T3.pdf
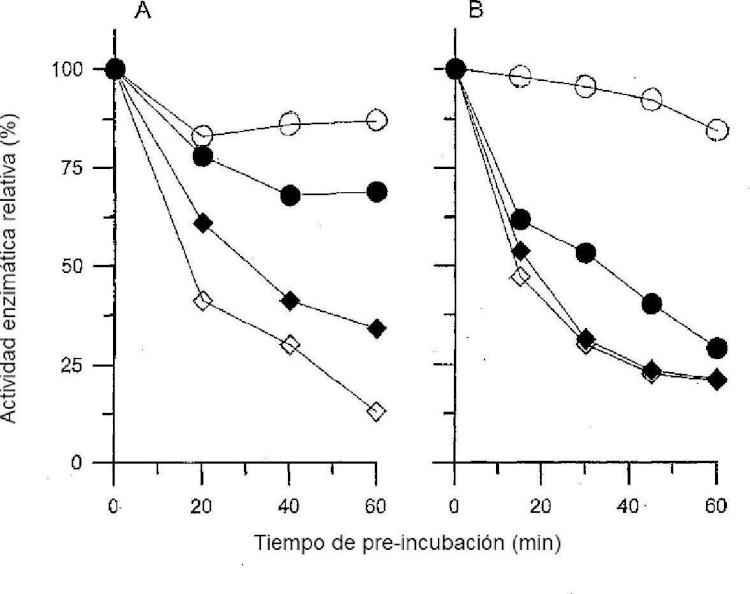
Fragmento de la descripción:
Terapia de combinación para tratar trastornos de deficiencia de proteínas
Esta solicitud reivindica prioridad de la solicitud provisional de EE.UU. n° de serie 6/444.136, presentada el 31 enero de 23, cuya descripción se incorpora aquí como referencia en su totalidad.
CAMPO DE LA INVENCIÓN
Esta solicitud proporciona métodos para mejorar la estabilidad in vitro o aumentar la vida útil in vitro de una proteína recombinante purificada, al combinar la proteína con chaperonas específicas para el sitio activo (ASSC - siglas en inglés) para aumentar la estabilidad y la eficacia de la proteína que se esté administrando. La solicitud proporciona, además, composiciones que comprenden la proteína purificada y una ASSC.
ANTECEDENTES
Deficiencia de proteínas
Las proteínas se sintetizan intracelularmente de acuerdo con la secuencia de nucleótidos genómica de un gen particular a través de la transcripción, traducción, y otros procesos. La deficiencia de proteínas puede ser provocada por una mutación en el gen codificante, lo que resulta en (i) la no síntesis de la proteína; (ii) la síntesis de la proteína que carece de actividad biológica; o (iii) la síntesis de la proteína que contiene la actividad biológica normal o parcial, pero que no puede ser procesada apropiadamente para alcanzar el compartimiento nativo de la proteína. A los trastornos por deficiencia de proteínas que resultan de mutaciones genéticas también se les alude como trastornos genéticos.
Además de deficiencias de proteínas que resultan de mutaciones genéticas, algunas deficiencias de proteínas surgen debido a una enfermedad, o como un efecto secundario de un tratamiento de una enfermedad (p. ej., quimioterapia) o como resultado de una insuficiencia nutricional.
Terapias actuales. Hay numerosos trastornos que resultan de deficiencias de proteínas, algunos de las cuales surgen de proteínas mutadas y mal plegadas (trastornos conformacionales - véase ínfra). Una terapia actual para el tratamiento de deficiencias de proteínas es la terapia de reemplazo de proteínas, que implica típicamente la infusión intravenosa, subcutánea o intramuscular de una forma purificada de la correspondiente proteína de tipo salvaje, o la implantación de la proteína en una forma sólida bio-erosionable para la liberación prolongada. Una de las principales complicaciones con la terapia de reemplazo de proteínas es el logro y el mantenimiento de cantidades terapéuticamente eficaces de la proteína debido a la rápida degradación de la proteína infundida. El enfoque actual para superar este problema es llevar a cabo numerosas costosas infusiones de dosis alta.
La terapia de reemplazo de proteínas tiene varias advertencias adicionales tales como dificultades con la generación a gran escala, la purificación y el almacenamiento de proteínas adecuadamente plegadas, la obtención de proteína glicosilada nativa, la generación de una respuesta inmune anti-proteína y la incapacidad de la proteína de atravesar la barrera sangre-cerebro en enfermedades en las que esté significativamente implicado el sistema nervioso central.
La terapia génica utilizando vectores recombinantes que contienen secuencias de ácidos nucleicos que codifican una proteína funcional, o células humanas genéticamente modificadas que expresan una proteína funcional, también se está utilizando para tratar deficiencias de proteínas y otros trastornos que se benefician de la sustitución de proteínas. Aunque prometedora, este enfoque también está limitado por dificultades técnicas tales como la incapacidad de los vectores de infectar o transducir células en división, una baja expresión del gen diana y la regulación de la expresión una vez que se suministra el gen.
Un tercer enfoque, relativamente reciente, para el tratamiento de deficiencias de proteínas implica el uso de inhibidores de moléculas pequeñas para reducir el sustrato natural de las proteínas de enzima deficiente, mejorando de este modo la patología. Este enfoque de "privación de sustrato" ha sido descrito específicamente para una clase de aproximadamente 4 trastornos enzimáticos relacionados denominados trastornos de almacenamiento lisosomal o trastornos de almacenamiento glicoesfingolípido. Estos trastornos hereditarios se caracterizan por deficiencias en enzimas lisosomales que catalizan la descomposición de glicolípidos en las células, lo que resulta en una acumulación anormal de lípidos que interrumpe la función celular. Los inhibidores de moléculas pequeñas propuestos para su uso como terapia son específicos para la inhibición de las enzimas implicadas en la síntesis de glicolípidos, reduciendo la cantidad de glicolípido celular que necesita ser roto por la enzima deficiente. Este enfoque
también está limitado, debido a que los glicolípidos son necesarios para la función biológica, y una privación en exceso puede provocar efectos adversos. Específicamente, los glicolípidos son utilizados por el cerebro para enviar señales de los gangliósidos de neuronas a otro. Si hay demasiados pocos o demasiados glicolípidos, se ve impedida la capacidad de la neurona para enviar señales.
Un cuarto enfoque, comentado más adelante, como estrategia específica de chaperonas, rescata proteínas mutantes de la degradación en el retículo endoplasmático.
Procesamiento de Proteínas en el Retículo Endoplasmático
Las proteínas se sintetizan en el citoplasma, y las proteínas recién sintetizadas se secretan en el lumen del retículo endoplasmático (ER - siglas en inglés) en un estado ampliamente sin plegar. En general, el plegamiento de proteínas se rige por el principio del auto-ensamblaje. Polipéptidos recién sintetizados se pliegan en su conformación nativa en base a sus secuencias de aminoácidos (Anfinsen et al., Adv. Proteln Chem.1975; 29: 25-3). In vivo, el plegamiento de proteínas es complicado, porque la combinación de temperatura ambiente y alta concentración de proteínas estimula el proceso de agregación en el que los aminoácidos normalmente enterrados en el núcleo hidrofóbico interactúan con sus vecinos de forma no específica. Para evitar este problema, el plegamiento de proteínas es generalmente facilitado por un grupo especial de proteínas llamadas chaperonas moleculares que impiden la agregación de las cadenas de polipéptido naciente, y se unen a la proteína desplegada de manera que las repliega en la conformación nativa (Hartl, Nature 1996; 381:571-58).
Las chaperonas moleculares están presentes en prácticamente todos los tipos de células y en la mayoría de los compartimientos celulares. Algunas están involucradas en el transporte de proteínas y permiten que las células sobrevivan en circunstancias de tensión tal como un choque térmico y la Inanición de glucosa (Gethlng et al., Nature 1992; 355:33-45; Caplan, Trends Cell Biol. 1999; 9: 262-268; Lin etal., Mol. Blol. Cell. 1993; 4:19-1119; Bergeron et al., Trends Blochem. Sel. 1994; 19:124-128). Entre las chaperonas moleculares, Blp (proteína de unión a inmunoglobulina de cadena pesada, Grp78) es la chaperona mejor caracterizada del ER (Haas, Curr. Top. MIcroblol. Immunol. 1991; 167:71-82). Al Igual que otras chaperonas moleculares, Blp ¡nteractúa con muchas proteínas secretoras y de la membrana dentro del ER durante su maduración, aunque la Interacción es normalmente débil y de corta duración cuando el plegado discurre con fluidez. Una vez que se logra la conformación de la proteína nativa, la chaperona molecular ya no ¡nteractúa con la proteína. La unión de Blp a una proteína que fracasa en el plegamiento, ensamblaje o en la glicosilación adecuada, se vuelve estable, y conduce a la degradación de la proteína a través de la vía de degradación asociada a ER. Este proceso sirve como un sistema de "control de calidad" en el ER, lo que garantiza que sólo las proteínas correctamente plegadas y ensambladas sean transportadas fuera del ER para su posterior maduración, y las proteínas plegadas incorrectamente se conservan para su posterior degradación (Hurtley etal., Annu. Rev. Cell. Biol. 1989; 5:277-37).
Determinadas mutaciones en el ADN resultan en sustituciones de aminoácidos que impiden adicionalmente, y en muchos casos se oponen, al plegamiento correcto de las proteínas mutantes. Para corregir estos plegamlentos erróneos, los investigadores han intentado utilizar diversas moléculas. Las altas concentraciones de gllcerol, dimetilsulfóxido (DMSO), trimetilamina-N-óxido (TMAO), o agua deuterada han demostrado suprimir la vía de degradación y aumentar el tráfico intracelular de la proteína mutante en varias enfermedades (Brown et al., Cell Stress Chaperones 1996; 1:117-125; Burrows et al, Proc. Nati. Acad. Sci. USA.... [Seguir leyendo]
Reivindicaciones:
1. Un método para mejorar la estabilidad in vitro o para aumentar la vida útil in vitro de una a-galactosidasa A de tipo
salvaje humana recombinante purificada en una formulación que tiene un pH entre 7, y 7,5 para la administración
parenteral a un ser humano, poniendo en contacto la a-galactosidasa A en un soporte farmacéuticamente aceptable
con 1-desoxigalactonojirimicina en una cantidad eficaz para aumentar la estabilidad in vitro o para aumentar la vida útil de la a-galactosidasa A purificada, en donde la a-galactosidasa A no es una a-galactosidasa A mutante que esté Incorrectamente plegada en una conformación biológicamente inactiva.
2. El método de la reivindicación 1, en el que la a-galactosidasa A está asociada con un trastorno de
almacenamiento lisosomal.
3. El método de la reivindicación 1, en el que la a-galactosidasa A, el soporte farmacéuticamente aceptable y 1-
desoxigalactonojirimicina se formulan en un polvo liofilizado.
4. El método de la reivindicación 1, en el que la a-galactosidasa A, el soporte farmacéuticamente aceptable y 1- desoxigalactonojirimicina se formulan en una disolución acuosa estéril.
5. El método de la reivindicación 1, en el que la a-galactosidasa A está asociada con un trastorno de
almacenamiento lisosomal.
6. Una composición farmacéutica que comprende una a-galactosidasa A de tipo salvaje humana recombinante purificada y 1-desoxigalactonojirimicina en un soporte farmacéuticamente aceptable, en donde la a-galactosidasa A purificada y 1-desoxigalactonojirimicina están en una formulación que tiene un pH entre 7, y 7,5 para la administración parenteral a un ser humano, y en donde la a-galactosidasa A no es una a-galactosidasa A mutante
que está Incorrectamente plegada en una conformación biológicamente inactiva.
7. La composición de la reivindicación 6, en donde la a-galactosidasa A está asociada con un trastorno de almacenamiento lisosomal.
8. La composición de acuerdo con cualquiera de las reivindicaciones 6 ó 7, en donde la formulación es un liquido estéril para la administración intravenosa.
Patentes similares o relacionadas:
Composiciones para la supresión de la formación de inhibidores contra el factor VIII en pacientes con hemofilia A., del 22 de Julio de 2020, de THE TRUSTEES OF THE UNIVERSITY OF PENNSYLVANIA: Una composición que comprende material vegetal liofilizado que comprende al menos un fragmento de FVIII conjugado con la subunidad B de la toxina […]
Composiciones farmacéuticas para uso tópico basadas en ácido hialurónico sulfatado como promotor de absorción de la piel, del 1 de Julio de 2020, de FIDIA FARMACEUTICI S.P.A.: Una composición farmacéutica para uso tópico que contiene ácido hialurónico sulfatado como promotor de absorción de la piel de diclofenaco, ketoprofeno, ibuprofeno […]
Compuestos para el tratamiento de Trastornos Neuropsiquiátricos, del 24 de Junio de 2020, de Curemark LLC: Una composición que comprende enzimas digestivas para uso en el tratamiento del Trastorno Esquizofreniforme, en donde las enzimas digestivas comprenden amilasa, lipasa […]
Tratamiento de glucogenosis de tipo II, del 20 de Mayo de 2020, de DUKE UNIVERSITY: α-Glucosidasa ácida (GAA) humana recombinante producida en un cultivo de células de ovario de hámster chino para uso en un método de tratamiento de glucogenosis […]
Reticuladores químicos, del 22 de Abril de 2020, de AMICUS THERAPEUTICS, INC: Un método de realización de un péptido de direccionamiento lisosomal modificado que comprende: a. poner en contacto el factor de crecimiento similar […]
Regímenes de dosificación para el tratamiento de la enfermedad de Fabry, del 22 de Abril de 2020, de AMICUS THERAPEUTICS, INC: 1-desoxigalactonojirimicina para su uso en el tratamiento de enfermedad de Fabry, en donde el tratamiento comprende administrar a un paciente desde aproximadamente 50 mg hasta […]
Proteína, del 18 de Diciembre de 2019, de Dupont Nutrition Biosciences ApS: Un polipéptido aislado que presenta actividad de xilanasa, seleccionado del grupo que consiste en: (a) un polipéptido que comprende una secuencia de aminoácido que tiene […]
Composiciones de alfa-galactosidasa, del 18 de Diciembre de 2019, de PROTALIX LTD. (100.0%): Una proteína α-galactosidasa humana que comprende una glicina como el resto N-terminal en donde dicha proteína α-galactosidasa humana se fusiona traduccionalmente […]