Procedimiento para la producción de péptidos y aminoácidos mediante hidrólisis ácida y básica en paralelo.
Procedimiento para la producción de péptidos y aminoácidos mediante hidrólisis ácida y básica en paralelo a partir de hemoglobina purificada,
procedente de animales. Posteriormente, el medio ácido y básico se mezclan para detener las reacciones, y los productos obtenidos (péptidos y aminoácidos) son purificados. La invención tiene por objeto proporcionar un procedimiento adecuado para subsanar la pérdida de aminoácidos que tiene lugar cuando la hemoglobina es hidrolizada empleando únicamente ácidos o álcalis de forma independiente, a la vez que se consigue un importante ahorro de reactivos, ya que tanto los ácidos como los álcalis son empleados como agentes de hidrólisis y neutralizantes.
De aplicación en los sectores de la agricultura, química y farmacia, medioambiental o alimentario, y en particular en aquellas industrias agroalimentarias o cárnicas que generan un exceso de sangre y que requieren un método eficiente para el post-procesado de subproductos.
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P201300560.
Solicitante: UNIVERSIDAD DE OVIEDO.
Nacionalidad solicitante: España.
Inventor/es: RENDUELES DE LA VEGA,MANUEL, DIAZ FERNANDEZ,MARIO, ÁLVAREZ GARCÍA,Carlos.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A23J1/06 NECESIDADES CORRIENTES DE LA VIDA. › A23 ALIMENTOS O PRODUCTOS ALIMENTICIOS; SU TRATAMIENTO, NO CUBIERTO POR OTRAS CLASES. › A23J COMPOSICIONES A BASE DE PROTEINAS PARA LA ALIMENTACION; TRATAMIENTO DE PROTEINAS PARA LA ALIMENTACION; COMPOSICIONES A BASE DE FOSFATIDOS PARA LA ALIMENTACION. › A23J 1/00 Preparación de composiciones a base de proteínas para la alimentación; Apertura de huevos en grandes cantidades y separación de la yema de la clara. › a partir de la sangre.
- A23J3/32 A23J […] › A23J 3/00 Tratamiento de proteínas para la alimentación. › utilizando agentes químicos.
- C07K1/12 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 1/00 Procedimientos generales de preparación de péptidos. › por hidrólisis.
- C12P21/06 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12P PROCESOS DE FERMENTACION O PROCESOS QUE UTILIZAN ENZIMAS PARA LA SINTESIS DE UN COMPUESTO QUIMICO DADO O DE UNA COMPOSICION DADA, O PARA LA SEPARACION DE ISOMEROS OPTICOS A PARTIR DE UNA MEZCLA RACEMICA. › C12P 21/00 Preparación de péptidos o de proteínas (proteína monocelular C12N 1/00). › preparados por hidrólisis de un enlace peptídico, p. ej. hidrolizados.
PDF original: ES-2414279_A1.pdf
Fragmento de la descripción:
La invención se refiere a un procedimiento para la producción de péptidos y aminoácidos a partir de hemoglobina purificada, procedente de animales, empleando para ello ácidos minerales y álcalis en un proceso de hidrólisis paralela. Posteriormente, el medio ácido y básico se mezclan para detener las reacciones, y los productos obtenidos (péptidos y aminoácidos) son purificados. La invención tiene por objeto proporcionar un procedimiento adecuado para subsanar la pérdida de aminoácidos que tiene lugar cuando la hemoglobina es hidrolizada empleando únicamente ácidos o álcalis de forma independiente, a la vez que se consigue un importante ahorro de reactivos, ya que tanto los ácidos como los álcalis son empleados como agentes de hidrólisis y neutralizantes.
La invención resulta de aplicación en la obtención de péptidos y aminoácidos a partir de hemoglobina purificada, principalmente en los sectores de la agricultura, química y farmacia, medioambiental o alimentario, y en particular en aquellas industrias agro alimentarias o cárnicas que generan un exceso de sangre y que requieren un método eficiente para el post-procesado de subproductos.
ESTADO DE LA TÉCNICA
En la actualidad, la hemoglobina purificada puede ser hidrolizada siguiendo procesos enzimáticos, hidrólisis química ácida (con ácidos orgánicos o minerales) , hidrólisis química básica o hidrólisis a muy altas presiones y temperaturas.
En el caso de las reacciones enzimáticas, se obtienen péptidos de manera predecible en cuanto a tamaño y secuencia sin pérdidas por degradación de aminoácidos; sin embargo, la concentración de proteína que puede ser tratada suele situarse habitualmente en un máximo de 5-50 giL. (Yike Y., Jianen H., Xuefeng B., Yuguang D. & Bingcheng L. Preparation and function of oligopeptide-enriched hydrolysate from globin by pepsin. Process Biochem., 2006, 41, 1589-1593; Tauzin, J., Mielo, L., Roth, S., Mollé, D. & Gaillard, J. L. Tr y ptic hydrolysis of bovine aS2
casein: identification and release kinetics of peptides. Int. Dair y J., 2003, 13, 15-27; Su, R. X., Qi, W. & He, Z. M. Time-dependent nature peptic hydrolysis of native bovine hemoglobin. Eur. Food Research Tech., 2007, 225, 637-647) . Ademas, es necesario un control muy estricto y continuo del pH del medio, el cual varia 5 constantemente a medida que la hidrolisis avanza. La temperatura es otro parametro esencial, debido a que solo dentro de un margen estrecho de valores de temperatura se obtienen buenos rendimientos de hidrolisis. Una vez finalizada la reaccion, la enzima empleada debe ser neutralizada en un paso posterior del proceso.
Cuando se emplean altas presiones y altas temperaturas, el producto final esti.
compuesto principalmente por aminoacidos y por productos de degradacion, como acidos organicos y amoniaco (Rogalinski, T., Hellmann, S., Brunner, G., Production of amino acids from bovine serum albumin by continuous sub-critical water hydrolysis. Journal of Supercritical Fluids, 2005, 36: 49-58.) . Con las condiciones de trabajo que se emplean habitualmente (15-27 MPa y 250-300 °C) , no es posible obtener peptidos de alto o bajo peso molecular. Ademas la tasa de transformacion de proteina en aminoacidos se sittla en torno al 65% (Esteban, M. B.; Garcia, A. J.; Ramos, P.; Marquez, M. C. Subcritical water hydrolysis of hog hair for amino acid production. Bioresour. Technol. 2010, 101, 2472-2476; Rogalinski, T.; Herrmann, S.; Brunner, G. Production of aminoacids from bovine serum albumin by continuous sub
critical water hydrolysis. J. Supercrit. Fluids 2005, 36, 49-58; Xian, Z.; Chao, Z.; Liang, Z.; Cheng, H. Amino acids production from fish proteins hydrolysis in subcritical water. Chin. J. Chem. Eng. 2008, 16, 456-460) .
En el caso de emplearse acidos como agentes hidrolizantes, se produce una degradacion de ciertos aminoacidos: asparagina y glutamina son transformados en acido aspartico y glutamico, mientras que el triptofano y la cisteina se destruyen por completo (Fountoulakis M., Hans-Werner L. Hydrolysis and amino acid composition analysis of proteins. Journal of Chromatography A, 1998, 826, 109-134) .
En el segundo caso, cuando se emplea una base para hidrolizar proteinas, se causa la perdida por degradacion de serina, treonina, arginina y cisteina; y la 30 asparagina y la glutamina son convertidas de igual modo en aspartato y glutamato (Ravindran, G. & Br y den, W.L. Tr y ptophan determination in proteins and feedstuffs by ion exchange chromatography. Food Chemistr y , 2004, 89, 309-314) . Las cantidades procesadas y el control de los parametros de la reaccion son iguales que en el caso anterior. La perdida de aminoacidos es un grave inconveniente, ya que algunos de ellos son esenciales y su carencia disminuye el valor nutricional del hidrolizado obtenido.
Como ventajas, los metodos quimicos no precisan un control del pH y el rango de temperaturas a las que se aplica es mucho mas amplio. Ademas, pueden procesarse hasta 500 g/L de sustrato (US 2.657.232 A; US 4.874.893 A) .
Habitualmente estos procesos quimicos son empleados para la hidrOlisis completa de las proteinas hasta obtener aminoacidos libres, nunca para la produccion de peptidos con un tamailo final predecible. Un proceso que permita obtener peptidos con un tamario predecible es significativo debido a que el tamario de los mismos determina sus propiedades funcionales y antioxidantes. Por tanto, un metodo que permita determinar el tamano final del hidrolizado es importante para conocer sus propiedades finales. Se sabe que peptidos de mas de 2 kDa presentan muy buenas propiedades funcionales, mientras que los de menos de 1 lcDa son muy buenos antioxidantes (Clemente, A., 2000, Enzymatic protein hydrolysates in human nutrition. Trends in Food Science and Technology, 11, 254-262; Suetsuna, K., Ukeda, H., & Ochi, H., 2000, Isolation and characterization of free radical scavenging
activities peptides derived from casein. The Journal of Nutrition Biochemistr y , 11 (3) , 128-131; Moure, A., Dominguez, H., & Parajo, J.C., 2006, Antioxidant properties of ultrafiltration-recovered soy protein fractions from industrial effluents and their hydrolysates. Process Biochemistr y . 41, 447-456) . Una vez finalizado el proceso, el acid° debe ser neutralizado empleando alcalis o por dilucion en agua, y lo mismo ocurre cuando se emplea alcali como hidrolizante, lo que incrementa notablemente la complejidad y el coste del proceso.
DESCRIPCION DE LA INVENCION
La presente invencion se refiere a un proceso para la produccion de peptidos y 30 aminoacidos libres a partir de hemoglobina purificada, mediante la aplicacion de acidos y áicalis como agentes hidrolizantes de forma paralela, con una neutralizaciOn y purificacion posterior de los productos obtenidos.
A los efectos de la presente invencion y su descripcion, se entiende por hidrolisis la ruptura ocurrida en un enlace peptidico mediante la accion de un agente hidrolizante, bien sea un acid° o un alcali. A los efectos de la presente invenciOn y su descripcion, se entiende por agente hidrolizante a los acidos o alcalis anadidos a la disoluciOn de proteinas que ocasionan la ruptura del enlace peptidico.
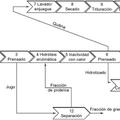
El procedimiento objeto de la invencion para la producciOn de peptidos y aminoacidos a partir de hemoglobina comprende las siguientes etapas:
a) Adicion de acido y alcali a dos disoluciones de hemoglobina purificada hasta alcanzar una concentración de 6 M de cada uno de los agentes hidrolizantes. Calentar estas mezclas hasta una temperatura entre los 50 y los 120 °C y mantenerlas en agitacion constante durante un tiempo de agitacion de entre 6 y 24 horas, dependiendo de la temperatura empleada.Preferentemente, la temperatura se fija en el valor adecuado bien sea para producir /*tidos (50 °C) , mezcla de peptidos y aminoacidos (80 °C) o solo aminoacidos (110 °C) . Se deja transcurfir la reaccion durante un periodo de tiempo tal que es de 24 horas cuando se emplean 50 °C y 110 °C y de 6 horas cuando se emplean 80 °C.
b) Mezclar las disoluciones acida y basica al termino de la hidrolisis hasta alcanzar un pH entre 1 y 2. c) Enfriar la mezcla hasta temperatura ambiente. A los efectos de la presente invencion y su descripcion, el termino "temperatura ambiente" debe interpretarse como la temperatura que se puede medir con un termometroy que se toma del ambiente actual. d) Separar la fraccion sOlida (rica en peptidos) y la fraccion liquida (rica en aminoacidos) mediante centrifugaciOn o filtracion. El producto una vez alcanza la temperatura ambiente es filtrado y se obtiene asi un permeado rico en sales disueltas (como por ejemplo... [Seguir leyendo]
Reivindicaciones:
1. Procedimiento para la produccion de peptidos y aminoacidos a partir de hemoglobina que comprende las siguientes etapas: a) adicion de acid° y alcali a dos disoluciones de hemoglobina purificada
hastaalcanzar una concentracion de 6 M de cada uno de los agentes hidrolizantes, calentar estas mezclas hasta una temperatura entre los 50 y los 120 °C y mantenerlas en agitacion constante durante un tiempo de agitación de entre 6 y 24 horas, dependiendo de la temperatura empleada;
b) mezclar las disoluciones acida y basica al termino de la hidrolisis hasta alcanzar un pH entre 1 y 2;
c) enfriar la mezcla hasta temperatura ambiente;
d) separar la fraccion solida (rica en peptidos) y la fraccion liquida (rica en aminoacidos) mediante centrifugación o filtracion; e) eliminar las sales en la fraccion solida mediante lavados con agua acida o destilada, eliminar las sales en la fraccion liquida mediante su precipitacion con etanol y purificar ambas fracciones mediante filtracion, decantacion o centrifugacion; eliminar el exceso de agua mediante secado.
2.Procedimiento, segun la reivindicacion 1, caracterizado por que la hemoglobina empleada procede de un animal.
3. Procedimiento, segim la reivindicacion 2 caracterizado por que el animal es del tipo porcino, vacuno, ovino, caprino, aviar o equino.
4. Procedimiento, segim la reivindicacion 1, caracterizado por que una vez
agregadoel acido o el alcali en la etapa a) la concentracion de hemoglobina de ambas mezclas es de 50 mg/mL.
5. Procedimiento, segim la reivindicacion 1, caracterizado por que el acido es acido sulfurico y el alcali es hidroxido sodico.
6. Procedimiento, segiin la reivindicacion 1, caracterizado por que la relaciOn de
volinnenes de reaccion de la etapa a) es de dos partes de disolucion basica y una parte de disoluciOn acida.
7. Procedimiento, segim la reivindicacion 1, caracterizado por que la temperatura de la etapa a) para producir peptidos es de 50 °C.
8. Procedimiento, segiin la reivindicacion 7, caracterizado por que el tiempo de
agitacion de la etapa a) es de 24 horas. 5
9.Procedimiento, segun la reivindicacion 1, caracterizado por que la temperatura de la etapa a) para producir una mezcla de peptidos y aminoacidos es de 80 °C.
10. Procedimiento, segim la reivindicacion 9, caracterizado por que el tiempo de agitacion de la etapa a) es de 6 horas.
11.Procedimiento, segun la reivindicacion 1, caracterizado por que la temperatura de la etapa a) para obtener aminoacidos es de 110 °C.
12. Procedimiento, segan la reivindicacion 11, caracterizado por que el tiempo de agitación de la etapa a) es de 24 horas.
13. Procedimiento, segan la reivindicacion 1, caracterizado por que el agua de 15 lavadode la fraccion sOlida en la etapa e) es destilada o con un pH de entre 1 y
2.
14. Procedimiento, segiin la reivindicacion 1, caracterizado por que la concentracion de etanol empleado en la etapa e) es del 15% v/v.
15. Procedimiento, segim la reivindicacion 1, caracterizado por que la filtracion de
lafase solida en la etapa e) es llevada a cabo por una membrana de 20 micras de diametro de poro.
16. Procedimiento, segiin la reivindicacion 1, caracterizado por que la separacion de la fase &Aida mediante centrifugacion en la etapa e) es llevada a cabo por una centrifugacion durante 10 minutos con una fuerza de 10.000 g.
Patentes similares o relacionadas:
 Quitina, hidrolizado y procedimiento para la producción de uno o más productos de interés a partir de insectos mediante
hidrólisis enzimática, del 29 de Julio de 2020, de Ynsect: Hidrolizado preparado a partir de insectos, que comprende al menos 40 % en peso de proteínas sobre el peso total de materia seca, un contenido […]
Quitina, hidrolizado y procedimiento para la producción de uno o más productos de interés a partir de insectos mediante
hidrólisis enzimática, del 29 de Julio de 2020, de Ynsect: Hidrolizado preparado a partir de insectos, que comprende al menos 40 % en peso de proteínas sobre el peso total de materia seca, un contenido […]
 Procedimiento de fermentación de alimentación discontinua de alta densidad celular para producir proteínas recombinantes, del 25 de Marzo de 2020, de WYETH LLC: Un procedimiento de producción de una proteína recombinante que comprende:
cultivar una célula bacteriana recombinante para expresar una proteína recombinante […]
Procedimiento de fermentación de alimentación discontinua de alta densidad celular para producir proteínas recombinantes, del 25 de Marzo de 2020, de WYETH LLC: Un procedimiento de producción de una proteína recombinante que comprende:
cultivar una célula bacteriana recombinante para expresar una proteína recombinante […]
Uso de tripeptidil peptidasas tolerantes a la prolina en composiciones de aditivo para piensos, del 26 de Febrero de 2020, de Dupont Nutrition Biosciences ApS: Un método para preparar una composición de aditivo para piensos que comprende: mezclar al menos una tripeptidil peptidasa tolerante a la prolina que tiene […]
Enzimas específicas de sitio y métodos de uso, del 19 de Febrero de 2020, de Poseida Therapeutics, Inc: Un polipéptido que comprende al menos una secuencia de aminoácidos que tiene la secuencia de LSTEQVVAIASX1X2GGKQALEAVKAQLLVLRAAPYE (SEQ ID NO: 1), en donde […]
Composiciones para unir módulos de dedos de cinc, del 15 de Enero de 2020, de Sangamo Therapeutics, Inc: Una proteína de dedos de cinc de múltiples dedos que se une específicamente a un sitio diana, comprendiendo la proteína de dedos de cinc de […]
Concentrado de proteínas de granos que contienen almidón: composición, método de fabricación y usos del mismo, del 1 de Enero de 2020, de THE UNITED STATES OF AMERICA AS REPRESENTED BY THE SECRETARY OF AGRICULTURE: Un proceso para producir un concentrado de proteinas a partir de un grano o semilla oleaginosa que contiene almidon, el proceso comprende: (i) moler el […]
 Terapia de ARNm para el tratamiento de enfermedades oculares, del 25 de Diciembre de 2019, de Translate Bio, Inc: Una composición que comprende un ARNm que codifica un péptido o polipéptido terapéutico para su uso en el tratamiento de una enfermedad, trastorno o afección ocular en un […]
Terapia de ARNm para el tratamiento de enfermedades oculares, del 25 de Diciembre de 2019, de Translate Bio, Inc: Una composición que comprende un ARNm que codifica un péptido o polipéptido terapéutico para su uso en el tratamiento de una enfermedad, trastorno o afección ocular en un […]
 Purificación de proteínas con prefiltrado, del 27 de Noviembre de 2019, de EMD Millipore Corporation: Un método para eliminar constituyentes de unión no específica de una corriente que contiene proteínas que comprende:
hacer fluir la corriente que contiene proteínas […]
Purificación de proteínas con prefiltrado, del 27 de Noviembre de 2019, de EMD Millipore Corporation: Un método para eliminar constituyentes de unión no específica de una corriente que contiene proteínas que comprende:
hacer fluir la corriente que contiene proteínas […]