MÉTODO Y SONDAS PARA LA DETECCIÓN DE UNA PROTEÍNA DE FUSIÓN ESPECÍFICA DE UN TUMOR.
Un conjunto de al menos una primera y una segunda sonda de FRET para la detección de una proteína de fusión,
proteína de fusión la cual comprende un primer sitio diana y un segundo sitio diana situados en lados opuestos de la región de fusión de dicha proteína de fusión, caracterizado porque: a) la primera sonda (i) comprende un dominio que se une específicamente al primer sitio diana de la proteína de fusión, (ii) está provisto de al menos un primer grupo reactivo, y (iii) está provisto de un primer colorante de FRET; b) la segunda sonda (i) comprende un dominio que se une específicamente al segundo sitio diana de la proteína de fusión, (ii) está provista de al menos un segundo grupo reactivo, y (iii) está provista de un segundo colorante de FRET; en el que c) para evitar la autoasociación de las sondas, los grupos reactivos en la primera sonda no interaccionan directamente con la segunda sonda, y los grupos reactivos en la segunda sonda no interaccionan directamente con la primera sonda; d) las dos sondas no interaccionan entre sí excepto que se añada una sustancia formadora de puente que reacciona con el primer y segundo grupo reactivo; e) al añadir la sustancia formadora de puente, los colorantes de FRET se llevan a una distancia de 100 Angstrom entre sí, permitiendo de ese modo la transferencia de energía y la detección de sondas yuxtapuestas
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/NL2003/000776.
Solicitante: ERASMUS UNIVERSITEIT ROTTERDAM.
Nacionalidad solicitante: Países Bajos.
Dirección: DR. MOLEWATERPLEIN 50 3015 GE ROTTERDAM PAISES BAJOS.
Inventor/es: VAN DONGEN,JACOBUS,JOHANNES,MARIA.
Fecha de Publicación: .
Fecha Solicitud PCT: 6 de Noviembre de 2003.
Fecha Concesión Europea: 8 de Septiembre de 2010.
Clasificación Internacional de Patentes:
- B82Y10/00 TECNICAS INDUSTRIALES DIVERSAS; TRANSPORTES. › B82 NANOTECNOLOGIA. › B82Y USOS O APLICACIONES ESPECIFICOS DE NANOESTRUCTURAS; MEDIDA O ANALISIS DE NANOESTRUCTURAS; FABRICACION O TRATAMIENTO DE NANOESTRUCTURAS. › Nano-tecnología para procesado, almacenamiento o transmisión de información, p. ej. cómputo cuántico o lógica de electrón suelto.
- B82Y20/00 B82Y […] › Nano óptica, p. ej. óptica cuántica o cristales ópticos.
- B82Y5/00 B82Y […] › Nano- biotecnología o nano-medicina, p. ej. ingeniería de proteínas o administración de fármaco.
- G01N33/542 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › con inhibición estérica o modificación de la señal, p. ej. extinción de fluorescencia.
- G01N33/574 G01N 33/00 […] › para el cáncer.
- G01N33/574V6
Clasificación PCT:
- G01N33/542 G01N 33/00 […] › con inhibición estérica o modificación de la señal, p. ej. extinción de fluorescencia.
- G01N33/574 G01N 33/00 […] › para el cáncer.
Clasificación antigua:
- G01N33/542 G01N 33/00 […] › con inhibición estérica o modificación de la señal, p. ej. extinción de fluorescencia.
- G01N33/574 G01N 33/00 […] › para el cáncer.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
Fragmento de la descripción:
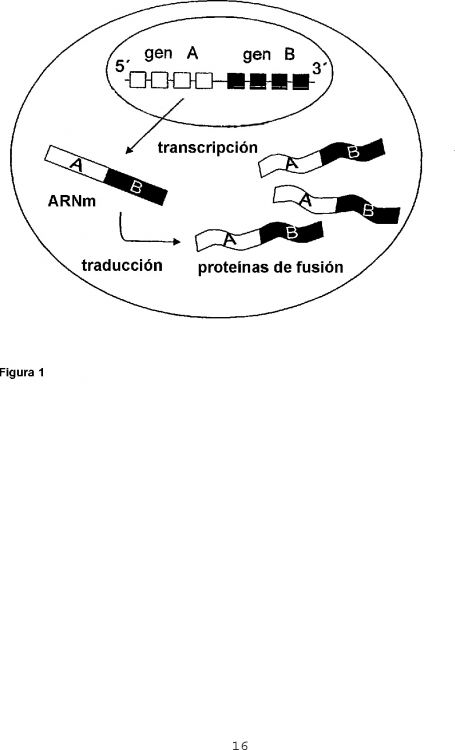
Esta invención se refiere a la detección de, entre otras, proteínas de fusión específicas de un tumor. Más específicamente, la invención se refiere a técnicas que indican la presencia de translocaciones cromosómicas detectando la presencia de una proteína de fusión a nivel de una sola célula. En el diagnóstico de diversos tipos de cáncer, tales como leucemias, linfomas y tumores sólidos, las aberraciones cromosómicas se usan frecuentemente para la clasificación en subgrupos relevantes desde el punto de vista del pronóstico1. Muchas de estas aberraciones cromosómicas dan como resultado genes de fusión, es decir, genes acoplados aberrantemente acoplados vía la parte en dirección de un gen a la parte en dirección del otro gen, o viceversa. Los genes de fusión se pueden transcribir en transcritos de genes de fusión, y se pueden traducir en proteínas de fusión. Generalmente, las proteínas de fusión desempeñan un papel importante en el proceso oncogenético. Hasta ahora, se ha descrito más de un centenar de diferentes genes de fusión y proteínas de fusión en diversos tipos de cáncer2-5 .
El término “cáncer” comprende un grupo heterogéneo de neoplasmas, en el que cada tipo tiene sus propias características cuando se considera su potencial neoplásico y su respuesta a terapia. No es necesario decir que el diagnóstico y clasificación exactos de los diversos tipos de cáncer es preeminente a la hora de ayudar a seleccionar la terapia más eficaz. Además, es esencial un método de diagnóstico que permita la detección de pequeños números de células neoplásicas en un gran escenario de células normales durante terapia, para evaluar la eficacia del tratamiento y para anticipar una recaída inminente.
Las translocaciones cromosómicas se pueden detectar mediante un amplio conjunto de técnicas, la mayoría de las cuales implican tecnología biomolecular moderna. Las técnicas citogenéticas incluyen técnicas de bandeo cromosómico convencionales (cariotipado) e hibridación in situ fluorescente (FISH) que usa sondas marcadas fluorescentemente. Para detectar fusiones de puntos de ruptura cromosómica, como se puede encontrar en translocaciones, inversiones y supresiones cromosómicas, se pueden usar estrategias a base de la reacción en cadena de la polimerasa (PCR), usando cebadores localizados en cada lado del punto de ruptura. La amplificación de ADN sólo se puede usar para aberraciones cromosómicas en las que los puntos de ruptura se agrupan en un área pequeña. En la mayoría de los casos, los puntos de ruptura se extienden sobre grandes regiones intrónicas, pero varias translocaciones, inversiones y supresiones dan lugar a genes de fusión y a transcritos de fusión adecuados para la amplificación mediante PCR después de una etapa de transcripción inversa (RT-PCR).
Las técnicas más usadas habitualmente dirigidas a detectar aberraciones cromosómicas específicas implican el análisis a nivel cromosómico o de ácidos nucleicos (ADN o ARN). Una ventaja de tales marcadores de fusión genética es su implicación directa en la oncogénesis. En consecuencia, su presencia es constante a lo largo de toda la evolución de la enfermedad. Sin embargo, un inconveniente principal de los marcadores de fusión se refiere al hecho de que no se pueden excluir variaciones en el nivel de la transcripción génica y/o traducción génica durante una enfermedad, y particularmente durante la terapia. De este modo, variaciones en la expresión de un transcrito de un gen de fusión o en la expresión de una proteína de fusión hacen difícil correlacionar el nivel de detección del marcador con la cantidad de células neoplásicas. Esto implica que la detección de un producto génico de fusión se lleva a cabo preferiblemente a nivel proteico en células individuales.
Una proteína de fusión comprende partes de al menos dos proteínas que corresponden a y que se transcribieron originalmente por y se tradujeron a partir de los genes separados originalmente. Las proteínas de fusión se caracterizan de forma única por un punto de fusión, en el que se encuentran las dos proteínas. Los puntos de fusión están a menudo expuestos antigénicamente, comprendiendo distintos epítopos que algunas veces se pueden detectar inmunológicamente.
Inicialmente, se hicieron intentos para crear anticuerpos específicos contra proteínas de fusión generando anticuerpos frente a un péptido que corresponde a la región de unión de una proteína de fusión. Este enfoque ha tenido raramente éxito, principalmente debido al hecho de que es difícil encontrar reactivos inmunológicos que sean exclusivamente reactivos con una proteína de fusión y no con las proteínas sin fusionar que normalmente se producen en una célula. Si se obtenían anticuerpos específicos de la fusión, generalmente no eran aplicables a microscopía de fluorescencia o citometría de flujo6-8. Por ejemplo, el anticuerpo ERP-FP1 frente a la proteína de fusión BCR-ABL funciona bien en procedimientos de transferencia Western, pero no tiene éxito en estudios microscópicos sobre leucemias positivas a BCR-ABL humanas6,7. Además, considerando la gran variación dentro de reordenamientos individuales observados en translocaciones cromosómicas, y dependiendo de la localización del punto de ruptura en el gen no aberrante, en el que (incluso cuando se producen las translocaciones dentro de los mismos dos genes) se pueden generar diferentes proteínas de fusión, se considera probable que, dentro de cada caso separado de proteínas de fusión, surjan nuevos puntos de fusión. La detección de proteínas de fusión mediante detección inmunológica específica del epítopo del punto de fusión de la proteína de fusión nunca ha sido por lo tanto ampliamente aplicable.
Un método alternativo para la detección específica de proteínas de fusión implica la aplicación de un denominado anticuerpo de captura, que reconoce una parte de una proteína de fusión, y un anticuerpo de detección marcado, que reconoce otra parte de una proteína de fusión. En tal sistema, un anticuerpo de captura se une a una capa de soporte sólido, tal como una placa de ELISA o una tira reactiva para inmersión. El anticuerpo de captura también se puede inmovilizar sobre perlas que se pueden analizar mediante citometría de flujo9. Tras la incubación de un anticuerpo de captura con un lisado celular que se sospecha que contiene la proteína de fusión, se detecta la proteína de fusión unida mediante un anticuerpo de detección marcado. Aunque elegante y fácil de llevar a cabo, el sistema de anticuerpo de captura/de detección no se puede aplicar de forma práctica para detectar una proteína de fusión intracelular sin destruir la integridad celular. La mayoría de las proteínas de fusión específicas de tumores están localizadas intracelularmente, por ejemplo factores de transcripción nucleares, o moléculas de señalización que residen en el citoplasma o que van y vienen entre el citoplasma y el núcleo. De este modo, un sistema de anticuerpo de captura/de detección no permite la detección de una proteína de fusión intracelular a nivel de una sola célula.
La colocalización de dos anticuerpos marcados diferentemente frente a dos partes diferentes de una proteína de fusión podría en teoría demostrar la presencia de una proteína de fusión en una sola célula. Sin embargo, la prueba completa de la colocalización requiere el análisis mediante microscopía confocal de barrido por láser (CLSM). Incluso entonces generalmente no es sencillo evaluar la colocalización de dos anticuerpos, debido a que las proteínas normales reconocidas, que derivan de los genes normales en los cromosomas no afectados, pueden provocar una tinción de fondo que interfiere con la detección de la proteína de fusión. Además, la CLSM tiene la gran desventaja de que requiere un laboratorio especializado y bien equipado, y un personal entrenado y muy cualificado. Tal técnica altamente especializada y que consume tiempo no es deseable para procedimientos de diagnóstico rutinarios, por ejemplo en un marco clínico.
Todo lo anterior indica que existe una necesidad específica de un método mejorado para detectar una proteína de fusión, que se puede usar preferiblemente en un laboratorio clínico. Particularmente desafiante es la detección de una proteína de fusión intracelular a nivel de una sola célula.
La invención proporciona la idea de que se puede usar la tecnología de transferencia de energía por resonancia de fluorescencia (FRET) para detectar la presencia de una proteína de fusión. La invención proporciona un conjunto de sondas, un kit de diagnóstico...
Reivindicaciones:
1. Un conjunto de al menos una primera y una segunda sonda de FRET para la detección de una proteína de fusión, proteína de fusión la cual comprende un primer sitio diana y un segundo sitio diana situados en lados opuestos de la región de fusión de dicha proteína de fusión, caracterizado porque:
a) la primera sonda (i) comprende un dominio que se une específicamente al primer sitio diana de la proteína de fusión, (ii) está provisto de al menos un primer grupo reactivo, y (iii) está provisto de un primer colorante de FRET;
b) la segunda sonda (i) comprende un dominio que se une específicamente al segundo sitio diana de la proteína de fusión, (ii) está provista de al menos un segundo grupo reactivo, y (iii) está provista de un segundo colorante de FRET;
en el que
c) para evitar la autoasociación de las sondas, los grupos reactivos en la primera sonda no interaccionan directamente con la segunda sonda, y los grupos reactivos en la segunda sonda no interaccionan directamente con la primera sonda;
d) las dos sondas no interaccionan entre sí excepto que se añada una sustancia formadora de puente que reacciona con el primer y segundo grupo reactivo;
e) al añadir la sustancia formadora de puente, los colorantes de FRET se llevan a una distancia de 100 Angstrom entre sí, permitiendo de ese modo la transferencia de energía y la detección de sondas yuxtapuestas.
2. Un conjunto según la reivindicación 1, en el que al menos una sonda está provista de una multiplicidad de grupos reactivos.
3. Un conjunto según las reivindicaciones 1 ó 2, en el que dicha sonda es un anticuerpo o un fragmento de unión funcionalmente equivalente al mismo.
4. Un conjunto según cualquiera de las reivindicaciones 1 a 3, en el que al menos uno de dichos colorantes es un fluorocromo.
5. Un conjunto según la reivindicación 4, en el que dicho fluorocromo se selecciona del grupo que consiste en isotiocianato de fluoresceína (FITC), isotiocianato de tetrametilrodamina (TRITC), Rojo de Tejas (TR), R-ficoeritrina (R-PE), aloficocianina (APC), miembros de las ficobiliproteínas, Cy3, Cy5, Cy5.5, Cy7, colorantes de cianina, colorantes de Alexa Fluor, conjugados en tándem de estos fluorocromos, y colorantes de nanopartículas semiconductoras.
6. Un conjunto según cualquiera de las reivindicaciones 1 a 5, en el que dicho grupo reactivo comprende biotina.
7. Un conjunto según cualquiera de las reivindicaciones 1 a 6, en el que la sustancia formadora de puentes comprende avidina o estreptavidina.
8. Un kit de diagnóstico para la detección de proteínas de fusión en una célula, que comprende un conjunto de sondas según cualquiera de las reivindicaciones 1 a 7.
9. Un método in vitro para detectar la presencia de una proteína de fusión en una célula, en el que la proteína de fusión comprende un primer sitio diana y un segundo sitio diana situados en lados opuestos de la región de fusión de dicha proteína de fusión, comprendiendo dicho método:
(i) poner en contacto una muestra que comprende una célula con un conjunto de al menos una primera y una segunda sonda de FRET según las reivindicaciones 1-8, en condiciones que permitan la unión de dichas sondas a dicha proteína de fusión;
(ii) añadir la sustancia formadora de puentes; y
(iii) detectar la yuxtaposición de dichas sondas vía FRET.
10. Un método según la reivindicación 9, que incluye adicionalmente la etapa de teñir dicha muestra para al menos un marcador celular para definir una población celular diana, comprendiendo el método poner en contacto dicha muestra con un compuesto capaz de unirse selectivamente a dicho marcador celular.
11. Un método según la reivindicación 10, en el que dicho marcador celular es un antígeno del agrupamiento de diferenciación (CD).
12. Un método según cualquiera de las reivindicaciones 9-11, en el que dicha proteína de fusión es una proteína de fusión específica de tumor.
13. Método según cualquiera de las reivindicaciones 9 a 12, en el que la señal de FRET se detecta mediante citometría de flujo, permitiendo de ese modo la detección a nivel de una sola célula.
Patentes similares o relacionadas:
Composiciones para la supresión del cáncer por inhibición de TMCC3, del 29 de Julio de 2020, de Development Center For Biotechnology: Un anticuerpo contra la proteína con dominios de superhélice transmembrana 3 (TMCC3), o un fragmento de unión de la misma, en donde el anticuerpo […]
Métodos para detectar distintivos de enfermedades o afecciones en fluidos corporales, del 15 de Julio de 2020, de PRESIDENT AND FELLOWS OF HARVARD COLLEGE: Un método in vitro para diagnosticar la presencia de un agente infeccioso en un individuo que comprende los pasos de: obtener un primer perfil de expresión […]
Biomarcadores de pronóstico y predictivos y aplicaciones biológicas de los mismos, del 1 de Julio de 2020, de INSTITUT GUSTAVE ROUSSY: Un método para evaluar la sensibilidad o la resistencia de un tumor frente a un agente antitumoral, que comprende evaluar la cantidad de complejo eiF4E-eiF4G (complejo Cap-ON) […]
Métodos para clasificar pacientes con un cáncer sólido, del 24 de Junio de 2020, de INSERM (INSTITUT NATIONAL DE LA SANTE ET DE LA RECHERCHE MEDICALE): Un método in vitro para el pronóstico del tiempo de supervivencia de un paciente que padece un cáncer sólido, cuyo método comprende los siguientes […]
Procedimiento de detección del cáncer, del 24 de Junio de 2020, de Sienna Cancer Diagnostics Ltd: La presente invención proporciona un procedimiento para resolver una evaluación citológica no concluyente de células epiteliales de vejiga en […]
Método para el diagnóstico/pronóstico de cáncer colorrectal, del 17 de Junio de 2020, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS (CSIC): La presente invención se refiere a un método de obtención de datos útiles para el diagnóstico, el pronóstico o la monitorización de la evolución de cáncer colorrectal (CCR), […]
Método de deducción de un valor de positividad de biomarcador en porcentaje para células seleccionadas presentes en un campo de visión, del 10 de Junio de 2020, de NOVARTIS AG: Método de deducción de un valor para el % de positividad de biomarcador (PBP) para todas las células u, opcionalmente, uno o más subconjuntos de las […]
Medios y métodos para la predicción de la respuesta a un tratamiento de un paciente con cáncer, del 10 de Junio de 2020, de Grabe, Niels: Un método para predecir si un paciente con cáncer con un tumor sólido responde a un tratamiento con quimioterapia, que comprende las etapas que consisten […]