RECONOCIMIENTO DE PRODUCTOS GENICOS ESPECIFICOS DE TUMORES EN CANCER.
Un método para detectar aberraciones cromosó-micas en una muestra biológica vía detección citométrica de flujo de diferentes tipos de productos génicos específicos de tumores simultáneamente en un ensayo de un solo tubo,
usando al menos una sonda de captura unida a perla y una sonda de detección dirigida contra cada producto génico, siendo cada sonda reactiva con sitios distintos en dicho producto génico
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/NL2001/000945.
Solicitante: ERASMUS UNIVERSITEIT ROTTERDAM.
Nacionalidad solicitante: Países Bajos.
Dirección: DR. MOLEWATERPLEIN 50 3015 GE ROTTERDAM PAISES BAJOS.
Inventor/es: VAN DONGEN,JACOBUS,JOHANNES,MARIA, VAN DER VELDEN,VINCENT,HENRICUS,JOHANNES.
Fecha de Publicación: .
Fecha Solicitud PCT: 28 de Diciembre de 2001.
Fecha Concesión Europea: 21 de Julio de 2010.
Clasificación Internacional de Patentes:
- G01N33/537 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › con separación del complejo inmunológico del antígeno o del anticuerpo no ligados.
- G01N33/574V6
Clasificación PCT:
- G01N33/574 G01N 33/00 […] › para el cáncer.
- G01N33/58 G01N 33/00 […] › en los que intervienen sustancias marcadas (G01N 33/53 tiene prioridad).
Clasificación antigua:
- G01N33/574 G01N 33/00 […] › para el cáncer.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
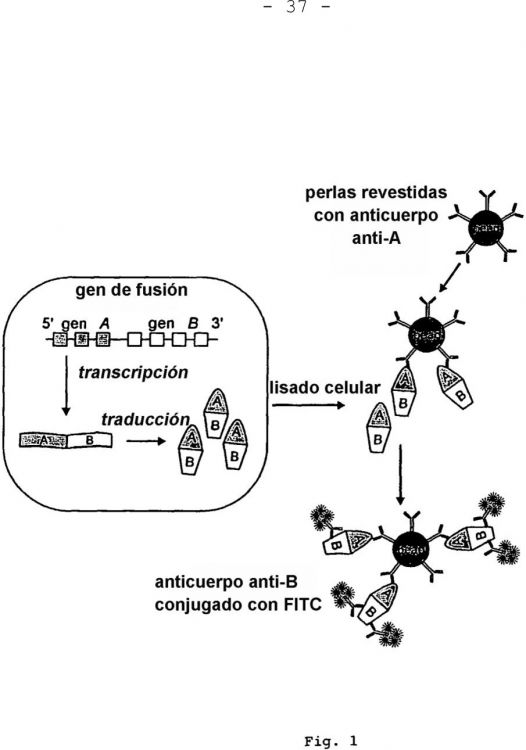
Fragmento de la descripción:
Esta invención se refiere al campo del diagnóstico 5 del cáncer y la aplicación de técnicas de diagnóstico en patología y hematología. Específicamente, la invención se refiere a técnicas que indican la presencia de aberracio-nes cromosómicas detectando productos génicos específicos de tumores que son expresados exclusivamente por células 10 tumorales, que contienen los cromosomas.
Antecedentes de la Invención
Las anormalidades o aberraciones cromosómicas son 15 la causa principal de trastornos o enfermedades genéti-cas, incluyendo trastornos congénitos y enfermedades ad-quiridas, tales como cánceres. Las células cancerosas tienen un origen clónico común puesto que se cree que se originan de una única célula que crece de forma autónoma 20 que se apartó de las señales reguladoras del crecimiento ambiental.
El término “cáncer” comprende un grupo heterogéneo de neoplasmas, en los que cada tipo tiene su propia ca-racterística cuando se considera su potencial maligno y 25 su respuesta a terapia. Actualmente, la eficacia del tra-tamiento del cáncer se determina empíricamente. Depen-diendo del momento en el tiempo en el desarrollo del cáncer, el origen y extensión del cáncer, y del estado fisiológico del paciente, se selecciona el tratamiento 30 más apropiado y más eficaz. Actualmente, se pueden reali-zar selecciones a partir de un tratamiento quirúrgico,
terapia de radiación y quimioterapia (o combinación de estas terapias). Incluso, se aprecia que cada terapia comporta efectos secundarios que comprometen enormemente a los beneficios del tratamiento. No es necesario decir que el diagnóstico exacto de los diversos tipos de cáncer 5 es preeminente a la hora de ayudar a seleccionar la tera-pia más eficaz.
La base del cáncer deriva de aberraciones cromosó-micas tales como translocaciones, inversiones, insercio-nes, supresiones y otras mutaciones en o entre los cromo-10 somas. A menudo, un cromosoma o dos cromosomas diferentes están implicados en el desarrollo de cánceres. De este modo, los genes o fragmentos de genes se retiran del con-texto fisiológico normal del cromosoma no aberrante y se fusionan con o encuentran una localización en un cromoso-15 ma receptor (ya sea el mismo o un segundo cromosoma) ad-yacente a genes o fragmentos de genes no relacionados (a menudo oncogenes o protooncogenes), en los que la nueva combinación genética puede encontrar el fundamento de un cáncer. 20
Los reordenamientos, tales como translocaciones, ocurren a menudo en un patrón en cierto modo establecido, en el que los genes, o sus fragmentos, se eliminan del cromosoma no aberrante en un punto de ruptura o una re-gión de agrupamiento de puntos de ruptura, y se insertan 25 en el cromosoma receptor en una región de fusión, creando de ese modo genes reordenados, suprimidos, translocados o fusionados que son específicos para ese cáncer específi-co. Además, los reordenamientos o translocaciones pueden ser recíprocos, por cuanto dos cromosomas intercambian 30 partes que conducen a células que contienen dos cromoso-mas recíprocamente reordenados los cuales contienen nue-
vos genes fusionados.
Cuando el gen fusionado se traduce, genera un pro-ducto génico, ARNm, que es único para el tumor. El ARNm quimérico comprende partes o fragmentos de dos ARNm que corresponden a y que se transcribieron originalmente por 5 los genes originalmente separados. Este ARNm específico del tumor se caracteriza de forma única por un punto de fusión, en el que se encuentran los fragmentos de ARN. En algunos casos, estos puntos de fusión se pueden detectar hibridando sondas de ácido nucleico. Sin embargo, consi-10 derando la gran variación en los reordenamientos indivi-duales observada en estas translocaciones y dependiendo de la localización del punto de ruptura en el gen no abe-rrante en la que (incluso cuando las translocaciones se producen en los mismos dos genes) se pueden generar dife-15 rentes genes específicos de tumores, se considera proba-ble que en cada caso separado de estos tipos de cáncer surjan nuevos puntos de fusión. Por lo tanto, la detec-ción de cáncer mediante detección específica del punto de fusión del producto génico (ARNm) específico del tumor 20 nunca se ha aplicado ampliamente.
Cuando el gen fusionado se fusiona en el marco, el ARNm fusionado se traduce en una proteína de fusión que es única para el tumor. La proteína comprende partes de dos proteínas que corresponden a y fueron transcritas 25 originalmente por y traducidas a partir de los genes ori-ginalmente separados. Las proteínas específicas de tumo-res se caracterizan de forma única por un punto de fu-sión, en el que se empalman las dos proteínas. Los puntos de fusión están expuestos antigénicamente, comprendiendo 30 distintos epítopos que algunas veces se pueden detectar inmunológicamente. Sin embargo, considerando la gran va-
riación dentro de los reordenamientos individuales obser-vada en estas translocaciones y dependiendo de la locali-zación del punto de ruptura en el gen no aberrante en el que (incluso cuando las translocaciones se producen de-ntro de los mismos dos genes) se pueden generar diferen-5 tes genes específicos de tumores, se considera probable que dentro de cada caso separado de estos tipos de cáncer surjan nuevos puntos de fusión. Por lo tanto, la detec-ción de cáncer mediante detección específica del epítopo de punto de fusión de la proteína específica de tumores 10 nunca se ha aplicado ampliamente. Los productos génicos específicos de tumores (productos de fusión) del gen fu-sionado o reordenado pueden contribuir al desarrollo pos-terior del cáncer.
Un área en el que las aberraciones cromosómicas 15 están relativamente bien estudiadas (en comparación con otros tipos de cáncer) es el campo de la leucemia. Compa-rable con los tumores más cancerígenos, las leucemias di-fieren en el grado de diferenciación de las células tumo-rales. Según la presentación clínica, las leucemias se 20 dividen en formas agudas y crónicas, dependiendo de la rapidez con la que evolucionan y, si no son tratadas, provocan la muerte. Dependiendo de la estirpe o estirpes celulares implicadas en el proceso leucémico, las leuce-mias agudas se clasifican como leucemias linfoblásticas 25 agudas (ALL) y leucemias no linfoblásticas agudas (ANLL), produciéndose las ALL, el tipo más predominante (>80%) en la niñez. Las leucemias crónicas son cánceres en los que las células leucémicas proliferantes descontroladas son capaces de madurar. Se distinguen dos subtipos de leuce-30 mia crónica, la leucemia linfocítica crónica (CLL) y la leucemia mieloide crónica (CML). Dentro de estos cuatro
grupos, se observa una considerable heterogeneidad en la biología y pronóstico, que actualmente se estratifica por características morfológicas. Esta estratificación tiene todavía poco valor en cuanto a una comprensión y predic-ción del pronóstico de un paciente leucémico y al diseño 5 racional de la terapia. Sin embargo, estudios genéticos moleculares recientes de pacientes leucémicos han demos-trado que se puede encontrar una amplia variedad de abe-rraciones cromosómicas con las diversas formas de leuce-mia. Un grupo consiste en reordenamientos del gen del re-10 ceptor de células T (TCR) o de inmunoglobulina (IG), que comprenden reordenamientos de genes antígeno-receptor que van más allá de los procesos fisiológicos normales que se requieren para generar la diversidad de las moléculas re-ceptoras de antígenos que tipifican la población de célu-15 las linfoides. En un gran grupo de reordenamientos de IG y TCR que se sabe que están asociados con leucemia, se expresan moléculas receptoras de antígenos específicas de tumores. Otro grupo de aberraciones comprende supresiones de un gen completo o partes de un gen de un genoma. Como 20 resultado de la supresión, las regiones promotoras que normalmente pertenecen al gen ahora suprimido pueden ejercer control sobre otro gen, dando como resultado la transcripción aberrante del gen. Un ejemplo es la supre-sión de las regiones codificantes del gen SIL en células 25 T, que da como resultado la transcripción del gen TAL-1 normalmente no expresado en células T, dando como resul-tado la expresión ectópica de la proteína de fusión de TAL-1. Aún otro grupo comprende translocaciones de frag-mentos génicos entre cromosomas, dando como resultado ge-30 nes de fusión que bien pueden transcribir proteínas de fusión únicas que contribuyen al desarrollo del cáncer.
Ejemplos bien conocidos son las translocaciones...
Reivindicaciones:
Reivindicaciones
1. Un método para detectar aberraciones cromosó-micas en una muestra biológica vía detección citométrica de flujo de diferentes tipos de productos génicos especí-5 ficos de tumores simultáneamente en un ensayo de un solo tubo, usando al menos una sonda de captura unida a perla y una sonda de detección dirigida contra cada producto génico, siendo cada sonda reactiva con sitios distintos en dicho producto génico. 10
2. El método de la reivindicación 1, en el que dichos productos génicos específicos de tumores son ARNm específicos de tumores que codifican proteínas específi-cas de tumores, y en el que dichas sondas son sondas de ácido nucleico. 15
3. El método de la reivindicación 1, en el que dichos productos génicos específicos de tumores son pro-teínas específicas de tumores, y en el que dichas sondas son sondas de anticuerpos.
4. El método según la reivindicación 2 ó 3, en 20 el que las diferentes proteínas específicas de tumores comprenden cada una un fragmento proteico amino-terminal y un fragmento carboxi-terminal los cuales corresponden cada uno a una proteína no específica de tumores diferen-te. 25
5. El método según la reivindicación 4, en el que al menos una sonda es específicamente reactiva con el fragmento proteico amino-terminal, y al menos una sonda es específicamente reactiva con el fragmento proteico carboxi-terminal. 30
6. El método según una cualquiera de las reivindicaciones 1 a 5, en el que dichos productos génicos di-
ferentes específicos de tumores derivan de translocacio-nes variantes de un gen diana fusionado a diferentes ge-nes compañeros.
7. El método según la reivindicación 6, en el que dicho gen diana es MLL, RARA, ALK o EWS. 5
8. El método según una cualquiera de las reivindicaciones 1 a 5, en el que los diferentes tipos de pro-ductos génicos específicos de tumores derivan de translo-caciones con puntos de ruptura variantes.
9. El método de la reivindicación 8, en el que 10 los diferentes tipos de productos génicos específicos de tumores están provocados por diferentes regiones de pun-tos de ruptura en el gen BCR de t(9;22).
10. El método de la reivindicación 9, en el que el punto de ruptura está en la región principal de agru-15 pamiento de puntos de ruptura (M-bcr), la región menor de agrupamiento de puntos de ruptura (m-bcr) o la región mi-cro de agrupamiento de puntos de ruptura (-bcr).
11. El método según una cualquiera de las reivindicaciones 1 a 10, en el que al menos una sonda está mar-20 cada con un fluorocromo.
12. El método según una cualquiera de las reivindicaciones 1 a 11, que usa perlas revestidas con una úni-ca sonda de captura en combinación con sondas de detec-ción conjugadas diferentemente. 25
13. El método según una cualquiera de las reivindicaciones 1 a 12, en el que se usan diferentes tipos de perlas para discriminar entre diferentes tipos de produc-tos génicos específicos de tumores.
14. El método según la reivindicación 13, en el 30 que las perlas difieren en tamaño, color o intensidad del fluorocromo conjugado, o características de dispersión
lateral.
15. El método según una cualquiera de las reivindicaciones 1 a 14, que comprende detectar diferentes ti-pos de productos génicos específicos de tumores en una categoría de enfermedad, preferiblemente en un trastorno 5 hematopoyético.
16. El método según la reivindicación 15, en el que la enfermedad se selecciona de leucemia mieloide crónica (CML), leucemia mieloide aguda (AML) y leucemia linfoblástica aguda (ALL). 10
17. El método según la reivindicación 15 ó 16, que comprende la detección de una aberración del cromoso-ma de Filadelfia.
18. El método según una cualquiera de las reivindicaciones 1 a 17, que comprende la detección simultánea 15 de al menos dos productos génicos específicos de tumores seleccionados del grupo que consiste en AML1-ETO, PML-RARA, CBFB-MYH11, E2A-PBX1, MLL-AF4, BCR-ABL y TEL-AML1.
19. El método según una cualquiera de las reivindicaciones 1 a 17, que comprende la detección simultánea 20 de al menos dos productos génicos específicos de tumores seleccionados del grupo que consiste en MLL-AF4, MLL-AF6, MLL-AF9, MLL-ENL, MLL-AF10, MLL-ELL, PML-RARA, PLZF-RARA, NPM-RARA, NUMA-RARA, NPM-ALK, TPM3-ALK, TFG-ALK, ATIC-ALK, EWS-FLI1, EWS-ERG y EWS-ETV1. 25
20. El método según una cualquiera de las reivindicaciones 1 a 19, en el que se selecciona al menos una sonda, preferiblemente al menos dos sondas, del grupo que consiste en un anticuerpo que reconoce específicamente un fragmento AML1 de la proteína de fusión AML1-ETO, un an-30 ticuerpo que reconoce específicamente un fragmento MLL de la proteína de fusión MLL-AF4, un anticuerpo que reconoce
específicamente un fragmento RARA de una proteína de fu-sión TML-RARA, un anticuerpo que reconoce específicamente un fragmento TEL de una proteína de fusión TEL-AML1, un anticuerpo que reconoce específicamente un fragmento ETO de una proteína de fusión AML1-ETO, un anticuerpo que re-5 conoce específicamente un fragmento PML de una proteína de fusión PML-RARA, un anticuerpo que reconoce específi-camente un fragmento CBFB de una proteína de fusión CBFB-MYH11, un anticuerpo que reconoce específicamente un fragmento MYH11 de una proteína de fusión CBFB-MYH11, un 10 anticuerpo que reconoce específicamente un fragmento E2A de una proteína de fusión E2A-PBX1, un anticuerpo que re-conoce específicamente un fragmento PBX1 de una proteína de fusión E2A-PBX1, un anticuerpo que reconoce específi-camente un fragmento AF4 de una proteína de fusión MLL-15 AF4, un anticuerpo que reconoce específicamente un frag-mento BCR de una proteína de fusión BCR-ABL, y un anti-cuerpo que reconoce específicamente un fragmento ABL de una proteína de fusión BCR-ABL.
21. El método según una cualquiera de las reivin-20 dicaciones 1 a 19, en el que se selecciona al menos una sonda, preferiblemente al menos dos sondas, del grupo que consiste en anticuerpos que reconocen específicamente fragmentos MLL de proteínas de fusión MLL-AF4, MLL-AF6, MLL-AF9, MLL-AF10, MLL-ENL o MLL-ELL, anticuerpos que re-25 conocen específicamente un fragmento RARA de la proteína de fusión PML-RARA, PLZF-RARA, NPM-RARA o NUMA-RARA, an-ticuerpos que reconocen específicamente un fragmento ALK de la proteína de fusión NPM-ALK, TPM3-ALK, TFG-ALK o ATIC-ALK, anticuerpos que reconocen específicamente un 30 fragmento EWS de la proteína de fusión EWS-FLI1, ESW-ERG o EWS-ETV1, un anticuerpo que reconoce específicamente un
fragmento PML de una proteína de fusión PML-RARA, un an-ticuerpo que reconoce específicamente un fragmento AF4 de una proteína de fusión MLL-AF4, un anticuerpo que recono-ce específicamente un fragmento AF9 de una proteína de fusión MLL-AF9, un anticuerpo que reconoce específicamen-5 te un fragmento ENL de una proteína de fusión MLL-ENL, un anticuerpo que reconoce específicamente un fragmento AF6 de una proteína de fusión MLL-AF6, un anticuerpo que re-conoce específicamente un fragmento AF10 de una proteína de fusión MLL-AF10, un anticuerpo que reconoce específi-10 camente un fragmento ELL de una proteína de fusión MLL-ENL, un anticuerpo que reconoce específicamente un frag-mento PLZF de una proteína de fusión PLZF-RARA, un anti-cuerpo que reconoce específicamente un fragmento NPM de una proteína de fusión NPM-RARA o NPM-ALK, un anticuerpo 15 que reconoce específicamente un fragmento NUMA de una proteína de fusión NUMA-RARA, un anticuerpo que reconoce específicamente un fragmento TPM3 de una proteína de fu-sión TPM3-ALK, un anticuerpo que reconoce específicamente un fragmento TFG de una proteína de fusión TFG-ALK, un 20 anticuerpo que reconoce específicamente un fragmento ATIC de una proteína de fusión ATIC-ALK, un anticuerpo que re-conoce específicamente un fragmento FLI1 de una proteína de fusión EWS-FLI1, un anticuerpo que reconoce específi-camente un fragmento ERG de una proteína de fusión EWS-25 ERG y un anticuerpo que reconoce específicamente un frag-mento ETV1 de una proteína de fusión EWS-ETV1.
22. Uso de un método según una cualquiera de las reivindicaciones 1 a 21 en la detección o identificación de cáncer. 30
Patentes similares o relacionadas:
Ensayos de cambio de movilidad homogéneos indirectos para la detección de agentes biológicos en muestras de pacientes, del 24 de Abril de 2019, de SOCIETE DES PRODUITS NESTLE S.A.: Un método para determinar la presencia o el nivel de un agente biológico en una muestra, comprendiendo el método: (a) poner en contacto la muestra con […]
Procedimiento para la medición de vitamina D, del 23 de Enero de 2019, de F. HOFFMANN-LA ROCHE AG: Un procedimiento in vitro para determinar la concentración de 25-hidroxivitamina D sin interferencia por 24,25-dihidroxivitamina D3, comprendiendo el procedimiento […]
Ensayo para entactógenos, del 18 de Abril de 2018, de SIEMENS HEALTHCARE DIAGNOSTICS INC.: Un compuesto de la fórmula: **(Ver fórmula)** en la que: R1 es H, alquilo inferior o un grupo protector, en el que el término alquilo inferior representa un radical […]
Método y sistema para analizar una muestra de sangre, del 28 de Junio de 2017, de BECKMAN COULTER, INC.: Un método para detectar células difíciles de acromizar, que se definen como células que retienen al menos 30 % de su contenido de hemoglobina original […]
Análisis de citometría de flujo de materiales adsorbidos en sales metálicas, del 5 de Abril de 2017, de GLAXOSMITHKLINE BIOLOGICALS SA: Un procedimiento para analizar un componente que está adsorbido en una sal metálica insoluble, que comprende las etapas de: (i) marcar el componente adsorbido […]
Marcadores colorantes fluorescentes que contienen sulfonamida N,N-disustituida biocompatible, del 11 de Enero de 2017, de VISEN MEDICAL, INC.: Un compuesto representado por la siguiente fórmula estructural:**Fórmula** o una sal del mismo, en la que: X1 y X2 se seleccionan independientemente entre […]
Métodos para identificar inmunoaglutinantes de antígenos de superficie celular, del 7 de Diciembre de 2016, de ESBATech, an Alcon Biomedical Research Unit LLC: Un método para identificar una célula que expresa anticuerpo que se une específicamente a un antígeno de superficie celular de interés, que comprende: (a) proporcionar […]
Sensor de inmunoensayo mejorado, del 13 de Enero de 2016, de UNIVERSAL BIOSENSORS, PTY. LTD: Un dispositivo para la detección de un analito diana en una muestra de fluido, comprendiendo el dispositivo: una cámara de reacción, en donde la cámara […]