Detección inmunocromatográfica de Staphylococcus multirresistente y kit de diagnóstico.
Un procedimiento para detectar una bacteria que produce proteína de unión a penicilina 2',
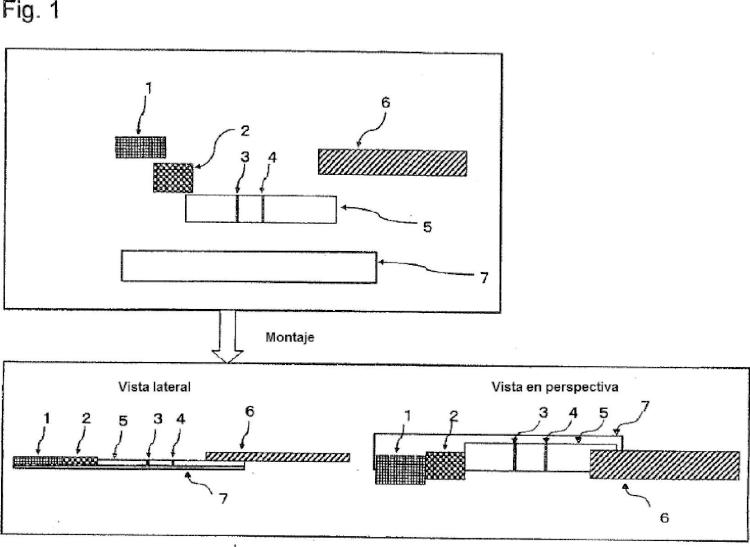
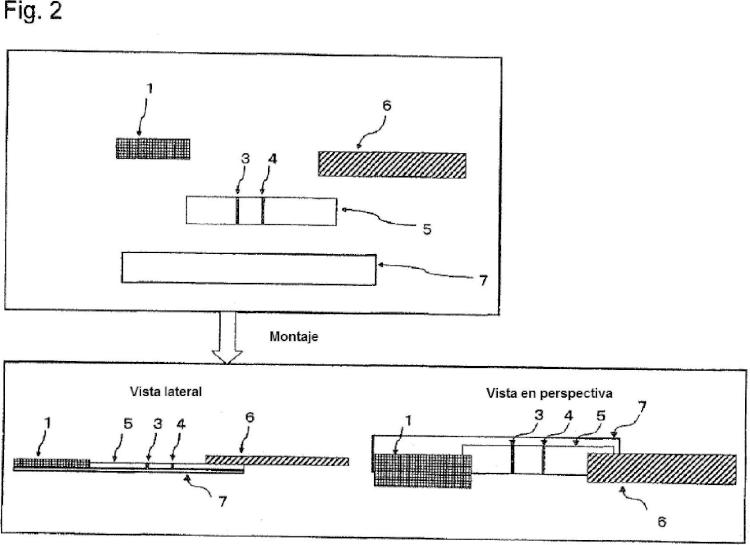
que comprende la detección la enzima sintetizadora de pared celular proteína de unión a penicilina 2' mediante detección inmunocromatográfica basada en una reacción de antígeno-anticuerpo, que implica el uso de un dispositivo de detección inmunocromatográfica que comprende sobre un soporte en fase sólida similar a una lámina: un sitio de suministro de muestra al que se suministra una solución de muestra que se deduce que contiene una bacteria productora de la enzima sintetizadora de pared celular proteína de unión a penicilina 2' o una solución de muestra que se deduce que contiene una proteína de unión a penicilina 2' liberada de la pared celular mediante pretratamiento de muestra; un sitio de reactivo marcado que mantiene un reactivo que es un anticuerpo marcado que se une específicamente a proteína de unión a penicilina 2' de tal manera que el reactivo se extienda por el soporte en fase sólida y un sitio de reactivo de captura en que se ha inmovilizado un reactivo de captura que es un anticuerpo que se une específicamente a un sitio que es diferente del sitio al que se une el anticuerpo marcado y que captura un complejo de proteína de unión a penicilina 2' y reactivo marcado; en el que el sitio de reactivo de captura comprende un tensioactivo de tipo sulfobetaína seleccionado del grupo consistente en CHAPS, CHAPSO, sulfobetaína de miristilo (SB3-14) y butanosulfonato de dodecildimetilamonio (DDABS), comprendiendo el procedimiento suministrar la solución de muestra al sitio de suministro de muestra.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/JP2006/324905.
Solicitante: DENKA SEIKEN CO., LTD..
Nacionalidad solicitante: Japón.
Dirección: 1-1, Nihonbashi Muromachi 2-chome, Chuo-ku Tokyo 103-8338 JAPON.
Inventor/es: ITO,HIROMI.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- G01N33/531 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › Producción de materiales de investigación o de análisis inmunoquímicos.
- G01N33/543 G01N 33/00 […] › con un soporte insoluble para la inmovilización de compuestos inmunoquímicos.
- G01N33/569 G01N 33/00 […] › para microorganismos, p. ej. protozoarios, bacterias, virus.
PDF original: ES-2553153_T3.pdf
Patentes similares o relacionadas:
Método de determinación de la presencia y/o cantidad de moléculas diana, del 22 de Julio de 2020, de Canopy Biosciences, LLC: Método para el análisis de células individuales en una muestra de sangre mediante la determinación de la presencia y/o cantidad de una o más moléculas […]
Kit de reactivos utilizado para detectar gastrina-17 y método de preparación y aplicación para el kit de reactivos, del 15 de Julio de 2020, de Shenzhen New Industries Biomedical Engineering Co., Ltd: Un kit para detectar gastrina-17, caracterizado porque comprende un componente A y un componente B, en donde el componente A es un primer […]
Un sustrato para inmovilizar sustancias funcionales y un método para preparar las mismas, del 15 de Julio de 2020, de Temasek Polytechnic: Un sustrato sólido que tiene compuestos dispuestos sobre el mismo, en donde se inmoviliza una molécula funcional sobre los compuestos, teniendo cada compuesto una cadena que […]
Análisis biológico autónomo de alta densidad, del 1 de Julio de 2020, de BioFire Diagnostics, LLC: Recipiente para realizar reacciones de amplificación en un sistema cerrado que comprende una porción flexible que tiene una serie de blísteres […]
Chip de análisis y aparato de análisis de muestras, del 1 de Julio de 2020, de Takano Co., Ltd: Un chip de análisis que comprende: un sustrato conformado sustancialmente en forma de disco; un puerto de inyección formado […]
Dispositivo para la detección de analitos, del 1 de Julio de 2020, de TECHLAB, INC.: Un dispositivo para detectar por lo menos una sustancia de interés en una muestra líquida, comprendiendo el dispositivo: (a) una unidad que […]
Estructuras para controlar la interacción de luz con dispositivos microfluídicos, del 3 de Junio de 2020, de Opko Diagnostics, LLC: Un sistema de ensayo múltiplex que comprende: un artículo que soporta ensayos en fase sólida, comprendiendo dicho artículo un sustrato plano rígido y comprendiendo […]
Uso de un estándar para la detección de agregados de proteínas de una enfermedad por plegamiento incorrecto de proteínas, del 27 de Mayo de 2020, de FORSCHUNGSZENTRUM JULICH GMBH: Uso de un estándar, que comprende una nanopartícula inorgánica con un tamaño de 2 a 200 nm, en cuya superficie ya sea mediante i) ácido carboxílico-espaciador-maleimida […]