DERIVADOS DE ESPIROINDOLINA.
Un método de combatir y reprimir insectos, ácaros, nematodos o moluscos,
que comprende aplicar a una plaga, a un lugar de una plaga o a una planta susceptible de ser atacada por una plaga una cantidad, eficaz como insecticida, acaricida, nematocida o molusquicida, de un compuesto de fórmula (I): en donde Y es un enlace sencillo, C=O o SO2;R1 es hidrógeno, alquilo C1-6, haloalquilo C1-6, alcoxi C1-6-alquilo (C1-6), heteroaril-alquilo (C1-6) (en donde el grupo heteroarilo puede estar opcionalmente sustituido con halo, nitro, ciano, alquilo C1-6, haloalquilo C1-6, alcoxi C1-6, haloalcoxi C1-6, alquil C1-6-sulfonilo, alquil C1-6-sulfinilo, alquiltio C1-6, alcoxi C1-6-carbonilo, alquil C1-6-carbonilamino, fenilcarbonilo, o dos posiciones adyacentes en el sistema de heteroarilo pueden estar cicladas para formar un anillo carbocíclico o heterocíclico de 5, 6 ó 7 miembros, este mismo opcionalmente sustituido con halógeno), fenil-alquilo C1-6 (en donde el grupo fenilo puede estar opcionalmente sustituido con halógeno, alquilo C1-4, alcoxi C1-4, haloalquilo C1-4, haloalcoxi C1-4, CN, NO2, fenilo, heteroarilo, amino o dialquilamino, alquil C1-6-sulfonilo, alquil C1-6-sulfinilo, alquiltio C1-6, alcoxi C1-6-carbonilo, alquil C1-6-carbonilamino, fenilcarbonilo, o dos posiciones adyacentes en el anillo de fenilo pueden estar cicladas para formar un anillo carbocíclico o heterocíclico de 5, 6 ó 7 miembros, este mismo opcionalmente sustituido con halógeno), alquil C1-6-carbonilamino-alquilo (C1-6), fenilo (que puede estar opcionalmente sustituido con halógeno, alquilo C1-4, alcoxi C1-4, haloalquilo C1-4, haloalcoxi C1-4, CN, NO2, fenilo, heteroarilo, amino o dialquilamino, alquil C1-6-sulfonilo, alquil C1-6-sulfinilo, alquiltio C1-6, alcoxi C1-6-carbonilo, alquil C1-6-carbonilamino, fenilcarbonilo, o dos posiciones adyacentes en el anillo de fenilo pueden estar cicladas para formar un anillo carbocíclico o heterocíclico de 5, 6 ó 7 miembros, este mismo opcionalmente sustituido con halógeno), heteroarilo (que puede estar opcionalmente sustituido con halo, nitro, ciano, alquilo C1-6, haloalquilo C1-6, alcoxi C1-6, haloalcoxi C1-6, alquil C1-6-sulfonilo, alquil C1-6-sulfinilo, alquiltio C1-6, alcoxi C1-6-carbonilo, alquil C1-6-carbonilamino, fenilcarbonilo, o dos posiciones adyacentes en el sistema de heteroarilo pueden estar cicladas para formar un anillo carbocíclico o heterocíclico de 5, 6 ó 7 miembros, este mismo opcionalmente sustituido con halógeno), alcoxi C1-6, haloalcoxi C1-6, fenoxi (en donde el grupo fenilo está opcionalmente sustituido con halógeno, alquilo C1-4, alcoxi C1-4, haloalquilo C1-4, haloalcoxi C1-4, CN, NO2, fenilo, heteroarilo, amino o dialquilamino), heteroariloxi (opcionalmente sustituido con halo, nitro, ciano, alquilo C1-6, haloalquilo C1-6, alcoxi C1-6 o haloalcoxi C1-6), heterocicliloxi (opcionalmente sustituido con halo, alquilo C1-6, haloalquilo C1-6, alcoxi C1-6 o haloalcoxi C1-6), ciano, alquenilo C2-6, cicloalquilo C3-6, cicloalquenilo C5-7, heterociclilo (opcionalmente sustituido con halo, ciano, alquilo C1-6, haloalquilo C1-6, alcoxi C1-6 o haloalcoxi C1-6), alquiltio C1-6, haloalquiltio C1-6, NR13R14, en que R13 y R14 son independientemente hidrógeno, COR40, alquilo C2-6, haloalquilo C2-6, fenilo (que puede estar opcionalmente sustituido con halógeno, alquilo C1-4, alcoxi C1-4, haloalquilo C1-4, haloalcoxi C1-4, CN, NO2, fenilo, heteroarilo, amino, dialquilamino, alcoxi C1-4-carbonilo) o heteroarilo (que puede estar opcionalmente sustituido con halo, nitro, ciano, alquilo C1-6, haloalquilo C1-6, alcoxi C1-6, haloalcoxi C1-6, alcoxi C1-4-carbonilo); alquil C1-6-carbonilamino, feniloxicarbonilamino (en donde el grupo fenilo está opcionalmente sustituido con halógeno, alquilo C1-4, alcoxi C1-4, haloalquilo C1-4, haloalcoxi C1-4, CN, NO2, fenilo, heteroarilo, amino o dialquilamino), amino, alquil C1-6-amino, fenilamino (en donde el grupo fenilo está opcionalmente sustituido con halógeno, alquilo C1-4, alcoxi C1-4, haloalquilo C1-4, haloalcoxi C1-4, CN, NO2, fenilo, heteroarilo, amino o dialquilamino); R2 y R3 son independientemente hidrógeno o alquilo C1-4; cada uno de R4 es independientemente halógeno, ciano, alquilo C1-8, haloalquilo C1-8, ciano-alquilo C1-8, alcoxi C1-6-alquilo (C1-6), alquinilo C2-6, trimetilsilil-alquinilo (C2-6), alcoxi C1-6-carbonilo, cicloalquilo C3-7, alquil C1-3-cicloalquilo (C3-7), fenilo (opcionalmente sustituido con halógeno, alquilo C1-4, alcoxi C1-4, haloalquilo C1-4, haloalcoxi C1-4, CN, NO2, fenilo, heteroarilo, amino o dialquilamino), heterociclilo (opcionalmente sustituido con halo, nitro, ciano, alquilo C1-6, haloalquilo C1-6, alcoxi C1-6 o haloalcoxi C1-6), alcoxi C1-8, haloalcoxi C1-6, fenoxi (opcionalmente sustituido con halógeno, alquilo C1-4, alcoxi C1-4, haloalquilo C1-4, haloalcoxi C1-4, CN, NO2, fenilo, heteroarilo, amino o dialquilamino), heteroariloxi (opcionalmente sustituido con halo, nitro, ciano, alquilo C1-3, haloalquilo C1-3, alcoxi C1-3 o haloalcoxi C1-3), dialquil (C1-8)-amino, ó 2 grupos R4 adyacentes, junto con los átomos de carbono a los que están unidos, forman un anillo carbocíclico o heterocíclico de 4, 5, 6 ó 7 miembros que puede estar opcionalmente sustituido con halógeno; n es 0, 1, 2, 3 ó 4; R8 es alquilo C1-6, haloalquilo C1-6, fenil-alquilo (C1-4) (en donde el grupo fenilo está opcionalmente sustituido con halógeno, alquilo C1-4, alcoxi C1-4, haloalquilo C1-4, haloalcoxi C1-4, CN, NO2, fenilo, heteroarilo, amino o dialquilamino), heteroaril-alquilo (C1-6) (en donde el grupo heteroarilo está opcionalmente sustituido con halógeno, alquilo C1-4, alcoxi C1-4, haloalquilo C1-4, haloalcoxi C1-4, CN, NO2, fenilo, heteroarilo, amino o dialquilamino), alquenilo C2-6, fenil-alquenilo (C2-6) (en donde el grupo fenilo está opcionalmente sustituido con halógeno, alquilo C1-4, alcoxi C1-4, haloalquilo C1-4, haloalcoxi C1-4, CN, NO2, fenilo, heteroarilo, amino o dialquilamino), alquinilo C2-6, fenil-alquinilo (C2-6) (en donde el grupo fenilo está opcionalmente sustituido con halógeno, alquilo C1-4, alcoxi C1-4, haloalquilo C1-4, haloalcoxi C1-4, CN, NO2, fenilo, heteroarilo, amino o dialquilamino); o C(R51)(R52)-[CR53=CR54]z-R55, en que z es 1 ó 2, R51 y R52 son cada uno independientemente H, halo o alquilo C1-2, R53 y R54 son cada uno independientemente H, halógeno, alquilo C1-4 o haloalquilo C1-4 y R55 es fenilo (en donde el grupo fenilo puede estar opcionalmente sustituido con uno o más sustituyentes independientemente seleccionados de halógeno, alquilo C1-6, haloalquilo C1-6, alcoxi C1-6-alquilo (C1-6), alcoxi C1-6, haloalcoxi C1-6, alquiltio C1-6, haloalquiltio C1-6, alquil C1-6-sulfinilo, haloalquil C1-6-sulfinilo, alquil C1-6-sulfonilo, haloalquil C1-6-sulfonilo, alquenilo C2-6, haloalquenilo C2-6, alquinilo C2-6, cicloalquilo C3-7, nitro, ciano, CO2H, alquil C1-6-carbonilo, alcoxi C1-6-carbonilo, amino, dialquilamino, arilo, heteroarilo, R31R32N o R33R34NC(O); en donde R31, R32, R33 y R34 son independientemente hidrógeno o alquilo C1-6), o heteroarilo (en donde el grupo heteroarilo puede estar opcionalmente sustituido con uno o más sustituyentes independientemente seleccionados de halógeno, alquilo C1-6, haloalquilo C1-6, alcoxi C1-6-alquilo (C1-6), alcoxi C1-6, haloalcoxi C1-6, alquiltio C1-6, haloalquiltio C1-6, alquil C1-6-sulfinilo, haloalquil C1-6-sulfinilo, alquil C1-6-sulfonilo, haloalquil C1-6-sulfonilo, alquenilo C2-6, haloalquenilo C2-6, alquinilo C2-6, cicloalquilo C3-7, nitro, ciano, CO2H, alquil C1-6-carbonilo, alcoxi C1-6-carbonilo, amino, dialquilamino, arilo, heteroarilo, R31R32N o R33R34NC(O); en donde R31, R32, R33 y R34 son independientemente hidrógeno o alquilo C1-6); R9 y R10 son independientemente hidrógeno, alquilo C1-2 o halógeno; R40 es H, alquilo C1-6, haloalquilo C1-6, alcoxi C1-6, haloalcoxi C1-6, fenoxi (en donde el grupo fenilo puede estar opcionalmente sustituido con halógeno, alquilo C1-4, alcoxi C1-4, haloalquilo C1-4, haloalcoxi C1-4, CN, NO2, fenilo, heteroarilo, amino o dialquilamino), fenilo (opcionalmente sustituido con halógeno, alquilo C1-4, alcoxi C1-4, haloalquilo C1-4, haloalcoxi C1-4, CN, NO2, fenilo, heteroarilo, amino o dialquilamino), heteroarilo (opcionalmente sustituido con halógeno, alquilo C1-4 o alcoxi C1-4), heteroariloxi (en donde el grupo heteroarilo puede estar opcionalmente sustituido con halógeno, alquilo C1-4 o alcoxi C1-4), o NR44R45, en que R44 y R45 son independientemente alquilo C1-6 (opcionalmente sustituido con halógeno, nitro, ciano, haloalquilo C1-6, alcoxi C1-6 o haloalcoxi C1-6), fenilo (opcionalmente sustituido con halógeno, alquilo C1-4, alcoxi C1-4, haloalquilo C1-4, haloalcoxi C1-4, CN, NO2, fenilo, heteroarilo, amino o dialquilamino) o heteroarilo (opcionalmente sustituido con halógeno, nitro, ciano, alquilo C1-6, haloalquilo C1-6, alcoxi C1-6 o haloalcoxi C1-6) y sales o N-óxidos de los mismos, con la condición de que el método no sea para el tratamiento, mediante terapia, del cuerpo humano o animal
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/GB2003/002424.
Solicitante: SYNGENTA LIMITED
SYNGENTA PARTICIPATIONS AG.
Nacionalidad solicitante: Reino Unido.
Dirección: EUROPEAN REGIONAL CENTRE PRIESTLEY ROAD SURREY RESEARCH PARK GUILDFORD SURREY GU2 7YH REINO UNIDO.
Inventor/es: MAIENFISCH, PETER, CASSAYRE,JEROME, WORTHINGTON,PAUL ANTHONY SYNGENTA LIMITED, RUSSELL,CHARLES ADAM SYNGENTA LIMITED, MOLLEYRES,LOUIS-PIERRE SYNGENTA CROP PROTECTION AG, PEACE,JAMES,EDWARD,SYNGENTA LIMITED, COULTER,THOMAS,STEPHEN,EVOTEC OAI, CLARKE,ERIC,DANIEL,SYNGENTA LIMITED, HUGHES,DAVID,JOHN,SYNGENTA LIMITED, ROBERTS,RICHARD,SPURRING,ALMIRALL PRODESFARM, ASHTON,MARK,RICHARD,EVOTEC OAI, CEDERBAUM,FREDRIK SYNERGENTA CROP PROTECTION AG.
Fecha de Publicación: .
Fecha Solicitud PCT: 4 de Junio de 2003.
Fecha Concesión Europea: 25 de Agosto de 2010.
Clasificación Internacional de Patentes:
- A01N43/90 NECESIDADES CORRIENTES DE LA VIDA. › A01 AGRICULTURA; SILVICULTURA; CRIA; CAZA; CAPTURA; PESCA. › A01N CONSERVACION DE CUERPOS HUMANOS O ANIMALES O DE VEGETALES O DE PARTES DE ELLOS (conservación de alimentos o productos alimenticios A23 ); BIOCIDAS, p. ej. EN TANTO QUE SEAN DESINFECTANTES, PESTICIDAS O HERBICIDAS (preparaciones de uso médico, dental o para el aseo que eliminan o previenen el crecimiento o la proliferación de organismos no deseados A61K ); PRODUCTOS QUE ATRAEN O REPELEN A LOS ANIMALES; REGULADORES DEL CRECIMIENTO DE LOS VEGETALES. › A01N 43/00 Biocidas, productos que atraen o repelen a los animales perjudiciales, o reguladores del crecimiento de los vegetales, que contienen compuestos heterocíclicos (que contienen anhídridos cíclicos, imidas cíclicas A01N 37/00; que contienen compuestos de fórmula , que no tienen más que un heterociclo en los que m≥1 y n≥0 y es una pirrolidina, una piperidina, una morfolina, una tiomorfolina, una piperazina o una polimetilenoimina, no sustituida o sustituida por un alcoilo, que tiene al menos cuatro grupos CH 2 A01N 33/00 - A01N 41/12; que contienen ácidos ciclopropanocarbhoxílicos o sus derivados, p. ej. ésteres con heterociclos, A01N 53/00). › que contienen varios heterocíclicos determinantes condensados entre ellos o con un sistema carbocíclico común.
- A01N47/34 A01N […] › A01N 47/00 Biocidas, productos que repelen o atraen a los animales perjudiciales, o reguladores del crecimiento de los vegetales, que contienen compuestos orgánicos que tienen un átomo de carbono que no forma parte de un ciclo y que no está enlazado a un átomo de carbono o hidrógeno, p. ej. derivados del ácido carbónico (tetrahalogenuros de carbono A01N 29/02). › que contienen los grupos , p. ej. biuret; Sus tioanálogos; Productos de condensación urea-aldehído.
- A01N47/38 A01N 47/00 […] › que contienen el grupo N—CO—N con al menos un átomo de nitrógeno formando parte de un heterociclo; Sus tioanálogos.
- C07D211/70 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 211/00 Compuestos heterocíclicos que contienen ciclos hidrogenados de piridina, no condensados con otros ciclos. › con solamente átomos de hidrógeno, radicales hidrocarbonados o hidrocarbonados sustituidos, unidos directamente a los átomos de carbono del ciclo.
- C07D211/76 C07D 211/00 […] › unidos en posición 2 ó 6.
- C07D471/10 C07D […] › C07D 471/00 Compuestos heterocíclicos que contienen átomos de nitrógeno como únicos heteroátomos del sistema condensado, teniendo al menos un ciclo de seis miembros con un átomo de nitrógeno, no previstos en los grupos C07D 451/00 - C07D 463/00. › Sistemas espiro-condensados.
- C07D491/10 C07D […] › C07D 491/00 Compuestos heterocíclicos que contienen en el sistema cíclico condensado, a la vez uno o más ciclos que tienen átomos de oxígeno como únicos heteroátomos del ciclo, y uno o más ciclos que tienen átomos de nitrógeno como únicos heteroátomos del ciclo, no previstos en los grupos C07D 451/00 - C07D 459/00, C07D 463/00, C07D 477/00 ó C07D 489/00. › Sistemas espiro-condensados.
Clasificación PCT:
- A01N43/90 A01N 43/00 […] › que contienen varios heterocíclicos determinantes condensados entre ellos o con un sistema carbocíclico común.
- C07D211/70 C07D 211/00 […] › con solamente átomos de hidrógeno, radicales hidrocarbonados o hidrocarbonados sustituidos, unidos directamente a los átomos de carbono del ciclo.
- C07D211/76 C07D 211/00 […] › unidos en posición 2 ó 6.
- C07D471/10 C07D 471/00 […] › Sistemas espiro-condensados.
- C07D491/10 C07D 491/00 […] › Sistemas espiro-condensados.
Clasificación antigua:
- A01N43/90 A01N 43/00 […] › que contienen varios heterocíclicos determinantes condensados entre ellos o con un sistema carbocíclico común.
- C07D209/00 C07D […] › Compuestos heterocíclicos que contienen ciclos de cinco miembros, condensados con otros ciclos, con solamente un átomo de nitrógeno como heteroátomo.
- C07D211/70 C07D 211/00 […] › con solamente átomos de hidrógeno, radicales hidrocarbonados o hidrocarbonados sustituidos, unidos directamente a los átomos de carbono del ciclo.
- C07D211/76 C07D 211/00 […] › unidos en posición 2 ó 6.
- C07D221/00 C07D […] › Compuestos heterocíclicos que contienen ciclos de seis miembros, teniendo un átomo de nitrógeno como único heteroátomo del ciclo, no previstos por los grupos C07D 211/00 - C07D 219/00.
- C07D317/00 C07D […] › Compuestos heterocíclicos que contienen ciclos de cinco miembros que tienen dos átomos de oxígeno como únicos heteroátomos del ciclo.
- C07D471/10 C07D 471/00 […] › Sistemas espiro-condensados.
- C07D491/10 C07D 491/00 […] › Sistemas espiro-condensados.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
Fragmento de la descripción:
Derivados de espiroindolina.
La presente invención se refiere a derivados de espiroindolina, a procedimientos para prepararlos, a composiciones insecticidas, acaricidas, molusquicidas y nematocidas que los comprenden y a métodos de utilizarlos para combatir y reprimir plagas de insectos, ácaros, moluscos y nematodos.
Derivados de espiroindolina con propiedades farmacéuticas se describen, por ejemplo, en los documentos WO9825605, WO9429309, WO9828297 y WO9964002. Rutas de síntesis a compuestos seleccionados con propiedades farmacéuticas se describen en Proc. Natl. Acad. Sci. USA (1995), 92, 7001, Tetrahedron (1997), 53, 10983 y Tetrahedron Letters (1997), 38, 1497. Se ha encontrado ahora, sorprendentemente, que determinadas espiroindolinas tienen propiedades insecticidas.
La presente invención proporciona, por lo tanto, un método de combatir y reprimir insectos, ácaros, nematodos o moluscos, que comprende aplicar a una plaga, a un lugar de una plaga o a una planta susceptible de ser atacada por una plaga una cantidad, eficaz como insecticida, acaricida, nematocida o molusquicida, de un compuesto de fórmula (I):
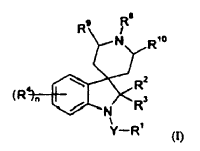
en donde Y es un enlace sencillo, C=O o SO2;
R1 es hidrógeno, alquilo C1-6, haloalquilo C1-6, alcoxi C1-6-alquilo (C1-6), heteroaril-alquilo (C1-6) (en donde el grupo heteroarilo puede estar opcionalmente sustituido con halo, nitro, ciano, alquilo C1-6, haloalquilo C1-6, alcoxi C1-6, haloalcoxi C1-6, alquil C1-6-sulfonilo, alquil C1-6-sulfinilo, alquiltio C1-6, alcoxi C1-6-carbonilo, alquil C1-6-carbonilamino, fenilcarbonilo, o dos posiciones adyacentes en el sistema de heteroarilo pueden estar cicladas para formar un anillo carbocíclico o heterocíclico de 5, 6 ó 7 miembros, este mismo opcionalmente sustituido con halógeno), fenil-alquilo C1-6 (en donde el grupo fenilo puede estar opcionalmente sustituido con halógeno, alquilo C1-4, alcoxi C1-4, haloalquilo C1-4, haloalcoxi C1-4, CN, NO2, fenilo, heteroarilo, amino o dialquilamino, alquil C1-6-sulfonilo, alquil C1-6-sulfinilo, alquiltio C1-6, alcoxi C1-6-carbonilo, alquil C1-6-carbonilamino, fenilcarbonilo, o dos posiciones adyacentes en el anillo de fenilo pueden estar cicladas para formar un anillo carbocíclico o heterocíclico de 5, 6 ó 7 miembros, este mismo opcionalmente sustituido con halógeno), alquil C1-6-carbonilamino-alquilo (C1-6), fenilo (que puede estar opcionalmente sustituido con halógeno, alquilo C1-4, alcoxi C1-4, haloalquilo C1-4, haloalcoxi C1-4, CN, NO2, fenilo, heteroarilo, amino o dialquilamino, alquil C1-6-sulfonilo, alquil C1-6-sulfinilo, alquiltio C1-6, alcoxi C1-6-carbonilo, alquil C1-6-carbonilamino, fenilcarbonilo, o dos posiciones adyacentes en el anillo de fenilo pueden estar cicladas para formar un anillo carbocíclico o heterocíclico de 5, 6 ó 7 miembros, este mismo opcionalmente sustituido con halógeno), heteroarilo (que puede estar opcionalmente sustituido con halo, nitro, ciano, alquilo C1-6, haloalquilo C1-6, alcoxi C1-6, haloalcoxi C1-6, alquil C1-6-sulfonilo, alquil C1-6-sulfinilo, alquiltio C1-6, alcoxi C1-6-carbonilo, alquil C1-6-carbonilamino, fenilcarbonilo, o dos posiciones adyacentes en el sistema de heteroarilo pueden estar cicladas para formar un anillo carbocíclico o heterocíclico de 5, 6 ó 7 miembros, este mismo opcionalmente sustituido con halógeno), alcoxi C1-6, haloalcoxi C1-6, fenoxi (en donde el grupo fenilo está opcionalmente sustituido con halógeno, alquilo C1-4, alcoxi C1-4, haloalquilo C1-4, haloalcoxi C1-4, CN, NO2, fenilo, heteroarilo, amino o dialquilamino), heteroariloxi (opcionalmente sustituido con halo, nitro, ciano, alquilo C1-6, haloalquilo C1-6, alcoxi C1-6 o haloalcoxi C1-6), heterocicliloxi (opcionalmente sustituido con halo, alquilo C1-6, haloalquilo C1-6, alcoxi C1-6 o haloalcoxi C1-6), ciano, alquenilo C2-6, cicloalquilo C3-6, cicloalquenilo C5-7, heterociclilo (opcionalmente sustituido con halo, ciano, alquilo C1-6, haloalquilo C1-6, alcoxi C1-6 o haloalcoxi C1-6), alquiltio C1-6, haloalquiltio C1-6, NR13R14, en que R13 y R14 son independientemente hidrógeno, COR40, alquilo C2-6, haloalquilo C2-6, fenilo (que puede estar opcionalmente sustituido con halógeno, alquilo C1-4, alcoxi C1-4, haloalquilo C1-4, haloalcoxi C1-4, CN, NO2, fenilo, heteroarilo, amino, dialquilamino, alcoxi C1-4-carbonilo) o heteroarilo (que puede estar opcionalmente sustituido con halo, nitro, ciano, alquilo C1-6, haloalquilo C1-6, alcoxi C1-6, haloalcoxi C1-6, alcoxi C1-6-carbonilo); alquil C1-6-carbonilamino, feniloxicarbonilamino (en donde el grupo fenilo está opcionalmente sustituido con halógeno, alquilo C1-4, alcoxi C1-4, haloalquilo C1-4, haloalcoxi C1-4, CN, NO2, fenilo, heteroarilo, amino o dialquilamino), amino, alquil C1-6-amino, fenilamino (en donde el grupo fenilo está opcionalmente sustituido con halógeno, alquilo C1-4, alcoxi C1-4, haloalquilo C1-4, haloalcoxi C1-4, CN, NO2, fenilo, heteroarilo, amino o dialquilamino);
R2 y R3 son independientemente hidrógeno o alquilo C1-4;
cada uno de R4 es independientemente halógeno, ciano, alquilo C1-8, haloalquilo C1-8, ciano-alquilo C1-8, alcoxi C1-6-alquilo (C1-6), alquinilo C2-6, trimetilsilil-alquinilo (C2-6), alcoxi C1-6-carbonilo, cicloalquilo C3-7, alquil C1-3-cicloalquilo (C3-7), fenilo (opcionalmente sustituido con halógeno, alquilo C1-4, alcoxi C1-4, haloalquilo C1-4, haloalcoxi C1-4, CN, NO2, fenilo, heteroarilo, amino o dialquilamino), heterociclilo (opcionalmente sustituido con halo, nitro, ciano, alquilo C1-6, haloalquilo C1-6, alcoxi C1-6 o haloalcoxi C1-6), alcoxi C1-8, haloalcoxi C1-8, fenoxi (opcionalmente sustituido con halógeno, alquilo C1-4, alcoxi C1-4, haloalquilo C1-4, haloalcoxi C1-4, CN, NO2, fenilo, heteroarilo, amino o dialquilamino), heteroariloxi (opcionalmente sustituido con halo, nitro, ciano, alquilo C1-3, haloalquilo C1-3, alcoxi C1-3 o haloalcoxi C1-3), dialquil (C1-8)-amino, ó 2 grupos R4 adyacentes, junto con los átomos de carbono a los que están unidos, forman un anillo carbocíclico o heterocíclico de 4, 5, 6 ó 7 miembros que puede estar opcionalmente sustituido con halógeno; n es 0, 1, 2, 3 ó 4;
R8 es alquilo C1-6, haloalquilo C1-6, fenil-alquilo (C1-4) (en donde el grupo fenilo está opcionalmente sustituido con halógeno, alquilo C1-4, alcoxi C1-4, haloalquilo C1-4, haloalcoxi C1-4, CN, NO2, fenilo, heteroarilo, amino o dialquilamino), heteroaril-alquilo (C1-6) (en donde el grupo heteroarilo está opcionalmente sustituido con halógeno, alquilo C1-4, alcoxi C1-4, haloalquilo C1-4, haloalcoxi C1-4, CN, NO2, fenilo, heteroarilo, amino o dialquilamino), alquenilo C2-6, fenil-alquenilo (C2-6) (en donde el grupo fenilo está opcionalmente sustituido con halógeno, alquilo C1-4, alcoxi C1-4, haloalquilo C1-4, haloalcoxi C1-4, CN, NO2, fenilo, heteroarilo, amino o dialquilamino), alquinilo C2-6, fenil-alquinilo (C2-6) (en donde el grupo fenilo está opcionalmente...
Reivindicaciones:
1. Un método de combatir y reprimir insectos, ácaros, nematodos o moluscos, que comprende aplicar a una plaga, a un lugar de una plaga o a una planta susceptible de ser atacada por una plaga una cantidad, eficaz como insecticida, acaricida, nematocida o molusquicida, de un compuesto de fórmula (I):
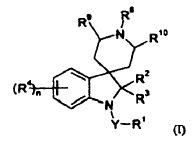
en donde Y es un enlace sencillo, C=O o SO2;
R1 es hidrógeno, alquilo C1-6, haloalquilo C1-6, alcoxi C1-6-alquilo (C1-6), heteroaril-alquilo (C1-6) (en donde el grupo heteroarilo puede estar opcionalmente sustituido con halo, nitro, ciano, alquilo C1-6, haloalquilo C1-6, alcoxi C1-6, haloalcoxi C1-6, alquil C1-6-sulfonilo, alquil C1-6-sulfinilo, alquiltio C1-6, alcoxi C1-6-carbonilo, alquil C1-6-carbonilamino, fenilcarbonilo, o dos posiciones adyacentes en el sistema de heteroarilo pueden estar cicladas para formar un anillo carbocíclico o heterocíclico de 5, 6 ó 7 miembros, este mismo opcionalmente sustituido con halógeno), fenil-alquilo C1-6 (en donde el grupo fenilo puede estar opcionalmente sustituido con halógeno, alquilo C1-4, alcoxi C1-4, haloalquilo C1-4, haloalcoxi C1-4, CN, NO2, fenilo, heteroarilo, amino o dialquilamino, alquil C1-6-sulfonilo, alquil C1-6-sulfinilo, alquiltio C1-6, alcoxi C1-6-carbonilo, alquil C1-6-carbonilamino, fenilcarbonilo, o dos posiciones adyacentes en el anillo de fenilo pueden estar cicladas para formar un anillo carbocíclico o heterocíclico de 5, 6 ó 7 miembros, este mismo opcionalmente sustituido con halógeno), alquil C1-6-carbonilamino-alquilo (C1-6), fenilo (que puede estar opcionalmente sustituido con halógeno, alquilo C1-4, alcoxi C1-4, haloalquilo C1-4, haloalcoxi C1-4, CN, NO2, fenilo, heteroarilo, amino o dialquilamino, alquil C1-6-sulfonilo, alquil C1-6-sulfinilo, alquiltio C1-6, alcoxi C1-6-carbonilo, alquil C1-6-carbonilamino, fenilcarbonilo, o dos posiciones adyacentes en el anillo de fenilo pueden estar cicladas para formar un anillo carbocíclico o heterocíclico de 5, 6 ó 7 miembros, este mismo opcionalmente sustituido con halógeno), heteroarilo (que puede estar opcionalmente sustituido con halo, nitro, ciano, alquilo C1-6, haloalquilo C1-6, alcoxi C1-6, haloalcoxi C1-6, alquil C1-6-sulfonilo, alquil C1-6-sulfinilo, alquiltio C1-6, alcoxi C1-6-carbonilo, alquil C1-6-carbonilamino, fenilcarbonilo, o dos posiciones adyacentes en el sistema de heteroarilo pueden estar cicladas para formar un anillo carbocíclico o heterocíclico de 5, 6 ó 7 miembros, este mismo opcionalmente sustituido con halógeno), alcoxi C1-6, haloalcoxi C1-6, fenoxi (en donde el grupo fenilo está opcionalmente sustituido con halógeno, alquilo C1-4, alcoxi C1-4, haloalquilo C1-4, haloalcoxi C1-4, CN, NO2, fenilo, heteroarilo, amino o dialquilamino), heteroariloxi (opcionalmente sustituido con halo, nitro, ciano, alquilo C1-6, haloalquilo C1-6, alcoxi C1-6 o haloalcoxi C1-6), heterocicliloxi (opcionalmente sustituido con halo, alquilo C1-6, haloalquilo C1-6, alcoxi C1-6 o haloalcoxi C1-6), ciano, alquenilo C2-6, cicloalquilo C3-6, cicloalquenilo C5-7, heterociclilo (opcionalmente sustituido con halo, ciano, alquilo C1-6, haloalquilo C1-6, alcoxi C1-6 o haloalcoxi C1-6), alquiltio C1-6, haloalquiltio C1-6, NR13R14, en que R13 y R14 son independientemente hidrógeno, COR40, alquilo C2-6, haloalquilo C2-6, fenilo (que puede estar opcionalmente sustituido con halógeno, alquilo C1-4, alcoxi C1-4, haloalquilo C1-4, haloalcoxi C1-4, CN, NO2, fenilo, heteroarilo, amino, dialquilamino, alcoxi C1-4-carbonilo) o heteroarilo (que puede estar opcionalmente sustituido con halo, nitro, ciano, alquilo C1-6, haloalquilo C1-6, alcoxi C1-6, haloalcoxi C1-6, alcoxi C1-4-carbonilo); alquil C1-6-carbonilamino, feniloxicarbonilamino (en donde el grupo fenilo está opcionalmente sustituido con halógeno, alquilo C1-4, alcoxi C1-4, haloalquilo C1-4, haloalcoxi C1-4, CN, NO2, fenilo, heteroarilo, amino o dialquilamino), amino, alquil C1-6-amino, fenilamino (en donde el grupo fenilo está opcionalmente sustituido con halógeno, alquilo C1-4, alcoxi C1-4, haloalquilo C1-4, haloalcoxi C1-4, CN, NO2, fenilo, heteroarilo, amino o dialquilamino);
R2 y R3 son independientemente hidrógeno o alquilo C1-4;
cada uno de R4 es independientemente halógeno, ciano, alquilo C1-8, haloalquilo C1-8, ciano-alquilo C1-8, alcoxi C1-6-alquilo (C1-6), alquinilo C2-6, trimetilsilil-alquinilo (C2-6), alcoxi C1-6-carbonilo, cicloalquilo C3-7, alquil C1-3-cicloalquilo (C3-7), fenilo (opcionalmente sustituido con halógeno, alquilo C1-4, alcoxi C1-4, haloalquilo C1-4, haloalcoxi C1-4, CN, NO2, fenilo, heteroarilo, amino o dialquilamino), heterociclilo (opcionalmente sustituido con halo, nitro, ciano, alquilo C1-6, haloalquilo C1-6, alcoxi C1-6 o haloalcoxi C1-6), alcoxi C1-8, haloalcoxi C1-6, fenoxi (opcionalmente sustituido con halógeno, alquilo C1-4, alcoxi C1-4, haloalquilo C1-4, haloalcoxi C1-4, CN, NO2, fenilo, heteroarilo, amino o dialquilamino), heteroariloxi (opcionalmente sustituido con halo, nitro, ciano, alquilo C1-3, haloalquilo C1-3, alcoxi C1-3 o haloalcoxi C1-3), dialquil (C1-8)-amino, ó 2 grupos R4 adyacentes, junto con los átomos de carbono a los que están unidos, forman un anillo carbocíclico o heterocíclico de 4, 5, 6 ó 7 miembros que puede estar opcionalmente sustituido con halógeno; n es 0, 1, 2, 3 ó 4;
R8 es alquilo C1-6, haloalquilo C1-6, fenil-alquilo (C1-4) (en donde el grupo fenilo está opcionalmente sustituido con halógeno, alquilo C1-4, alcoxi C1-4, haloalquilo C1-4, haloalcoxi C1-4, CN, NO2, fenilo, heteroarilo, amino o dialquilamino), heteroaril-alquilo (C1-6) (en donde el grupo heteroarilo está opcionalmente sustituido con halógeno, alquilo C1-4, alcoxi C1-4, haloalquilo C1-4, haloalcoxi C1-4, CN, NO2, fenilo, heteroarilo, amino o dialquilamino), alquenilo C2-6, fenil-alquenilo (C2-6) (en donde el grupo fenilo está opcionalmente sustituido con halógeno, alquilo C1-4, alcoxi C1-4, haloalquilo C1-4, haloalcoxi C1-4, CN, NO2, fenilo, heteroarilo, amino o dialquilamino), alquinilo C2-6, fenil-alquinilo (C2-6) (en donde el grupo fenilo está opcionalmente sustituido con halógeno, alquilo C1-4, alcoxi C1-4, haloalquilo C1-4, haloalcoxi C1-4, CN, NO2, fenilo, heteroarilo, amino o dialquilamino); o C(R51)(R52)-[CR53=CR54]z-R55, en que z es 1 ó 2,
R51 y R52 son cada uno independientemente H, halo o alquilo C1-2, R53 y R54 son cada uno independientemente H, halógeno, alquilo C1-4 o haloalquilo C1-4 y R55 es fenilo (en donde el grupo fenilo puede estar opcionalmente sustituido con uno o más sustituyentes independientemente seleccionados de halógeno, alquilo C1-6, haloalquilo C1-6, alcoxi C1-6-alquilo (C1-6), alcoxi C1-6, haloalcoxi C1-6, alquiltio C1-6, haloalquiltio C1-6, alquil C1-6-sulfinilo, haloalquil C1-6-sulfinilo, alquil C1-6-sulfonilo, haloalquil C1-6-sulfonilo, alquenilo C2-6, haloalquenilo C2-6, alquinilo C2-6, cicloalquilo C3-7, nitro, ciano, CO2H, alquil C1-6-carbonilo, alcoxi C1-6-carbonilo, amino, dialquilamino, arilo, heteroarilo, R31R32N o R33R34NC(O); en donde R31, R32, R33 y R34 son independientemente hidrógeno o alquilo C1-6), o heteroarilo (en donde el grupo heteroarilo puede estar opcionalmente sustituido con uno o más sustituyentes independientemente seleccionados de halógeno, alquilo C1-6, haloalquilo C1-6, alcoxi C1-6-alquilo (C1-6), alcoxi C1-6, haloalcoxi C1-6, alquiltio C1-6, haloalquiltio C1-6, alquil C1-6-sulfinilo, haloalquil C1-6-sulfinilo, alquil C1-6-sulfonilo, haloalquil C1-6-sulfonilo, alquenilo C2-6, haloalquenilo C2-6, alquinilo C2-6, cicloalquilo C3-7, nitro, ciano, CO2H, alquil C1-6-carbonilo, alcoxi C1-6-carbonilo, amino, dialquilamino, arilo, heteroarilo, R31R32N o R33R34NC(O); en donde R31, R32, R33 y R34 son independientemente hidrógeno o alquilo C1-6);
R9 y R10 son independientemente hidrógeno, alquilo C1-2 o halógeno;
R40 es H, alquilo C1-6, haloalquilo C1-6, alcoxi C1-6, haloalcoxi C1-6, fenoxi (en donde el grupo fenilo puede estar opcionalmente sustituido con halógeno, alquilo C1-4, alcoxi C1-4, haloalquilo C1-4, haloalcoxi C1-4, CN, NO2, fenilo, heteroarilo, amino o dialquilamino), fenilo (opcionalmente sustituido con halógeno, alquilo C1-4, alcoxi C1-4, haloalquilo C1-4, haloalcoxi C1-4, CN, NO2, fenilo, heteroarilo, amino o dialquilamino), heteroarilo (opcionalmente sustituido con halógeno, alquilo C1-4 o alcoxi C1-4), heteroariloxi (en donde el grupo heteroarilo puede estar opcionalmente sustituido con halógeno, alquilo C1-4 o alcoxi C1-4), o NR44R45, en que R44 y R45 son independientemente alquilo C1-6 (opcionalmente sustituido con halógeno, nitro, ciano, haloalquilo C1-6, alcoxi C1-6 o haloalcoxi C1-6), fenilo (opcionalmente sustituido con halógeno, alquilo C1-4, alcoxi C1-4, haloalquilo C1-4, haloalcoxi C1-4, CN, NO2, fenilo, heteroarilo, amino o dialquilamino) o heteroarilo (opcionalmente sustituido con halógeno, nitro, ciano, alquilo C1-6, haloalquilo C1-6, alcoxi C1-6 o haloalcoxi C1-6) y sales o N-óxidos de los mismos, con la condición de que el método no sea para el tratamiento, mediante terapia, del cuerpo humano o animal.
2. Un método de acuerdo con la reivindicación 1, en el que Y es un enlace o es C=O.
3. Un método de acuerdo con la reivindicación 1 ó 2, en el que R1 es alquilo C1-6, haloalquilo C1-6, alcoxi C1-6-alquilo (C1-6), heteroaril-alquilo (C1-3) (en donde el grupo heteroarilo puede estar opcionalmente sustituido con halo, nitro, ciano, alquilo C1-6, haloalquilo C1-6, alcoxi C1-6, haloalcoxi C1-6, alquil C1-6-sulfonilo, alcoxi C1-6-carbonilo, o dos posiciones adyacentes en el sistema de heteroarilo pueden estar cicladas para formar un anillo carbocíclico o heterocíclico de 5, 6 ó 7 miembros, este mismo opcionalmente sustituido con halógeno), fenil-alquilo (C1-3) (en donde el grupo fenilo puede estar opcionalmente sustituido con halógeno, alquilo C1-4, alcoxi C1-4, haloalquilo C1-4, haloalcoxi C1-4, CN, NO2, fenilo, heteroarilo, amino, dialquilamino, alquil C1-6-sulfonilo, alcoxi C1-6-carbonilo, o dos posiciones adyacentes en el anillo de fenilo pueden estar cicladas para formar un anillo carbocíclico o heterocíclico de 5, 6 ó 7 miembros, este mismo opcionalmente sustituido con halógeno), fenilo (que puede estar opcionalmente sustituido con halógeno, alquilo C1-4, alcoxi C1-4, haloalquilo C1-4, haloalcoxi C1-4, CN, NO2, fenilo, heteroarilo, amino, dialquilamino, alquil C1-6-sulfonilo, alcoxi C1-6-carbonilo, o dos posiciones adyacentes en el anillo de fenilo pueden estar cicladas para formar un anillo carbocíclico o heterocíclico de 5, 6 ó 7 miembros, este mismo opcionalmente sustituido con halógeno), heteroarilo (que puede estar opcionalmente sustituido con halo, nitro, ciano, alquilo C1-6, haloalquilo C1-6, alcoxi C1-6, haloalcoxi C1-6, alquil C1-6-sulfonilo, alcoxi C1-6-carbonilo, o dos posiciones adyacentes en el sistema de heteroarilo pueden estar cicladas para formar un anillo carbocíclico o heterocíclico de 5, 6 ó 7 miembros, este mismo opcionalmente sustituido con halógeno), alcoxi C1-6, haloalcoxi C1-6, alquenilo C2-6, heterociclilo (opcionalmente sustituido con halo, ciano, alquilo C1-6, haloalquilo C1-6, alcoxi C1-6 o haloalcoxi C1-6), alquiltio C1-6, haloalquiltio C1-6 o NR13R14, en donde R13 y R14 son independientemente hidrógeno, alquilo C2-6 o haloalquilo C2-6, alquil C2-6-carbonilo o fenilcarbonilo (en donde el fenilo está opcionalmente sustituido con halógeno, alquilo C1-4, alcoxi C1-4, haloalquilo C1-4, haloalcoxi C1-4, CN, NO2, fenilo, heteroarilo, amino o dialquilamino).
4. Un método de acuerdo con cualquier reivindicación precedente, en el que R2 y R3 son independientemente hidrógeno o metilo.
5. Un método de acuerdo con cualquier reivindicación precedente, en el que R4 es independientemente halógeno, ciano, alquilo C1-8, haloalquilo C1-8, ciano-alquilo C1-8, alcoxi C1-6-alquilo (C1-6), alquinilo C2-6, heterociclilo (opcionalmente sustituido con alquilo C1-6), alcoxi C1-8, haloalcoxi C1-6, fenoxi (opcionalmente sustituido con halo, ciano, alquilo C1-3 o haloalquilo C1-3), heteroariloxi (opcionalmente sustituido con halo, ciano, alquilo C1-3 o haloalquilo C1-3), dialquil(C1-8)amino, ó 2 grupos R4 adyacentes, junto con los átomos de carbono a los que están unidos, forman un anillo carbocíclico o heterocíclico de 4, 5, 6 ó 7 miembros que puede estar opcionalmente sustituido con halógeno; n es 0, 1, 2, 3 ó 4.
6. Un método de acuerdo con cualquier reivindicación precedente, en el que
R8 es fenil-alquilo (C1-4) (en donde el grupo fenilo está opcionalmente sustituido con halógeno, alquilo C1-4, alcoxi C1-4, haloalquilo C1-4, haloalcoxi C1-4, CN, NO2, fenilo, heteroarilo, amino o dialquilamino), heteroaril-alquilo (C1-6) (en donde el grupo heteroarilo está opcionalmente sustituido con halógeno, alquilo C1-4, alcoxi C1-4, haloalquilo C1-4, haloalcoxi C1-4, CN, NO2, fenilo, heteroarilo, amino o dialquilamino), fenil-alquenilo (C2-6) (en donde el grupo fenilo está opcionalmente sustituido con halógeno, alquilo C1-4, alcoxi C1-4, haloalquilo C1-4, haloalcoxi C1-4, CN, NO2, fenilo, heteroarilo, amino o dialquilamino) o fenil-alquinilo (C2-6) (en donde el grupo fenilo está opcionalmente sustituido con halógeno, alquilo C1-4, alcoxi C1-4, haloalquilo C1-4, haloalcoxi C1-4, CN, NO2, fenilo, heteroarilo, amino o dialquilamino); o -C(R51)(R52)-[CR53=CR54]z-R55, en que z es 1 ó 2, R51 y R52 son cada uno independientemente H, halo o alquilo C1-2, R53 y R54 son cada uno independientemente H, halógeno, alquilo C1-4 o haloalquilo C1-4 y R55 es fenilo (en donde el grupo fenilo puede estar opcionalmente sustituido con uno o más sustituyentes independientemente seleccionados de halógeno, alquilo C1-6, haloalquilo C1-6, alcoxi C1-6-alquilo (C1-6), alcoxi C1-6, haloalcoxi C1-6, alquiltio C1-6, haloalquiltio C1-6, alquil C1-6-sulfinilo, haloalquil C1-6-sulfinilo, alquil C1-6-sulfonilo, haloalquil C1-6-sulfonilo, alquenilo C2-6, haloalquenilo C2-6, alquinilo C2-6, cicloalquilo C3-7, nitro, ciano, CO2H, alquil C1-6-carbonilo, alcoxi C1-6-carbonilo, amino, dialquilamino, arilo, heteroarilo, R31R32N o R33R34NC(O); en donde R31, R32, R33 y R34 son independientemente hidrógeno o alquilo C1-6), o heteroarilo (en donde el grupo heteroarilo puede estar opcionalmente sustituido con uno o más sustituyentes independientemente seleccionados de halógeno, alquilo C1-6, haloalquilo C1-6, alcoxi C1-6-alquilo (C1-6), alcoxi C1-6, haloalcoxi C1-6, alquiltio C1-6, haloalquiltio C1-6, alquil C1-6-sulfinilo, haloalquil C1-6-sulfinilo, alquil C1-6-sulfonilo, haloalquil C1-6-sulfonilo, alquenilo C2-6, haloalquenilo C2-6, alquinilo C2-6, cicloalquilo C3-7, nitro, ciano, CO2H, alquil C1-6-carbonilo, alcoxi C1-6-carbonilo, amino, dialquilamino, arilo, heteroarilo, R31R32N o R33R34NC(O); en donde R31, R32, R33 y R34 son independientemente hidrógeno o alquilo C1-6).
7. Un método de acuerdo con cualquier reivindicación precedente, en el que R9 y R10 son ambos hidrógeno.
8. Un compuesto de fórmula IK
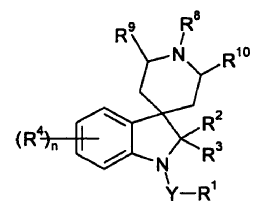
en donde Y es un enlace sencillo, C=O o S(O)2; R1 es alquilo C1-8, haloalquilo C1-6, ciano-alquilo C1-6, cicloalquil C3-7-alquilo (C1-6), fenoxi C1-6-alquilo (C1-6), alqueniloxi C3-6-alquilo (C1-6), alquiniloxi C3-6-alquilo (C1-6), fenoxi-alquilo (C1-6), carboxi-alquilo (C1-6), alquil C1-6-carbonil-alquilo (C1-6), alquenil C2-6-carbonil-alquilo (C1-6), alquinil C2-6-carbonil-alquilo (C1-6), alcoxi C1-6-carbonil-alquilo (C1-6), alqueniloxi C3-6-carbonil-alquilo (C1-6), alquiniloxi C3-6-carbonil-alquilo (C1-6), fenoxicarbonil-alquilo (C1-6), alquiltio C1-6-alquilo (C1-6), alquil C1-6-sulfinil-alquilo (C1-6), alquil C1-6-sulfonil-alquilo (C1-6), aminocarbonil-alquilo (C1-6), alquil C1-6-aminocarbonil-alquilo (C1-6), dialquil C1-6-aminocarbonil-alquilo (C1-6), fenil-alquilo (C1-6) (en donde el grupo fenilo está opcionalmente sustituido con halógeno, nitro, ciano, alquilo C1-6, haloalquilo C1-6, alcoxi C1-6 o haloalcoxi C1-6), heteroaril-alquilo (C1-4) (en donde el grupo heteroarilo puede estar sustituido con halógeno, nitro, ciano, alquilo C1-6, haloalquilo C1-6, alcoxi C1-6 o haloalcoxi C1-6), heterociclil-alquilo (C1-4) (en donde el grupo heterociclilo puede estar sustituido con halógeno, ciano, alquilo C1-6, haloalquilo C1-6, alcoxi C1-6 o haloalcoxi C1-6), fenilo (opcionalmente sustituido con halógeno, nitro, ciano, alquilo C1-6, haloalquilo C1-6, alcoxi C1-6 o haloalcoxi C1-6), heteroarilo (opcionalmente sustituido con halógeno, nitro, ciano, alquilo C1-6, haloalquilo C1-6, alcoxi C1-6 o haloalcoxi C1-6), alcoxi C1-6, haloalcoxi C1-6, alquenilo C2-6, haloalquenilo C2-6, cianoalquenilo C2-6, alquinilo C2-6, cicloalquilo C3-7, formilo, heterociclilo (opcionalmente sustituido con halógeno, nitro, ciano, alquilo C1-6, haloalquilo C1-6, alcoxi C1-6 o haloalcoxi C1-6) o alquiltio C1-6; R2 y R3 son independientemente hidrógeno o alquilo C1-4; cada uno de R4 es independientemente halógeno, ciano, alquilo C1-10, opcionalmente sustituido con alcoxi C1-6, halógeno, fenilo (este mismo opcionalmente sustituido con halógeno, alquilo C1-4 o alcoxi C1-4), alquenilo C2-6, opcionalmente sustituido con alcoxi C1-6, halógeno, fenilo (este mismo opcionalmente sustituido con halógeno, alquilo C1-4 o alcoxi C1-4) o alquinilo C2-6, opcionalmente sustituido con alcoxi C1-6, halógeno, fenilo (este mismo opcionalmente sustituido con halógeno, alquilo C1-4 o alcoxi C1-4); n es 0, 1, 2, 3 ó 4; R8 es alquilo C1-10, opcionalmente sustituido con alcoxi C1-6, halógeno o fenilo (este mismo opcionalmente sustituido con halógeno, alquilo C1-4 o alcoxi C1-4), alquenilo C2-6, opcionalmente sustituido con alcoxi C1-6, halógeno o fenilo (este mismo opcionalmente sustituido con halógeno, alquilo C1-4 o alcoxi C1-4) o alquinilo C2-6, opcionalmente sustituido con alcoxi C1-6, halógeno o fenilo (este mismo opcionalmente sustituido con halógeno, alquilo C1-4 o alcoxi C1-4); R9 y R10 son ambos hidrógeno; y sales o N-óxidos de los mismos, con la condición de que R8 no sea metilo e YR1 no sea SO2CH3, metilo, etilo, fenilo o enilo sustituido con fluoro.
9. Un compuesto de fórmula (11)
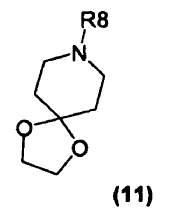
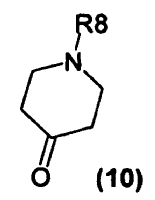
en que R8 es fenil-alquenilo (C2-4) (en donde el grupo fenilo está opcionalmente sustituido con halógeno, alquilo C1-4, alcoxi C1-4, haloalquilo C1-4, haloalcoxi C1-4, CN, NO2, fenilo, heteroarilo, amino o dialquilamino), con la condición de que R8 no sea cinamilo o 4-fluorocinamilo; o un compuesto de fórmula (10)
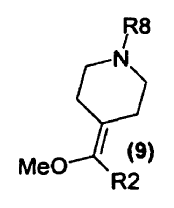
en que R8 es fenil-alquenilo (C2-4) (en donde el grupo fenilo está opcionalmente sustituido con halógeno, alquilo C1-4, alcoxi C1-4, haloalquilo C1-4, haloalcoxi C1-4, CN, NO2, fenilo, heteroarilo, amino o dialquilamino), con la condición de que R8 no sea cinamilo o 4-fluorocinamilo; o un compuesto de fórmula (9)
en que R2 es como se define para la fórmula (I) en la reivindicación 1 y R8 es fenil-alquenilo (C2-4) (en donde el grupo fenilo está opcionalmente sustituido con halógeno, alquilo C1-4, alcoxi C1-4, haloalquilo C1-4, haloalcoxi C1-4, CN, NO2, fenilo, heteroarilo, amino o dialquilamino); o un compuesto de fórmula (9A)
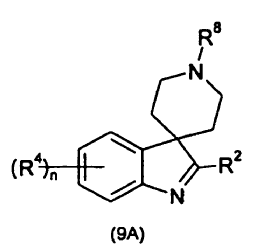
en que R2 y en que (R4)n son como se definen para la fórmula (I) en la reivindicación 1 y R8 es fenil-alquenilo (C2-4) (en donde el grupo fenilo está opcionalmente sustituido con halógeno, alquilo C1-4, alcoxi C1-4, haloalquilo C1-4, haloalcoxi C1-4, CN, NO2, fenilo, heteroarilo, amino o dialquilamino).
10. Una composición insecticida, acaricida y nematocida que comprende una cantidad eficaz como insecticida, acaricida o nematocida de un compuesto de fórmula I según se define en la reivindicación 1.
Patentes similares o relacionadas:
Composiciones herbicidas sólidas que contienen un fitoprotector, del 29 de Julio de 2020, de DOW AGROSCIENCES LLC: Una composición herbicida sólida que comprende: a) de 50 gramos de ingrediente activo por kilogramo (g ia/kg) a 600 g de ia/kg, con respecto a la composición […]
Composición fungicida para uso agrícola y hortícola, del 22 de Julio de 2020, de NIPPON SODA CO., LTD.: Una composición fungicida para su uso agrícola y hortícola, que comprende: un compuesto representado por la fórmula (a-5), **(Ver fórmula)** y […]
Productos concentrados de suspensión de herbicida de alta resistencia, del 22 de Julio de 2020, de DOW AGROSCIENCES LLC: Una composición estable que comprende a. una fase dispersa que comprende, con respecto a la composición total, de 1 gramo de ingrediente activo por litro (g ia/L) a […]
Mezcla de pesticidas que comprende un compuesto de pirazol, un insecticida y un fungicida, del 24 de Junio de 2020, de BASF SE: Una mezcla de pesticidas, que comprende como componentes activos 1) compuesto I-9 de la siguiente estructura **(Ver fórmula)** y […]
Método para el control de mosquitos, del 10 de Junio de 2020, de Dobson, Stephen: Un método para el control de mosquitos que comprende: criar insectos adultos; tratar los insectos adultos con uno o más insecticidas que comprenden al menos […]
Derivados heterocíclicos con sustituyentes que contienen azufre activos como plaguicidas, del 27 de Mayo de 2020, de SYNGENTA PARTICIPATIONS AG: Un compuesto de fórmula I **(Ver fórmula)** donde A representa CH o N; Q está unido a la posición 3 o 4; y es cicloalquiloC3-C6 […]
Compuestos herbicidas, del 13 de Mayo de 2020, de SYNGENTA PARTICIPATIONS AG: Un compuesto de Fórmula (I) **(Ver fórmula)** o una sal o N-óxido del mismo; en donde A1 es CR1 o N; R1 es hidrógeno, alquilo C1- C4, haloalquilo C1-C4, alcoxi […]
Control sinérgico de malas hierbas mediante aplicaciones de clomazona y benzobiciclón, del 13 de Mayo de 2020, de DOW AGROSCIENCES LLC: Una composición herbicida que comprende herbicidas, donde los herbicidas comprenden una cantidad sinérgica herbicidamente eficaz de (a) clomazona o una de sus sales agrícolamente […]