Anticuerpos biespecíficos bivalentes.
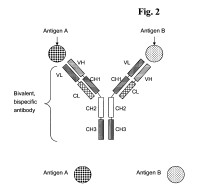
Anticuerpo biespecífico bivalente, que comprende:
a) la cadena ligera y la cadena pesada de un anticuerpo que se une específicamente a un primer antígeno,
y
b) la cadena ligera y la cadena pesada de un anticuerpo de unión específico a un segundo antígeno, en el que los dominios variables VL y VH se sustituyen uno por otro.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2008/010703.
Solicitante: F. HOFFMANN-LA ROCHE AG.
Inventor/es: SCHAFER, WOLFGANG, KLEIN, CHRISTIAN, DR..
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K39/395 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Anticuerpos (aglutininas A61K 38/36 ); Inmunoglobulinas; Inmunosuero, p. ej. suero antilinfocitario.
- C07K16/22 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › contra factores de crecimiento.
- C07K16/28 C07K 16/00 […] › contra receptores, antígenos celulares de superficie o determinantes celulares de superficie.
- C07K16/46 C07K 16/00 […] › Inmoglobulinas híbridas (híbridos de una inmunoglobulina con un péptido distinto de una inmunoglobulina C07K 19/00).
- C07K19/00 C07K […] › Péptidos híbridos (Inmoglobulinas híbridas compuestas solamente de inmoglobulinas C07K 16/46).
PDF original: ES-2469791_T3.pdf
Fragmento de la descripción:
Anticuerpos biespecïficos bivalentes
La presente invenciïn se refiere a nuevos anticuerpos biespecïficos bivalentes, a su preparaciïn y a su utilizaciïn.
Antecedentes de la invenciïn Las proteïnas manipuladas, tales como los anticuerpos biespecïficos o multiespecïficos capaces de unirse a dos o mïs antïgenos, son conocidas de la tïcnica. Estas proteïnas de uniïn multiespecïficas pueden generarse mediante fusiïn celular, conjugaciïn quïmica o tïcnicas de ADN recombinante.
Recientemente se ha desarrollado una amplia diversidad de formatos de anticuerpo recombinante biespecïfico, por ejemplo anticuerpos biespecïficos tetravalentes mediante la fusiïn de, por ejemplo, un formato de anticuerpo IgG y dominios de cadena sencilla (ver, por ejemplo, Morrison S.L. et al., Nature Biotech. 15:159-163, 1997, documento nï WO 2001/077342, y Coloma M.J., Nature Biotech. 25:1233-1234, 2007) .
Ademïs, se han desarrollado algunos otros formatos nuevos en los que ya no se retiene la estructura nuclear del anticuerpo (IgA, IgD, IgE, IgG o IgM) , tales como diacuerpos, triacuerpos o tetracuerpos, minicuerpos, varios formatos de una sola cadena (scFv, Bis-scFv) , que son capaces de unirse a dos o mïs antïgenos (Holliger P. et al., Nature Biotech. 23:1126-1136, 2005; Fischer N. y Lïger O., Pathobiology 74:3-14, 2007; Shen J. et al., Journal of Immunological Methods 318:65-74, 2007; Wu C. et al., Nature Biotech. 25:1290-1297, 2007) .
La totalidad de dichos formatos utiliza conectores para fusionar el nïcleo del anticuerpo (IgA, IgD, IgE, IgG o IgM) a una proteïna adicional de uniïn (por ejemplo scFv) o para fusionar, por ejemplo, dos fragmentos Fab o scFv (Fischer N. y Lïger O., Pathobiology 74:3-14, 2007) . Aunque resulta evidente que los conectores presentan ventajas para la manipulaciïn de los anticuerpos biespecïficos, tambiïn pueden provocar problemas en contextos terapïuticos. En efecto, estos pïptidos forïneos podrïan inducir una respuesta inmunolïgica contra el conector mismo o contra la uniïn entre la proteïna y el conector. Ademïs, la naturaleza flexible de estos pïptidos provoca que presenten una mayor tendencia al corte proteolïtico, potencialmente conduciendo a una pobre estabilidad del anticuerpo, a agregaciïn y a una inmunogenicidad incrementada. Ademïs, puede resultar deseable conservar funciones efectoras, tales como, por ejemplo, la citotoxicidad dependiente del complemento (CDC) o la citotoxicidad celular dependiente de anticuerpos (ADCC) , que se encuentran mediadas por la parte Fc, mediante el mantenimiento de un elevado grado de similitud a anticuerpos naturales. De esta manera, idealmente, el objetivo debe ser el desarrollo de anticuerpos biespecïficos que presentan una estructura general muy similar a los anticuerpos naturales (por ejemplo IgA, IgD, IgE, IgG o IgM) , con diferencias mïnimas respecto a las secuencias humanas.
En un enfoque, se han producido anticuerpos biespecïficos que son muy similares a los anticuerpos naturales, utilizando la tecnologïa del cuadroma (ver Milstein C. y Cuello A.C., Nature 305:537-40, 1983) , basada en la fusiïn somïtica de dos lïneas celulares de hibridoma diferentes que expresan anticuerpos monoclonales murinos con las especificidades deseadas del anticuerpo biespecïfico. Debido al apareamiento aleatorio de las cadenas pesada y ligera de dos anticuerpos diferentes dentro de la lïnea celular de hibridoma (o cuadroma) hïbrido resultante, se generan hasta diez especies diferentes de anticuerpo de entre las que ïnicamente una es el anticuerpo biespecïfico funcional deseado. Debido a la presencia de productos secundarios incorrectamente apareados, y rendimientos de producciïn significativamente reducidos, resultan necesarios procedimientos sofisticados de purificaciïn (ver, por ejemplo, Morrison S.L., Nature Biotech. 25:1233-1234, 2007) . En general, se mantiene el mismo problema de productos secundarios mal apareados en el caso de que se utilicen tïcnicas de expresiïn recombinante.
Un enfoque para evitar el problema de los productos secundarios mal apareados, que se conoce como “botïn en ojal”, pretende forzar el apareamiento de dos cadenas pesadas de anticuerpos diferentes mediante la introducciïn de mutaciones en los dominios CH3 para modificar la interfaz de contacto. En una cadena se sustituyen aminoïcidos voluminosos por aminoïcidos con cadenas laterales cortas, para crear un “ojal”. A la inversa, se introducen aminoïcidos con cadenas laterales grandes en el otro dominio CH3, para crear un “botïn”. Mediante la coexpresiïn de dichas dos cadenas pesadas (y dos cadenas ligeras idïnticas, las cuales deben ser apropiadas para ambas cadenas pesadas) , se observaron rendimientos elevados de formaciïn de heterodïmeros ('botïn-ojal') frente a la formaciïn de homodïmeros ('ojal-ojal' o 'botïn-botïn') (Ridgway J.B., Presta LG., Carter P. y documento nï WO1996/027011) . El porcentaje de heterodïmeros pudo incrementarse adicionalmente mediante remodelaje de las superficies de interacciïn de los dos dominios CH3 utilizando un enfoque de expresiïn fïgica y la introducciïn de un puente disulfuro para estabilizar los heterodïmeros (Merchant A.M. et al., Nature Biotech. 16:677-681, 1998; Atwell S., Ridgway J.B., Wells J.A., Carter P., J. Mol. Biol. 270:26-35, 1997) . Se describen nuevos enfoques para la tecnologïa de botïn-en-ojal en, por ejemplo, el documento EP nï 1870459A1. Aunque este formato aparentemente resulta muy atractivo, en la actualidad no se dispone de datos que describan la progresiïn hacia el uso clïnico. Una
importante limitaciïn de esta estrategia es que las cadenas ligeras de los dos anticuerpos parentales deben ser idïnticas para evitar el apareamiento incorrecto y la formaciïn de molïculas inactivas. De esta manera, esta tïcnica no resulta apropiada para el desarrollo sencillo de anticuerpos biespecïficos bivalentes recombinantes contra dos antïgenos partiendo de dos anticuerpos contra el primer y segundo antïgenos, debido a que las cadenas pesadas de estos anticuerpos y/o las cadenas ligeras idïnticas deben optimizarse.
Xie Z. et al., J. Immunol. Methods 286:95-101, 2005, se refieren a un nuevo formato de anticuerpo biespecïfico utilizando scFv en combinaciïn con tecnologïa de botïn-en-ojal para la parte Fc.
Chan L. et al., Mol. Immunol. 41:527-538, 2004, dan a conocer un anticuerpo monoespecïfico bivalente en el que los dominios CH y VL en ambos brazos han sido intercambiados, creando de esta manera dos veces un constructo VH-CL:VL-CH1. Sin embargo, en dicha publicaciïn el ïnfases recae sobre la influencia de estos cambios estructurales sobre las funciones efectoras.
El documento nï WO 93/06217 da a conocer el acoplamiento de dos fragmentos de anticuerpo monoespecïfico o biespecïfico utilizando un residuo de cisteïna con un tiol libre.
El documento nï WO 99/37791 da a conocer la utilizaciïn de la interacciïn CL-CH1 como andamiaje de heterodimerizaciïn para constructos de anticuerpo biespecïfico o multiespecïfico.
Descripciïn resumida de la invenciïn La invenciïn se refiere a un anticuerpo biespecïfico bivalente, que comprende:
a) la cadena ligera y la cadena pesada de un anticuerpo que se une especïficamente a un primer antïgeno, y b) la cadena ligera y la cadena pesada de un anticuerpo de uniïn especïfico a un segundo antïgeno, en el que los dominios variables VL y VH se sustituyen uno por otro.
Una realizaciïn adicional de la invenciïn es un mïtodo para la preparaciïn de un anticuerpo biespecïfico bivalente 30 segïn la invenciïn, que comprende las etapas de:
a) transformar una cïlula huïsped con:
- vectores que comprenden molïculas de ïcidos nucleicos codificantes de la cadena ligera y la cadena pesada 35 de un anticuerpo que se une especïficamente a un primer antïgeno,
- vectores que comprenden molïculas de ïcidos nucleicos codificantes de la cadena ligera y la cadena pesada de un anticuerpo de uniïn especïfica a un segundo antïgeno, en el que los dominios variables VL y VH se sustituyen uno por otro,
b) cultivar la cïlula huïsped bajo condiciones que permitan la sïntesis de dicha molïcula de anticuerpo, y c) recuperar dicha molïcula de anticuerpo a partir de dicho cultivo.
Una realizaciïn adicional de la invenciïn es una cïlula huïsped que comprende:
- vectores que comprenden molïculas de ïcidos nucleicos codificantes de la cadena ligera y la cadena pesada de un anticuerpo que se une especïficamente a un primer antïgeno,
- vectores que comprenden molïculas de ïcidos nucleicos codificantes de la cadena ligera y la cadena pesada de un anticuerpo de uniïn especïfica a un segundo antïgeno, en... [Seguir leyendo]
Reivindicaciones:
1. Anticuerpo biespecïfico bivalente, que comprende:
a) la cadena ligera y la cadena pesada de un anticuerpo que se une especïficamente a un primer antïgeno, y b) la cadena ligera y la cadena pesada de un anticuerpo de uniïn especïfico a un segundo antïgeno, en el que los dominios variables VL y VH se sustituyen uno por otro.
2. Anticuerpo segïn la reivindicaciïn 1, caracterizado porque:
el dominio CH3 de una cadena pesada y el dominio CH3 de la otra cadena pesada se reïnen en una interfaz que comprende una interfaz original entre los dominios CH3 del anticuerpo, en el que se altera dicha interfaz con el fin de estimular la formaciïn del anticuerpo biespecïfico bivalente, en el que la alteraciïn se caracteriza porque:
a) se altera el dominio CH3 de una cadena pesada, de manera que dentro de la interfaz original, el dominio CH3 de una cadena pesada que se reïne con la interfaz original del dominio CH3 de la otra cadena pesada dentro del anticuerpo biespecïfico bivalente, se sustituye un residuo aminoïcido por un residuo aminoïcido con un volumen de cadena lateral mayor, generando de esta manera una protuberancia dentro de la interfaz del dominio CH3 de una cadena pesada que es posicionable en una cavidad dentro de la interfaz del dominio CH3 de la otra cadena pesada, y b) se altera el dominio CH3 de la otra cadena pesada, de manera que dentro de la interfaz original del segundo dominio CH3 que se reïne con la interfaz original del primer dominio CH3 dentro del anticuerpo biespecïfico bivalente,
se sustituye un residuo aminoïcido por un residuo aminoïcido de volumen de cadena lateral mïs pequeïo, generando de esta manera una cavidad en el interior de la interfaz del segundo dominio CH3, en el interior de la cual puede posicionarse una protuberancia dentro de la interfaz del primer dominio CH3,
3. Anticuerpo segïn la reivindicaciïn 2, caracterizado porque:
dicho residuo aminoïcido de volumen de cadena lateral mïs grande se selecciona de entre el grupo que consiste de arginina (R) , fenilalanina (F) , tirosina (Y) y triptïfano (W) .
4. Anticuerpo segïn cualquiera de la reivindicaciïn 2 ï 3, caracterizado porque:
dicho residuo aminoïcido que presenta un volumen menor de cadena lateral se selecciona de entre el grupo que consiste de alanina (A) , serina (S) , treonina (T) y valina (V) .
5. Anticuerpo segïn cualquiera de las reivindicaciones 2 a 4, caracterizado porque ambos dominios CH3 se alteran adicionalmente mediante la introducciïn de cisteïna (C) como aminoïcido en las posiciones correspondientes de cada dominio CH3.
6. Anticuerpo segïn la reivindicaciïn 1, caracterizado porque uno de los dominios constantes de cadena pesada CH3 de ambas cadenas pesadas se sustituye por un dominio constante de cadena pesada CH1, y el otro dominio 45 constante de cadena pesada CH3 se sustituye por un dominio constante de cadena ligera CL.
7. Mïtodo para la preparaciïn de un anticuerpo biespecïfico bivalente segïn la reivindicaciïn 1, que comprende las etapas de:
a) transformar una cïlula huïsped con:
- vectores que comprenden molïculas de ïcidos nucleicos codificantes de la cadena ligera y la cadena pesada de un anticuerpo de uniïn especïfica a un primer antïgeno,
- vectores que comprenden molïculas de ïcidos nucleicos codificantes de la cadena ligera y la cadena pesada de un anticuerpo de uniïn especïfica a un segundo antïgeno, en el que los dominios variables VL y VH se sustituyen uno
por otro, b) cultivar la cïlula huïsped bajo condiciones que permitan la sïntesis de dicha molïcula de anticuerpo, y c) recuperar dicha molïcula de anticuerpo a partir de dicho cultivo.
8. Cïlula huïsped que comprende:
- vectores que comprenden molïculas de ïcidos nucleicos codificantes de la cadena ligera y la cadena pesada de un anticuerpo de uniïn especïfica a un primer antïgeno,
- vectores que comprenden molïculas de ïcidos nucleicos codificantes de la cadena ligera y la cadena pesada de un anticuerpo de uniïn especïfica a un segundo antïgeno, en el que los dominios variables VL y VH se sustituyen uno por otro.
9. Composiciïn del anticuerpo biespecïfico bivalente segïn las reivindicaciones 1 a 6.
10. Composiciïn farmacïutica que comprende un anticuerpo biespecïfico bivalente segïn las reivindicaciones 1 a 6 y por lo menos un excipiente farmacïuticamente aceptable.
Patentes similares o relacionadas:
 Métodos para producir proteínas bicatenarias en bacterias, del 29 de Julio de 2020, de GENENTECH, INC.: Un método para producir un receptor de linfocitos T monoclonal de movilización inmunitaria contra el cáncer (ImmTAC) que comprende una cadena alfa del receptor de linfocitos […]
Métodos para producir proteínas bicatenarias en bacterias, del 29 de Julio de 2020, de GENENTECH, INC.: Un método para producir un receptor de linfocitos T monoclonal de movilización inmunitaria contra el cáncer (ImmTAC) que comprende una cadena alfa del receptor de linfocitos […]
Anticuerpos anti-alfa-sinucleína y procedimientos de uso, del 29 de Julio de 2020, de F. HOFFMANN-LA ROCHE AG: Un anticuerpo anti-alfa-sinucleína humana que comprende (a) HVR-H1 que comprende la secuencia de aminoácidos de SEQ ID NO: 21; (b) HVR-H2 que […]
Formulaciones estabilizadas que contienen anticuerpos anti-receptor de interleucina 4 (IL-4R), del 29 de Julio de 2020, de REGENERON PHARMACEUTICALS, INC.: Una jeringuilla precargada que contiene una formulación farmacéutica líquida estable, en la que la formulación farmacéutica líquida comprende: […]
Métodos y composiciones para tratar y prevenir enfermedades asociadas con la integrina AVB8, del 29 de Julio de 2020, de THE REGENTS OF THE UNIVERSITY OF CALIFORNIA: Un anticuerpo aislado que se une específicamente a la integrina β8 humana e inhibe la adhesión del péptido asociado a latencia (LAP) a ανβ8, en donde el […]
Utilización de anticuerpos optimizados en ADCC para tratar a los pacientes con bajo nivel de respuesta, del 22 de Julio de 2020, de LABORATOIRE FRANCAIS DU FRACTIONNEMENT ET DES BIOTECHNOLOGIES: Utilización de una composición de anticuerpo monoclonal quimérico, humanizado o humano de isotipo IgG1 anti- Rhesus del glóbulo rojo humano cuya […]
Proteínas de unión al antígeno ST2, del 22 de Julio de 2020, de AMGEN INC.: Un anticuerpo aislado que se une a un antígeno ST2 que tiene la secuencia de aminoácidos 19-556 del SEQ ID NO: 1, comprendiendo dicho anticuerpo una secuencia de […]
Método para producir inmunoconjugados de anticuerpo-SN-38 con un enlazador CL2A, del 22 de Julio de 2020, de IMMUNOMEDICS, INC.: Un método para producir un compuesto, CL2A-SN-38, que presenta la estructura, **(Ver fórmula)** que comprende realizar un esquema de reacción como el que se muestra: **(Ver […]
Bloqueo de CD73, del 22 de Julio de 2020, de Innate Pharma: Un anticuerpo aislado que específicamente se une a un polipéptido CD73 humano en la superficie de una célula y que tiene capacidad de neutralizar […]