BASE CRISTALINA DE ESCITALOPRAM Y COMPRIMIDOS ORODISPERSABLES QUE COMPRENDEN LA BASE DE ESCITALOPRAM.
Base cristalina de escitalopram y comprimidos orodispersables que comprenden la base de escitalopram.
La presente invención se refiere a la base cristalina del bien conocido fármaco antidepresivo escitalopram, S-1- [3-(dimetilamino)propil]-1-(4- fluorofenil)-1,3-dihidro-5-isobenzofurancarbonitrilo, a formulaciones de dicha base, a un procedimiento para la preparación de sales purificadas de escitalopram, tales como el oxalato, usando la base, a las sales obtenidas por dicho procedimiento y a formulaciones que contienen tales sales y a un procedimiento para la preparación de la base libre purificada de escitalopram o sales de escipalopram, tales como el oxalato, usando el hidrobromuro, a las sales obtenidas por dicho procedimiento y a formulaciones que contienen tales sales. Finalmente la presente invención se refiere a un comprimido orodispersable que tiene una dureza de al menos 22 N y un tiempo de desintegración oral de menos de 120 s y que comprende un ingrediente farmacéutico activo adsorbido sobre una carga soluble en agua, en el que dicho ingrediente farmacéutico activo tiene un punto de fusión en el intervalo de 40-100ºC, así como a un método para la fabricación de un comprimido orodispersable
Tipo: Resumen de patente/invención. Número de Solicitud: W06000366DK.
Solicitante: H. LUNDBECK A/S.
Nacionalidad solicitante: Dinamarca.
Dirección: OTTILIAVEJ 9,2500 VALBY-COPENHAGEN.
Inventor/es: DANCER, ROBERT, PETERSEN, HANS, ROCK, MICHAEL, HAROLD, NIELSEN, OLE, LILJEGREN, KEN, ELIASEN,HELLE.
Fecha de Solicitud: 22 de Junio de 2006.
Fecha de Publicación: .
Fecha de Concesión: 27 de Enero de 2010.
Clasificación Internacional de Patentes:
- C07D307/87 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 307/00 Compuestos heterocíclicos que contienen ciclos de cinco miembros que tienen un átomo de oxígeno como único heteroátomo del ciclo. › Benzo [c] furanos; Benzo [c] furanos hidrogenados.
Clasificación PCT:
- C07D307/87 C07D 307/00 […] › Benzo [c] furanos; Benzo [c] furanos hidrogenados.
Fragmento de la descripción:
Base cristalina de escitalopram y comprimidos orodispersables que comprenden la base de escitalopram.
La presente invención se refiere en un primer aspecto a la base cristalina del bien conocido fármaco antidepresivo escitalopram, S-1-[3-(dimetilamino)propil]-1-(4-fluorofenil)-1,3-dihidro-5-isobenzofurancarbonitrilo, a formulaciones de dicha base, a procedimientos para la preparación de la base libre purificada de escitalopram y de sus sales, usando la base cristalina o el hidrobromuro de escitalopram, a las sales obtenidas por dicho procedimiento y a formulaciones que contienen tales sales. En un segundo aspecto, la presente invención se refiere a comprimidos orodispersables que comprenden un ingrediente farmacéutico activo adsorbido sobre una carga soluble en agua, en los que dicho ingrediente farmacéutico activo tiene un punto de fusión en el intervalo de 40-100ºC, y a métodos para la fabricación de tales comprimidos orodispersables.
Antecedentes de la invención
El escitalopram es un bien conocido fármaco antidepresivo que ha estado ahora en el mercado durante algunos años y tiene la siguiente estructura:
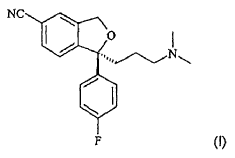
Es un agente inhibidor selectivo de la reabsorción de la serotonina (5-hidroxitriptamina; 5-HT) que actúa centralmente y, por consiguiente, tiene actividades antidepresivas.
El escitalopram fue descrito por primera vez en el documento US 4.943.590. El escitalopram preparado se aisló como el oxalato. Además, la base de escitalopram se obtuvo como un aceite. El escitalopram se comercializa como el oxalato.
El escitalopram puede prepararse, entre otros, según los procedimientos descritos en los documentos WO 2003006449 y WO 2003051861.
El hidrobromuro cristalino de escitalopram se describió en el documento WO 2004056791.
Los comprimidos orodispersables han ganado considerable atención en los últimos años. Los comprimidos orodispersables se desintegran en la boca y, subsiguientemente, se tragan. Esto es ventajoso para pacientes que tienen dificultades para tragar las a formulaciones de comprimidos convencionales y, consecuentemente, los comprimidos orodispersables aumentan no sólo la comodidad sino también el cumplimiento del paciente. El ingrediente farmacéutico activo que se incorpora en el comprimido que se desintegra con rapidez puede disolverse parcial o completamente en la boca, permitiendo de este modo que se produzca la absorción desde la cavidad oral.
En la bibliografía se han aplicado varios términos a los comprimidos orodispersables. Entre éstos están comprimidos que se disuelven con rapidez, comprimidos de dispersión rápida, comprimidos que se desintegran con rapidez, comprimidos que funden, comprimidos de disolución rápida, comprimidos que se disuelven en la boca y comprimidos de desintegración rápida.
Para fabricar comprimidos de desintegración rápida se han aplicado varios métodos. Muchos de estos métodos hacen uso de equipamiento no convencional y técnicas de procesado complicadas tales como la liofilización y las técnicas de espumación. Muchos de estos métodos dan lugar a comprimidos de desintegración rápida con mala resistencia de los comprimidos y baja friabilidad. Esto puede impedir el uso de materiales y procedimientos de envasado convencionales.
El documento WO2005/018617 describe el uso de la granulación convencional en estado fundido para producir gránulos a partir de un compuesto con bajo punto de fusión que funde o se ablanda a o por debajo de 37ºC, y un excipiente soluble en agua. Los gránulos se mezclaron subsiguientemente con un ingrediente farmacéutico activo y excipientes adicionales y, a continuación, se comprimieron para dar comprimidos de disolución rápida de baja dureza, 2,2 kP o menos.
Por lo tanto, son deseables métodos de fabricación que estén basados en el uso de equipamiento y técnicas convencionales y que den lugar a comprimidos de desintegración rápida con suficiente resistencia.
Ahora, se ha encontrado que la base de escitalopram puede obtenerse como un producto cristalino muy puro, el cual puede manipularse fácilmente y formularse convenientemente en comprimidos y otras formas farmacéuticas. Además, se ha encontrado que puede obtenerse una purificación eficiente de escitalopram durante la fabricación de escitalopram (por ejemplo, de la sal de oxalato) cristalizando la base, y formando después opcionalmente una sal a partir de la base.
Asimismo, se ha encontrado que puede obtenerse una purificación muy eficiente de escitalopram durante la fabricación de escitalopram (por ejemplo, de la base libre o de la sal de oxalato) cristalizando el hidrobromuro, y formando después opcionalmente la base o una sal, que no sea el hidrobromuro, a partir de la base.
Estos procedimientos de purificación son particularmente útiles para separar compuestos intermedios que estén estrechamente relacionados estructuralmente con el escitalopram, en particular compuestos que sólo difieran del escitalopram en el sustituyente situado en la posición 5 del anillo de isobenzofurano y/o que carezcan de uno o de ambos grupos metilo, y compuestos intermedios que tengan propiedades físicas/químicas que sean próximas a las de escitalopram, por ejemplo los 1-[3-(dimetilamino)propil]-1-(4-fluorofenil)-1,3-dihidro-isobenzofuranos que tienen un átomo de halógeno (en particular bromo y cloro), una amida o un éster en la posición 5 del anillo de isobenzofurano, o los compuestos de fórmula (III).
Además, se ha desarrollado un nuevo tipo de comprimidos orodispersables con alta resistencia y baja friabilidad. Estos nuevos comprimidos orodispersables pueden fabricarse en un procedimiento de aglomeración en estado fundido, un procedimiento de revestimiento en estado fundido o un procedimiento de extrusión en estado fundido, que pueden realizarse usando equipamiento convencional de aglomeración o extrusión de una masa fundida. En el procedimiento, el ingrediente farmacéutico activo se calienta a una temperatura superior, alrededor de o ligeramente inferior al punto de fusión para aglomerar la masa fundida o las partículas de la carga revestidas con la masa fundida. Los aglomerados o las partículas de la carga revestidas se mezclan subsiguientemente con excipientes adecuados y se comprimen para dar comprimidos.
Se ha encontrado que la base de escitalopram es adecuada para formularla en tales comprimidos orodispersables.
Sumario de la invención
La presente invención proporciona la base cristalina de escitalopram con la fórmula (I):
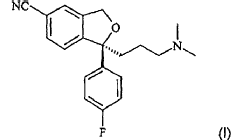
En un segundo aspecto, la invención proporciona un procedimiento para la fabricación de la base libre de escitalopram o de una de sus sales, preferiblemente el oxalato, en el que el hidrobromuro de escitalopram se precipita en forma cristalina en un disolvente y se separa del disolvente, se recristaliza opcionalmente una o más veces y, a continuación, se transforma en la base libre de escitalopram o en una de sus sales farmacéuticamente aceptable siempre que la sal de escitalopram fabricada no se sea el hidrobromuro.
En un tercer aspecto, la invención se refiere a la base libre de escitalopram pura cristalina o al oxalato de escitalopram preparados por el anterior procedimiento de la invención.
En un cuarto aspecto, la invención proporciona un procedimiento para la fabricación de una sal de escitalopram, preferiblemente el oxalato, en el cual la base libre de escitalopram se precipita en forma sólida en un disolvente y se separa del disolvente, se recristaliza opcionalmente una o más veces y, a continuación, se transforma en una sal farmacéuticamente aceptable de escitalopram.
En un quinto aspecto, la invención se refiere al oxalato de escitalopram puro cristalino preparado por el anterior procedimiento de la invención.
En un sexto aspecto, la invención se refiere a un procedimiento para la reducción de la cantidad de escitalopram, N-óxido ((S-1-[3-(dimetilamino)propil]-1-(4-fluorofenil)-1, 3-dihidroiso-benzofuran-5-carbonitrilo, N-óxido) en la base libre de escitalopram o en una de sus sales, que comprende disolver la base libre de escitalopram en éter dietílico y separar el escitalopram, N-óxido, como un material sólido.
En un séptimo aspecto, la invención se refiere a un comprimido orodispersable que...
Reivindicaciones:
1. La base libre de escitalopram, en forma sólida.
2. La base libre de escitalopram según la reivindicación 1, caracterizada porque comprende escitalopram cristalino.
3. La base libre de escitalopram según la reivindicación 2, caracterizada porque es al menos 90% cristalina, particularmente al menos 95% cristalina y más particularmente al menos 98% cristalina.
4. La base libre de escitalopram según la reivindicación 1, caracterizada porque es cristalina.
5. Una composición farmacéutica, que contiene la base libre de escitalopram según las reivindicaciones 1 a 4.
6. Un procedimiento para la fabricación de la base libre de escitalopram o de una de sus sales, caracterizado porque se precipita hidrobromuro de escitalopram en forma cristalina en un disolvente y se separa del disolvente, se recristaliza opcionalmente una o más veces y, a continuación, se transforma en la base libre de escitalopram o en una de sus sales siempre que la sal de escitalopram fabricada no se sea el hidrobromuro.
7. Un procedimiento según la reivindicación 6 para la fabricación de la base libre de escitalopram o de una de sus sales, caracterizado porque se precipita hidrobromuro de escitalopram a partir de un escitalopram bruto.
8. Un procedimiento según la reivindicación 6 ó 7 para la fabricación de la base libre de escitalopram o de una de sus sales, caracterizado porque, mediante el procedimiento, se separan de o se reducen en el escitalopram una o más impurezas de las fórmulas (II) o (III)
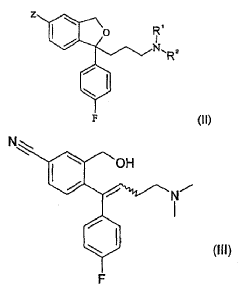
en las que Z es un átomo de halógeno, un grupo ciano o un grupo -CONH2,
R1 y R2 son independientemente un átomo de hidrógeno o un grupo metilo, siempre que si ambos de R1 y R2 son un grupo metilo, entonces Z no puede ser un grupo ciano,
y el enlace dibujado como una línea en zigzag en la fórmula (III) indica que la configuración alrededor del doble enlace puede ser E- o Z-.
9. El procedimiento según la reivindicación 8, en el que las impurezas son de la fórmula (II) en la que
Z es un átomo de bromo o de cloro y R1 y R2 son ambos un grupo metilo,
Z es un grupo -CONH2 y R1 y R2 son ambos un grupo metilo, o
Z es un grupo ciano, R1 es un átomo de hidrógeno y R2 es un grupo metilo;
o de la fórmula (III), en la que la configuración alrededor del doble enlace es Z.
10. El procedimiento según cualquiera de las reivindicaciones 7 a 9, en el que el escitalopram bruto se somete a una purificación inicial antes de que se precipite el hidrobromuro de escitalopram en forma cristalina.
11. El procedimiento según cualquiera de las reivindicaciones 6 a 10, caracterizado porque el hidrobromuro de escitalopram se transforma en la base libre de escitalopram o en oxalato de escitalopram.
12. Una base cristalina de escitalopram, o una sal de oxalato de escitalopram, caracterizada porque contiene menos que 0,20% de impurezas diferentes de R-citalopram, particularmente menos que 0,10%.
13. La base cristalina, o la sal de oxalato, según la reivindicación 12, caracterizada porque contiene menos que 0,10% de cualquier impureza particular diferente de R-citalopram.
14. La base cristalina de escitalopram, o una sal de oxalato de escitalopram, preparada por el procedimiento de cualquiera de las reivindicaciones 6-11.
15. La base, o la sal de oxalato, según la reivindicación 14, caracterizada porque contiene menos que 0,20% de impurezas diferentes de R-citalopram, particularmente menos que 0,10%.
16. La base cristalina, o la sal de oxalato, según la reivindicación 15, caracterizada porque contiene menos que 0,10% de cualquier impureza particular diferente de R-citalopram.
17. Un procedimiento para la fabricación de una sal de escitalopram, caracterizado porque se precipita la base libre de escitalopram en forma sólida en un disolvente y se separa del disolvente, se recristaliza opcionalmente una o más veces y a continuación se transforma en una sal de escitalopram.
18. Un procedimiento según la reivindicación 17 para la fabricación de una sal de escitalopram, caracterizado porque la base libre de escitalopram se precipita a partir de un escitalopram bruto.
19. Un procedimiento según la reivindicación 17 ó 18 para la fabricación de una sal de escitalopram, caracterizado porque, mediante el procedimiento, se separa de o se reduce en el escitalopram una impureza de la fórmula (II)
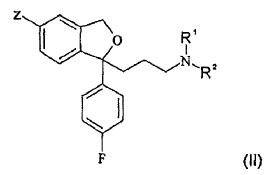
en la que Z es un grupo ciano, R1 es un grupo metilo y R2 es un átomo de hidrógeno.
20. El procedimiento según la reivindicación 19, en el que Z es un átomo de bromo.
21. El procedimiento según cualquiera de las reivindicaciones 18 a 20, en el que el escitalopram bruto se somete a una purificación inicial antes de que se precipite el hidrobromuro de escitalopram en forma cristalina.
22. El procedimiento según cualquiera de las reivindicaciones 18 a 21, caracterizado porque la base libre de escitalopram se transforma en oxalato de escitalopram.
23. Un procedimiento para la reducción de la cantidad de escitalopram, N-óxido en la base libre de escitalopram o en una de sus sales, que comprende disolver la base libre de escitalopram en éter de dietilo y separar el escitalopram, N-óxido como un material sólido.
Patentes similares o relacionadas:
Ligandos novedosos del receptor de estrógenos, del 17 de Julio de 2019, de Karo Pharma AB: Compuesto de fórmula (I) o un éster, una amida, un carbamato o una sal farmacéuticamente aceptable del mismo, que incluye una sal de tal […]
Profármacos de sales de amonio cuaternario, del 16 de Agosto de 2017, de Alkermes Pharma Ireland Limited: Un compuesto profármaco de un fármaco pariente que contiene aminaa terciariaa en el que dicho compuesto profármaco del fármaco pariente tiene la fórmula:**Fórmula** en el […]
Procedimiento para la purificación de sales farmacéuticamente aceptables de escitalopram, del 6 de Abril de 2016, de H. LUNDBECK A/S: Un procedimiento para la purificación de una mezcla en bruto de una sal farmacéuticamente aceptable de escitalopram que comprende: (a) disolver dicha sal en […]
Procedimiento para la preparación de citalopram diol racémico y/o S- O R-citalopram dioles y el uso de tales dioles para la preparación de citalopram racémico, R-citalopram y/o S-citalopram, del 6 de Junio de 2012, de H. LUNDBECK A/S: Un procedimiento para la preparación de la base libre y/o la sal de adición de ácido de 4-[4-(dimetilamino)-1-(4- fluorofenil)-1-hidroxibutil]-3-(hidroximetil) […]
MÉTODO PARA LA FABRICACIÓN DE ESCITALOPRAM, del 16 de Noviembre de 2011, de H. LUNDBECK A/S: Un método para la resolución de 4-[4-(dimetilamino)-1-(4'-fluorofenil)-1-hidroxibutil]-3-(hidroximetil)-benzonitrilo a partir de una mezcla racémica […]
ALQUILACIÓN ASIMÉTRICA DE CARBONILO, del 5 de Septiembre de 2011, de SANDOZ AG: Procedimiento para la alquilación asimétrica de un grupo carbonilo en un compuesto (compuesto K) que contiene un grupo carbonilo y un grupo de […]
BASE CRISTALINA DEL ESCITALOPRAM Y COMPRIMIDOS ORODISPERSABLES QUE COMPRENDEN LA BASE DEL ESCITALOPRAM, del 13 de Abril de 2011, de H. LUNDBECK A/S: Base cristalina de escitalopram y comprimidos orodispersables que comprenden la base de escitalopram. La presente invención se refiere a la base cristalina […]
ANTAGONISTAS CÍCLICOS UNIDOS A C DEL RECEPTOR P2Y1 ÚTILES EN EL TRATAMIENTO DE AFECCIONES TROMBÓTICAS, del 23 de Febrero de 2011, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto con la Fórmula (I): **Fórmula** o uno de sus estereoisómeros, tautómeros, sales o solvatos farmacéuticamente aceptables, en la que: el anillo A […]