PROCEDIMIENTO PARA FABRICAR BROMURO DE 3(R)-(2-HIDROXI-2,2-DITIEN-2-ILACETOXI)-1-(3-FENOXIPROPIL)-1-AZONIABICICLO(2,2,2)-OCTANO.
Procedimiento para fabricar bromuro de 3(R)-(2-hidroxi-2,2-ditien-2-ilacetoxi)-1-(3-fenoxipropil)-1-azoniabiciclo[2.
2.2]octano haciendo reaccionar éster 1-azabiciclo[2.2.2]oct-3(R)ílico del ácido 2-hidroxi-2,2-ditien-2-ilacético y bromuro de 3-fenoxipropilo, en el que la reacción tiene lugar en un disolvente o mezcla de disolventes que tiene un punto de ebullición de 50 a 210ºC y se selecciona del grupo consistente en cetonas y éteres cíclicos
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2007/006278.
Solicitante: LABORATORIOS ALMIRALL, S.A..
Nacionalidad solicitante: España.
Inventor/es: BUSQUETS BAQUE,NURIA, PAJUELO LORENZO,FRANCESCA.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07D453/02 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 453/00 Compuestos heterocíclicos que contienen sistemas cíclicos de quinuclidina o isoquinuclidina, p. ej. alcaloides de quinina. › que contienen sistemas cíclicos de quinuclidina sin otra condensación.
Clasificación PCT:
- C07D453/02 C07D 453/00 […] › que contienen sistemas cíclicos de quinuclidina sin otra condensación.
Descripción:
Procedimiento para fabricar bromuro de 3(R)-(2-hidroxi-2,2-ditien-2-ilacetoxi)-1-(3-fenoxipropil)-1-azoniabiciclo[2,2,2]-octano.
La presente invención se refiere a un procedimiento para la fabricación de 3(R)-(2-hidroxi-2,2-ditien-2-ilacetoxi)-1-(3-fenoxipropil)-1-azoniabiciclo[2.2.2]octano.
Este compuesto, así como un procedimiento para su fabricación, se describen en el documento WO 01/04118 A2.
Los autores de la invención han encontrado de forma inesperada que mediante una selección apropiada de las condiciones de reacción se puede optimizar el procedimiento descrito en el documento WO 01/04118 A2 permitiendo disminuir el tiempo de reacción y la cantidad de disolventes y reaccionantes de alquilación utilizados, al mismo tiempo que se aumenta el rendimiento y se mantiene el nivel de impurezas.
Estos objetos se pueden conseguir llevando a cabo la reacción de cuaternarización entre el éster 1-azabiciclo[2.2.2]oct-3(R)ílico del ácido 2-hidroxi-2,2-ditien-2-ilacético y el bromuro de 3-fenoxipropilo en un disolvente o mezcla de disolventes que tiene(n) un punto de ebullición de 50 a 210ºC y que se selecciona(n) del grupo consistente en cetonas y éteres cíclicos. Se prefiere el uso de un único disolvente.
A continuación se presentan algunos ejemplos de cetonas o éteres cíclicos que se pueden utilizar como disolventes para llevar a cabo la invención: acetona, metil etil cetona, metil isobutil cetona, fenil metil cetona, ciclopentanona, dioxano, tetrahidrofurano, etiltetrahidrofurano. Los disolventes preferidos se seleccionan del grupo consistente en acetona, dioxano o tetrahidrofurano. Un disolvente particularmente preferido es tetrahidrofurano.
En particular, ha sido ventajoso el uso de una relación de equivalentes de bromuro de 3-fenoxipropilo respecto al éster 1-azabiciclo[2.2.2]oct-3(R)ílico del ácido 2-hidroxi-2,2-ditien-2-ilacético en el intervalo de 1,0 a 3,0, más preferiblemente de 1,1 a1,5, siendo la más preferible de 1,2 a 1,3.
En otra realización preferida, el éster 1-azabiciclo[2.2.2]oct-3(R)ílico del ácido 2-hidroxi-2,2-ditien-2-ilacético se suspende (o se disuelve) en un volumen de disolvente o mezcla de disolventes comprendido entre 1,7 y 7 litros de disolvente(s) por mol de éster 1-azabiciclo[2.2.2]oct-3(R)ílico del ácido 2-hidroxi-2,2-ditien-2-ilacético. Más preferiblemente, el éster se suspende (o se disuelve) en un volumen de disolvente comprendido entre 2 y 4 litros por mol de éster.
Bajo estas condiciones se ha demostrado que es adecuado permitir que la mezcla reaccione durante un período de tiempo que no supere 24 horas, preferiblemente no mayor de 12 horas, más preferiblemente no mayor de 9 horas y, siendo lo más preferible de hasta 6 horas.
Se obtienen resultados particularmente buenos cuando el éster 1-azabiciclo[2.2.2]oct-3(R)ílico del ácido 2-hidroxi-2,2-ditien-2-ilacético se suspende en 2 a 4 l de tetrahidrofurano por mol de éster 1-azabiciclo[2.2.2]oct-3(R)ílico del ácido 2-hidroxi-2,2-ditien-2-ilacético, se añaden de 1,2 a 1,3 equivalentes de bromuro de 3-fenoxipropilo a la suspensión resultante y se agita durante no más de 9 horas, con preferencia no más de 6 horas a reflujo en una atmósfera inerte.
Los siguientes ejemplos muestran métodos ilustrativos para preparar compuestos de acuerdo con la presente invención, y no pretenden limitar el ámbito de la invención.
Sección experimental
Ejemplo comparativo 1
(Según el documento WO 01/04118)
Se suspendieron 0,6 mmol de éster 1-azabiciclo[2.2.2]oct-3(R)ílico del ácido 2-hidroxi-2,2-ditien-2-ilacético en 4 ml de CH3CN y 6 ml de CHCl3. Se añadieron 0,48 ml de bromuro de 3-fenoxipropilo a la suspensión resultante y la mezcla se agitó durante 72 h a temperatura ambiente en una atmósfera inerte. Los disolventes se evaporaron seguidamente proporcionando bromuro de 3(R)-(2-hidroxi-2,2-ditien-2-ilacetoxi)-1-(3-fenoxipropil)-1-azoniabiciclo[2.2.2]octano (90% de rendimiento). El producto se aísla por filtración a temperatura ambiente y se determina el nivel de bromuro de 3-fenoxipropilo que es de 117 ppm.
Ejemplos 2 a 12
Se suspendieron los moles de éster 1-azabiciclo[2.2.2]oct-3(R)ílico del ácido 2-hidroxi-2,2-ditien-2-ilacético indicados en la columna B en la cantidad (columna E) de disolvente indicado en la columna D. A continuación, se añadió a la suspensión resultante la cantidad de bromuro de 3-fenoxipropilo resultante de multiplicar la columna B por la columna C y la mezcla se agitó durante 6 horas a reflujo en una atmósfera inerte. Los disolventes se evaporaron seguidamente proporcionando bromuro de 3(R)-(2-hidroxi-2,2-ditien-2-ilacetoxi)-1-(3-fenoxipropil)-1-azoniabiciclo[2.2.2]octano. El producto se aisló por filtración a temperatura ambiente y se determinaron el rendimiento y el nivel de bromuro de 3-fenoxipropilo, tal como se indica en las columnas F y G, respectivamente.
La siguiente tabla resume los resultados del ejemplo comparativo 1 y de los ejemplos 2 a 12 de la presente invención.
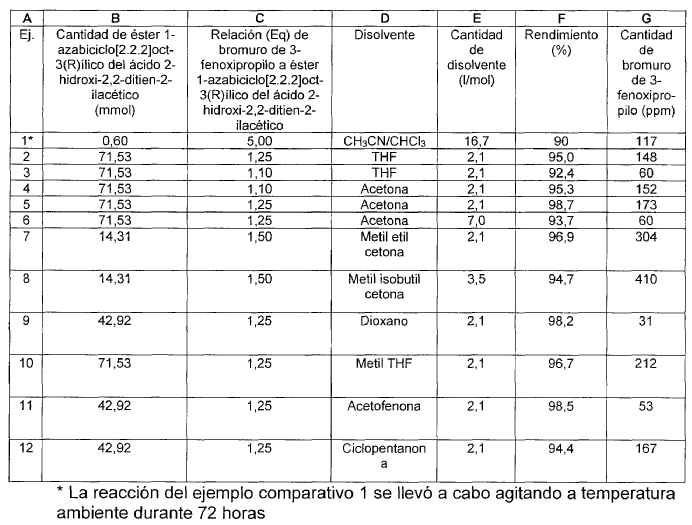
Como se puede apreciar de los resultados de la tabla 1 se muestra que el procedimiento de la presente invención permite acortar el tiempo de reacción y reducir la cantidad de bromuro de 3-fenoxipropilo empleado, aumentando al mismo tiempo el rendimiento y manteniendo todavía la cantidad de impurezas de bromuro de 3-fenoxipropilo genotóxico a un nivel aceptable por debajo de 500 ppm.
Reivindicaciones:
1. Procedimiento para fabricar bromuro de 3(R)-(2-hidroxi-2,2-ditien-2-ilacetoxi)-1-(3-fenoxipropil)-1-azoniabiciclo[2.2.2]octano haciendo reaccionar éster 1-azabiciclo[2.2.2]oct-3(R)ílico del ácido 2-hidroxi-2,2-ditien-2-ilacético y bromuro de 3-fenoxipropilo, en el que la reacción tiene lugar en un disolvente o mezcla de disolventes que tiene un punto de ebullición de 50 a 210ºC y se selecciona del grupo consistente en cetonas y éteres cíclicos
2. Procedimiento según la reivindicación 1, en el que la relación de equivalentes de bromuro de 3-fenoxipropilo respecto al éster 1-azabiciclo[2.2.2]oct-3(R)ílico del ácido 2-hidroxi-2,2-ditien-2-ilacético varía en el intervalo de 1,0 a 3,0.
3. Procedimiento según la reivindicación 2, en el que la relación de equivalentes varía en el intervalo de 1,1 a 1,5.
4. Procedimiento según la reivindicación 3, en el que la relación de equivalentes varía en el intervalo de 1,2 a 1,3.
5. Procedimiento según cualquiera de las reivindicaciones anteriores, en el que se suspende o disuelve el éster 1-azabiciclo[2.2.2]oct-3(R)ílico del ácido 2-hidroxi-2,2-ditien-2-ilacético en un volumen de disolvente o mezcla de disolventes comprendido entre 1,7 y 7 litros de disolvente(s) por mol de éster 1-azabiciclo[2.2.2]oct-3(R)ílico del ácido 2-hidroxi-2,2-ditien-2-ilacético.
6. Procedimiento según la reivindicación 5, en el que el volumen de disolvente está comprendido entre 2 y 4 litros por mol de éster 1-azabiciclo[2.2.2]oct-3(R)ílico del ácido 2-hidroxi-2,2-ditien-2-ilacético.
7. Procedimiento según cualquiera de las reivindicaciones anteriores, en el que el disolvente se selecciona del grupo consistente en acetona, dioxano y tetrahidrofurano.
8. Procedimiento según la reivindicación 7, en el que el disolvente es tetrahidrofurano.
9. Procedimiento según cualquiera de las reivindicaciones anteriores, en el que la mezcla se deja reaccionar durante un período de tiempo que no supera 24 horas.
10. Procedimiento según la reivindicación 9, en el que el período de tiempo no es mayor de 12 horas.
11. Procedimiento según la reivindicación 10, en el que el período de tiempo no es mayor de 9 horas.
12. Procedimiento según la reivindicación 11, en el que el período de tiempo no es mayor de 6 horas.
Patentes similares o relacionadas:
Compuestos que tienen actividad antagonista del receptor muscarínico y agonista del receptor beta2 adrenérgico, del 29 de Julio de 2020, de CHIESI FARMACEUTICI S.P.A.: Un compuesto de fórmula general I **(Ver fórmula)** en la que Q es un grupo de fórmula Q1 **(Ver fórmula)** Z es H u OH; […]
Profármacos de treprostinil, del 15 de Abril de 2020, de Corsair Pharma, Inc: Un compuesto según la fórmula (IA) **(Ver fórmula)** en la que, Z es -OH, -OR11 o P1; R11 es alquilo, alquilo sustituido, cicloalquilo, cicloalquilo sustituido, […]
Nuevos derivados bicíclicos que tienen actividad agonista beta2 adrenérgica y actividad antagonista muscarínica M3, del 26 de Febrero de 2020, de ALMIRALL, S.A: Un compuesto de fórmula (A), o una sal farmacéuticamente aceptable, o N-óxido, o derivado marcado isotópicamente del mismo, **(Ver fórmula)** en donde • Ar representa […]
Compuestos intermedios para la preparación de compuestos de pirazolo[1,5-a]pirimidina substituidos como inhibidores de quinasas Trk, del 8 de Enero de 2020, de ARRAY BIOPHARMA, INC.: Un compuesto de Fórmula II **(Ver fórmula)** en la que: Y (es (i) fenilo opcionalmente substituido con uno o más substituyentes […]
Inhibidores de la glucosilceramida sintasa, del 27 de Noviembre de 2019, de GENZYME CORPORATION: Un compuesto representado por la siguiente fórmula estructural, **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo.
Método para preparar inhibidores de la glucosilceramida sintasa, del 21 de Octubre de 2019, de GENZYME CORPORATION: Un método para preparar un compuesto de la fórmula,**Fórmula** en la que: n es 1, 2 o 3; m es 1; t es 0, 1 o 2; y es 1 o 2; z es 0, 1 […]
Compuestos de amida de quinuclidina sustituida geminal como agonistas de receptores alfa-7 nicotínicos de acetilcolina, del 2 de Octubre de 2019, de Axovant Sciences GmbH: Un compuesto de amida de quinuclidina sustituida geminal representado por la fórmula (I): **(Ver fórmula)** en donde el resto C(R1)(R2) forma un carbociclo (de […]
Derivados de ciclohexil y quinuclidinil carbamato que tienen actividades de agonista beta2 adrenérgicos y antagonistas muscarínicos M3, del 4 de Septiembre de 2019, de ALMIRALL, S.A: Un compuesto de Fórmula (I), o una sal farmacéuticamente aceptable o derivado deuterado del mismo:**Fórmula** en la que, R representa un átomo de hidrógeno […]