NUEVO CAMSILATO DE AMLODIPINA Y MÉTODO PARA SU PREPARACIÓN.
Camsilato de amlodipina que tiene la estructura de la fórmula (1)
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/KR2002/000543.
Solicitante: Hanmi Holdings Co., Ltd.
Nacionalidad solicitante: República de Corea.
Dirección: No. 45, Bangi-dong Songpa-gu Seoul 138-828 REPUBLICA DE COREA.
Inventor/es: WOO, JONG SOO, KIM, NAM, DU, LEE, GWAN, SUN, MOON, YOUNG, HO, LEE,KYUNG IK.
Fecha de Publicación: .
Fecha Solicitud PCT: 28 de Marzo de 2002.
Clasificación Internacional de Patentes:
- C07D211/90 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 211/00 Compuestos heterocíclicos que contienen ciclos hidrogenados de piridina, no condensados con otros ciclos. › Atomos de carbono que tienen tres enlaces a heteroátomos con a lo sumo un enlace a halógeno.
Clasificación PCT:
- C07D211/90 C07D 211/00 […] › Atomos de carbono que tienen tres enlaces a heteroátomos con a lo sumo un enlace a halógeno.
Clasificación antigua:
- C07D211/84 C07D 211/00 […] › con heteroátomos o con átomos de carbono que tienen tres enlaces a heteroátomos, con a lo sumo un enlace a halógeno, unidos directamente a los átomos de carbono del ciclo.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Finlandia, Chipre.
PDF original: ES-2360787_T3.pdf
Fragmento de la descripción:
Sector técnico de la invención
La presente invención se refiere a camsilato de amlodipina de fórmula (1) y a un procedimiento para su preparación.
**(Ver fórmula)**
Antecedentes de la invención
La amlodipina, nombre genérico para el compuesto de fórmula (2), dicarboxilato de 3-etil-5-metil-2-(2-aminoetoximetil)-4-(2-clorofenil)-6-metil-1,4-dihidro-3,5,-piridina es un bloqueador del canal del calcio a largo plazo, útil para el tratamiento de enfermedades cardiovasculares, tales como estenocarditis, hipertensión y cardioplegia congestiva.
**(Ver fórmula)**
La publicación de patente europea nº 89167 da a conocer varios tipos diferentes de sales farmacéuticamente aceptables de amlodipina. Una sal farmacéuticamente aceptable es preparada por adición de un ácido farmacéuticamente aceptable para formar una sal no tóxica de amlodipina de tipo ácido y entre los ejemplos de la misma se incluyen el clorhidrato, bromhidrato, sulfato, fosfato o fosfato ácido, acetato, maleato, fumarato, lactato, tartarato, citrato y gluconato. Entre estas sales, el maleato es la más preferible.
La amlodipina en forma de base libre es útil para utilización farmacéutica. No obstante, dado que la amlodipina amorfa muestra baja estabilidad es preferible administrarla en forma de una sal de un ácido farmacéuticamente aceptable.
La publicación de patente coreana nº 95-6710 sugiere que una sal farmacéuticamente aceptable debe cumplir cuatro exigencias físico-químicas: alta solubilidad, buena estabilidad, no higroscopicidad y capacidad de proceso para formulación de tabletas.
La mayor parte de sales de amlodipina son amorfas y es difícil prepararlas en estado puro. Además, una sal de amlodipina por adición de ácido que cumple todas las exigencias antes mencionadas no ha sido desarrollada todavía. Por ejemplo, se ha descubierto que incluso el maleato de amlodipina, que se ha propuesto como la forma farmacéuticamente más preferible, tiene una solubilidad relativamente alta en agua, pero se degrada en una solución al cabo de varias semanas.
La patente coreana publicada nº 95-7228 y el documento EP 0244944 dan a conocer que el bencensulfonato de amlodipina (designado a continuación “besilato de amlodipina”) muestra una elevada solubilidad y elevada estabilidad y tiene propiedades adecuadas para preparar formulaciones farmacéuticas. No obstante, el besilato de amlodipina se deriva de ácido bencensulfónico tóxico y, por lo tanto, existe una cuestión de seguridad.
Los presentes inventores se han propuesto desarrollar una nueva amlodipina cristalina que satisface todas las características requeridas.
Resumen de la invención
De acuerdo con ello, es un objetivo principal de la presente invención dar a conocer una nueva sal cristalina de amlodipina que es poco tóxica y tiene características farmacéuticamente aceptables.
De acuerdo con un aspecto de la presente invención, se da a conocer un método para la preparación de una sal cristalina de amlodipina utilizando ácido canforsulfónico relativamente poco tóxico en comparación con el ácido bencensulfónico.
De acuerdo con otro aspecto de la presente invención, se da a conocer camsilato de amlodipina que tiene la estructura de la fórmula (1) preparado con el procedimiento de la invención.
De acuerdo con otro aspecto de la presente invención, se da a conocer un compuesto farmacéutico para el tratamiento de enfermedades cardiovasculares que comprende el camsilato de amlodipina como componente efectivo.
Breve descripción de los dibujos
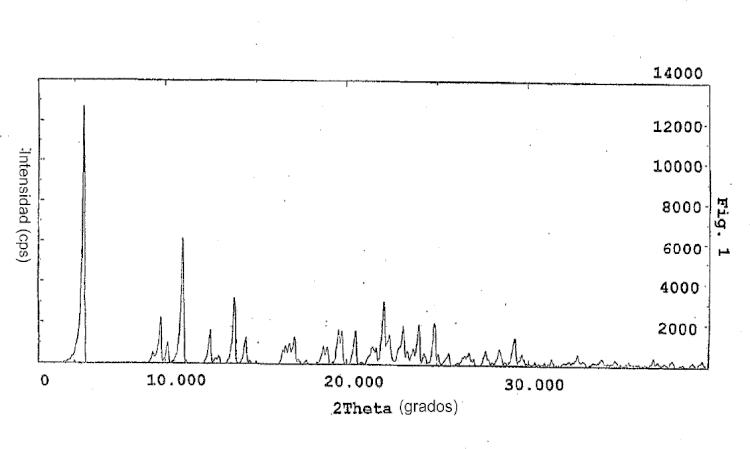
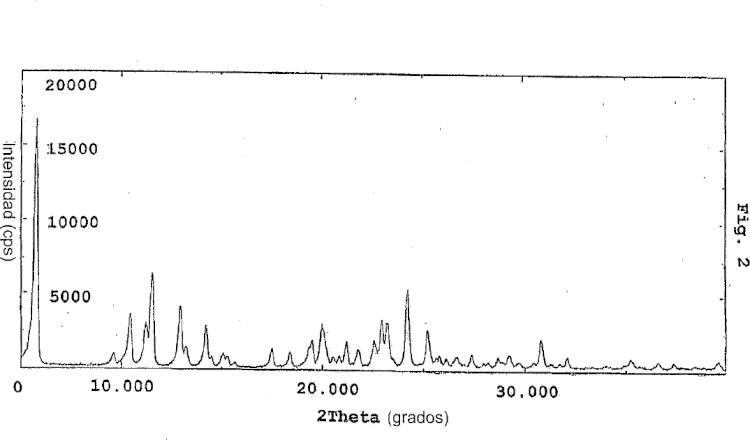
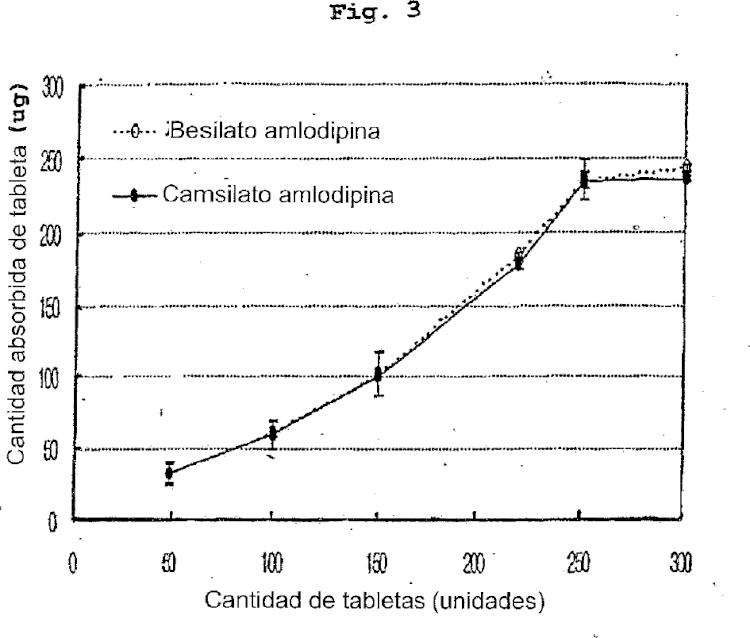
Los anteriores y otros objetivos y características de la presente invención quedarán evidentes a partir de la siguiente descripción de la invención, considerada en relación con los dibujos adjuntos que muestran respectivamente; Figura 1: escaneado por difracción por rayos X del camsilato de amlodipina de la presente invención; Figura 2: escaneado por difracción por rayos X de besilato de amlodipina; Figura 3: características adhesivas del camsilato de amlodipina de la invención y del besilato de amlodipina.
Descripción detallada de la invención
La presente invención da a conocer un procedimiento para la preparación de una sal cristalina de amlodipina utilizando ácido canforsulfónico de baja toxicidad. De manera detallada, el procedimiento de la presente invención comprende las siguientes etapas:
1) disolver amlodipina de fórmula (2) en un disolvente orgánico; 2) añadir una solución de ácido canforsulfónico en un disolvente orgánico a la solución de amlodipina y agitar la mezcla durante un periodo suficiente para formar un sólido;
3) filtrar, lavar y secar el sólido.
**(Ver fórmula)**
Una sal cristalina de amlodipina, de acuerdo con la presente invención, puede ser preparada por adición de un ácido a la solución de amlodipina o añadiendo un ácido a la mezcla de reacción para preparar la amlodipina.
Es preferible utilizar amlodipina, según la etapa 1) en la concentración de 3 a 60% en peso para favorecer de manera eficaz la cristalización, más preferentemente, de 10 a 30% en peso.
El ácido canforsulfónico, que se puede utilizar en la etapa 2) incluye, sin que sea limitativo, ácido (1S)-(+)-10canforsulfónico de fórmula (3), ácido (1R)-(-)10-canforsulfónico de fórmula (4) y ácido 10-canforsulfónico racémico. Es preferible utilizar ácido canforsulfónico en una cantidad de 0,1 a 5,0 equivalentes basándose en la cantidad de amlodipina, más preferentemente de 1,0 a 1,3 equivalentes.
Un disolvente orgánico utilizado en las etapas 1) ó 2) incluye metanol, etanol, isopropanol y acetonitrilo.
El sólido en la etapa 2) se forma preferentemente a una temperatura de -10 a 50ºC, más preferentemente de 0 a 25ºC.
**(Ver fórmula)**
Además, la presente invención da a conocer camsilato de amlodipina preparado por el procedimiento de la invención que tiene baja toxicidad y características farmacéuticamente aceptables.
Se ha demostrado que la sal cristalina de amlodipina de la invención, camsilato de amlodipina, tiene una forma cristalina distinta con respecto al compuesto amorfo o besilato de amlodipina mediante escaneado de difracción por rayos X (ver figuras 1 y 2) y tiene una estructura de fórmula (1) mediante análisis NMR.
**(Ver fórmula)**
10 Es bien conocido que el besilato de amlodipina es el más adecuado para una formulación farmacéutica, pero tiene el problema de la estabilidad debido a la utilización de ácido bencensulfónico que es tóxico. Para solucionar este problema, la presente invención utiliza ácido canforsulfónico relativamente menos tóxico que el ácido bencensulfónico.
La toxicidad del ácido canforsulfónico se compara con la del ácido bencensulfónico, según los datos del Registro de 15 Efectos Tóxicos de Sustancias Químicas (RTECS) y los resultados comparativos se describen en la tabla 1.
<Tabla 1>
Sustancia Ruta de administración Sujeto animal Dosis Referencia Ácido bencensulfónico Oral Rata LD50 890 ml/kg AIHAAP 23,95,1962 Cutánea Gato LDLO 10 g/kg JPETAB 84,358,1945 Oral Pájaros salvajes LD50 75 mg/kg TXAPA9 21,315,1972 Ácido (1S)-(+)-10canforsulfónico Subcutánea Ratón LD50 2502 mg/kg PHARAT 1,150,1946 Ácido ()-10canforsulfónico Oral Codorniz LD50 >316 mg/kg EESADV 6,149,1982 LD50: 50% dosis fetal, LDLO: dosis fetal mínimaTal como se ha mostrado en la tabla 1, dado que es imposible comparar el valor LD50 de la misma especie entre ellas, es difícil comparar directamente la toxicidad del ácido canforsulfónico con la del ácido bencensulfónico, no obstante, se puede confirmar que el ácido canforsulfónico utilizado en la presente invención muestra menor toxicidad que el ácido bencensulfónico.
Además, la presente invención da a conocer un compuesto farmacéutico para el tratamiento de enfermedades cardiovasculares que comprende el camsilato de amlodipina de la invención como ingrediente efectivo y excipientes, portadores o diluyentes farmacéuticamente aceptables.
Una composición farmacéutica puede ser preparada de acuerdo con cualquiera de los procedimientos convencionales. En la preparación de la composición, el ingrediente activo es preferentemente mezclado o diluido con un portador o embebido dentro de un portador que puede adoptar la forma de una... [Seguir leyendo]
Reivindicaciones:
1. Camsilato de amlodipina que tiene la estructura de la fórmula (1)
2. Procedimiento para la preparación de camsilato de amlodipina, según la reivindicación 1, que comprende las etapas:
**(Ver fórmula)**
1) disolver amlodipina de fórmula (2) en un disolvente orgánico; 2) añadir una solución de ácido canforsulfónico en un disolvente orgánico a la solución de amlodipina y agitar la mezcla durante un periodo suficiente para formar un sólido;
3) filtrar, lavar y secar el sólido.
**(Ver fórmula)**
3. Procedimiento, según la reivindicación 2, en el que el ácido canforsulfónico es seleccionado del grupo que consiste en ácido (1S)-(+)-10-canforsulfónico de fórmula (3), ácido (1R)-(-)-10-canforsulfónico de fórmula (4) y ácido racémico 10-canforsulfónico.
**(Ver fórmula)**
15 4. Procedimiento, según la reivindicación 2, en el que la concentración de amlodipina de la mezcla utilizada en la etapa 2) es de 3 a 60% en peso.
5. Procedimiento, según la reivindicación 2, en el que el ácido canforsulfónico es utilizado en una cantidad de 0,1 a 5,0 equivalentes basándose en la cantidad de amlodipina.
6. Procedimiento, según la reivindicación 2, en el que el disolvente orgánico utilizado en las etapas 1) ó 2) es 20 seleccionado entre el grupo que consiste en metanol, etanol, isopropanol y acetonitrilo.
7. Procedimiento, según la reivindicación 2, en el que el sólido es formado a una temperatura de -10 a 50ºC.
8. Composición farmacéutica para tratar una enfermedad cardiovascular que comprende camsilato de amlodipina de la reivindicación 1 como un ingrediente efectivo.
Patentes similares o relacionadas:
DERIVADOS DE 4-FENILDIHIDROPIRIDINA PARA EL TRATAMIENTO Y/O PREVENCIÓN DE UNA INFECCIÓN O ENFERMEDAD CAUSADA POR HELICOBACTER, del 23 de Abril de 2020, de FUNDACION INSTITUTO DE INVESTIGACION SANITARIA ARAGON: Derivados de 4-fenildihidropiridina de fórmula I y composiciones farmacéuticas de los mismos, donde el significado para R1, R2, […]
Derivados de 4-fenildihidropiridina para el tratamiento y/o prevención de una infección o enfermedad causada por Helicobacter, del 20 de Abril de 2020, de FUNDACION INSTITUTO DE INVESTIGACION SANITARIA ARAGON: Derivados de 4-fenildihidropiridina para el tratamiento y/o prevención de una infección o enfermedad causada por Helicobacter. Derivados de 4-fenildihidropiridina de fórmula […]
Clorhidrato de lercanidipino amorfo, del 13 de Noviembre de 2019, de RECORDATI IRELAND LIMITED: Hidrocloruro de lercanidipino amorfo que presenta una pureza de por lo menos el 95%.
Aril dihidropiridinonas y piperidinonas como inhibidores de MGAT2, del 13 de Febrero de 2019, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de Formula (I):**Fórmula** o un estereoisomero, un tautomero o una sal farmaceuticamente aceptable, en la que: indica un enlace simple […]
Arilhidrazidas que contienen una fracción de 2-piridona como agentes antibacterianos selectivos, del 29 de Octubre de 2018, de ABAC THERAPEUTICS, S.L: Un compuesto de la fórmula (I): **Fórmula** una sal, solvato, isótopo, polimórfo o tautómero farmacéuticamente aceptable del mismo, en donde A es […]
Aril dihidropiridinonas y piperidinonas como inhibidores de MGAT2, del 18 de Mayo de 2016, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de Formula (I):**Fórmula** o un estereoisomero, un tautomero, una sal farmaceuticamente aceptable o un solvato del mismo, en la que: […]
Preparación de dihidropiridinas, del 10 de Febrero de 2016, de LABORATORIOS LESVI, S.L.: Un proceso para la preparación de butirato de clevidipina que comprende la etapa: (i) hacer reaccionar un compuesto de fórmula (I): **Fórmula** […]
 Agente reductor de triglicéridos y agente de mejora del hiperinsulinismo, del 8 de Febrero de 2016, de KOWA COMPANY LTD.: Uso de un compuesto de pitavastatina y amlodipino o una sal del mismo para
- producir un agente reductor de triglicéridos o
- para producir un agente preventivo y/o terapéutico […]
Agente reductor de triglicéridos y agente de mejora del hiperinsulinismo, del 8 de Febrero de 2016, de KOWA COMPANY LTD.: Uso de un compuesto de pitavastatina y amlodipino o una sal del mismo para
- producir un agente reductor de triglicéridos o
- para producir un agente preventivo y/o terapéutico […]