Camsilato de amlodipina amorfo, estable, procedimiento para la reparación del mismo y composición para su administración oral.
Camsilato de amlodipina amorfo, preparado por disolución de camsilato de amlodipina cristalino en un disolvente orgánico seleccionado entre el grupo que comprende acetona,
metanol, etanol, acetonitrilo, tetrahidrofurano, dioxano, acetato de metilo, acetato de etilo, cloruro de metileno, cloroformo y una mezcla de los mismos, y eliminando el disolvente de la solución resultante.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/KR2004/000136.
Solicitante: Hanmi Science Co., Ltd. .
Nacionalidad solicitante: República de Corea.
Dirección: 550 Dongtangiheung-ro, Dongtan-myeon, Hwaseong-si Gyeonggi-do 445-813 REPUBLICA DE COREA.
Inventor/es: WOO, JONG SOO, KIM, NAM, DU, LEE, GWAN, SUN, CHANG, YOUNG KIL, MOON, YOUNG, HO, LEE,KYUNG IK.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07D211/84 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 211/00 Compuestos heterocíclicos que contienen ciclos hidrogenados de piridina, no condensados con otros ciclos. › con heteroátomos o con átomos de carbono que tienen tres enlaces a heteroátomos, con a lo sumo un enlace a halógeno, unidos directamente a los átomos de carbono del ciclo.
- C07D211/90 C07D 211/00 […] › Atomos de carbono que tienen tres enlaces a heteroátomos con a lo sumo un enlace a halógeno.
PDF original: ES-2500292_T3.pdf


Fragmento de la descripción:
Camsilato de amlodipina amorfo, estable, procedimiento para la preparación del mismo y composición para su administración oral.
Sector de la invención
La presente invención se refiere a una forma amorfa del camsilato de amlodipina, que tiene una elevada solubilidad y buena estabilidad de almacenamiento, haciendo referencia también a una composición para la administración oral del mismo.
Antecedentes de la invención
La amorodipina, nombre genérico para el compuesto (3-etil-5-metil-2-(2-aminoetoxi-metil)-4-(2-clorofenil)-6-metil-1,4- dihidro-3,5-piridina dicarboxilato), es un bloqueador del canal del calcio de larga duración útil para el tratamiento de enfermedades cardiovasculares tales como angina de pecho, hipertensión y cardioplegia congestiva.
La amlodipina en forma de base libre es útil para uso farmacéutico, pero muestra estabilidad reducida. Por lo tanto, se administra preferentemente en forma de una sal de un ácido farmacéuticamente aceptable.
La publicación de la patente coreana n° 1995-671 sugiere que una sal farmacéuticamente aceptable debe cumplir cuatro exigencias fisicoquímicas: elevada solubilidad, buena estabilidad, no higroscopicidad y capacidad de proceso para formulación en tabletas.
La publicación de la patente coreana n° 1995-7228 da a conocer que el bencensulfonato de amlodipina (a continuación, designado besilato de amlodipina) muestra características adecuadas para formulación farmacéutica, incluyendo elevada solubilidad y buena estabilidad.
Los presentes inventores han sugerido también en el documento WO 2/79158 A1, que un camsilato de amlodipina cristalino es farmacéuticamente estable.
Resumen de la invención
Es un objetivo principal de la presente invención dar a conocer una forma mejorada del camsilato de amlodipina, que tiene una estabilidad y solubilidad más elevadas que las sales convencionales de amlodipina.
De acuerdo con otro aspecto de la presente invención, se da a conocer camsilato de amlodipina amorfo preparado por disolución del camsilato de amlodipina cristalino en un disolvente orgánico, y eliminando el disolvente de la solución resultante, de acuerdo con la reivindicación 1.
De acuerdo con otro aspecto de la presente invención, se da a conocer una composición farmacéutica para el tratamiento de enfermedades cardiovasculares que comprende el camsilato de amlodipina amorfo como ingrediente activo, de acuerdo con la reivindicación 2.
Breve descripción de los dibujos
Los anteriores y otros objetivos y características de la presente invención quedarán evidentes de la siguiente descripción de la misma en conjunción con los dibujos siguientes que se acompañan, que muestran respectivamente:
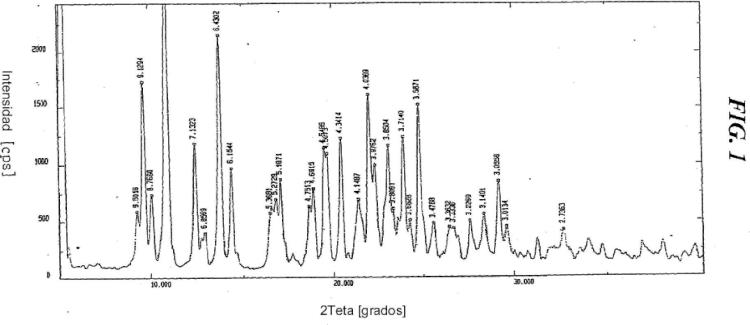
La figura 1, una exploración por difracción de rayos X del camsilato de amlodipina cristalino;
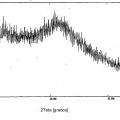
La figura 2, una exploración por difracción de rayos X del camsilato de amlodipina amorfo de la invención;
La figura 3, una exploración por calorimetría de barrido diferencial (DSC) del camsilato de amlodipina cristalino; y
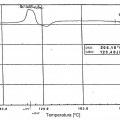
La figura 4, una exploración por calorimetría de barrido diferencial (DSC) del camsilato de amlodipina amorfo de la invención.
Descripción detallada de la invención
El camsilato de amlodipina de la invención es sustancialmente amorfo y termodinámicamente estable, y tiene elevada solubilidad en agua y buena estabilidad de almacenamiento.
El camsilato de amlodipina amorfo de la invención puede ser preparado por solución de una forma cristalina de camsilato de amlodipina en un disolvente orgánico, y eliminando el disolvente de la solución resultante para obtener una forma amorfa del camsilato de amlodipina.
Se incluyen entre los ejemplos de disolvente orgánico que se puede utilizar de manera adecuada en la presente invención, la acetona, metanol, acetonitrilo, tetrahidrofurano y dioxano, acetato de etilo o de metilo, cloruro de metileno, cloroformo y una mezcla de los mismos, preferentemente una mezcla de etanol y cloruro de metileno.
El disolvente orgánico puede ser eliminado por evaporación rápida de disolventes, secado por pulverización, secado por rodillos, precipitación de disolvente o liofilización, entre los que es preferible el secado por pulverización, dado que el camsilato de amlodipina amorfo resultante es termodinámicamente estable. De modo más preferente, se puede utilizar un sistema de secado por pulverización en ciclo cerrado que puede reciclar el medio de secado en términos de seguridad y eficiencia económica del procedimiento.
En el secado por pulverización, un gas inerte, tal como argón, nitrógeno y dióxido de carbono o aire puede ser utilizado como gas de secado. Las temperaturas de entrada y salida del mismo pueden depender del punto de ebullición del disolvente utilizado. Por ejemplo, la temperatura de entrada puede variar entre 5 y 14°C, preferentemente entre 6 y 125°C, y la temperatura de salida puede variar entre 45 y 1°C, preferentemente entre 5 y 8°C. Utilizando condiciones de secado por pulverización apropiadas, se puede formar un producto que tiene un tamaño de partículas uniforme.
En el secado por pulverización o por rodillos se utiliza, preferentemente, un disolvente que tiene un punto de ebullición (p.e) inferior al punto de coagulación del producto de la invención. Cuando se lleva a cabo el secado a presión atmosférica, se puede utilizar preferentemente un disolvente que tiene un punto de ebullición de 8°C o menor. Si el secado es llevado a cabo a presión reducida, se puede utilizar un disolvente que tiene un punto de ebullición superior a 8°C.
En la precipitación de disolvente, se puede disolver camsilato de amlodipina cristalino en un disolvente orgánico adecuado, seguido de la adición de un disolvente no polar en una cantidad adecuada al mismo, para inducir la precipitación del producto de la invención. Entre los disolventes no polares preferentes utilizados en la precipitación se incluyen éteres tales como isopropileter, o hidrocarburos aromáticos tales como benceno y tolueno. El disolvente no polar debe ser, por lo menos parcialmente, miscible con el disolvente orgánico adecuado. Un ejemplo representativo de la combinación de disolvente es diclorometano/metanol/isopropileter. El sólido precipitado es sometido preferentemente a filtrado rápido y secado, para evitar la formación de cristales. Asimismo, se puede utilizar un gas portador, tal como aire, para generar burbujas en solución.
Asimismo, la precipitación de disolvente puede ser aplicada directamente a la mezcla de reacción obtenida después de la formación de camsilato de amlodipina cristalino.
Por su parte, el secado por congelación puede ser llevado a cabo a una temperatura adecuada, dependiendo del punto de congelación del disolvente utilizado, por ejemplo, unos 12°C cuando se utiliza dioxano como disolvente.
El camsilato de amlodipina cristalino utilizado para la presente invención se puede fabricar de acuerdo con el procedimiento que se da a conocer en el documento WO 2/79158 A1.
La presente invención da a conocer asimismo un compuesto amorfo de camsilato de amlodipina, preparado por disolución de camsilato de amlodipina cristalino, tensoactivos, portadores inorgánicos insolubles en agua u otros aditivos en un disolvente orgánico apropiado, y eliminando el disolvente de la solución resultante.
Además, la presente invención da a conocer además una composición farmacéutica para el tratamiento de enfermedades cardiovasculares que comprende el camsilato de amlodipina amorfo de la invención como ingrediente activo y excipientes, portadores o diluyentes farmacéuticamente aceptables.
La composición farmacéutica de la presente invención puede ser formulada de acuerdo con cualquiera de los procedimientos convencionales. La formulación puede adoptar forma de tabletas, pastillas, polvos, bolsas, elixir, suspensión, emulsión, solución, jarabe, aerosol, cápsulas de gelatina blanda o dura, solución estéril inyectable o polvo envasado estéril.
Se incluyen entre los portadores excipientes y diluyentes adecuados, los almidones, sacarosa, lactosa, dextrosa, gelatina, sorbitol, manitol, silicato cálcico, celulosa, metil celulosa, celulosa microcristalina, polivinilpirrolidona, agua, metilhidroxibenzoatos, propilhidroxibenzoatos, talco, estearato magnésico y aceite mineral. Las formulaciones
pueden incluir además materiales de carga, agentes anti-aglutinantes, desintegrantes, lubrificantes, agentes humectantes, agentes de sabor, emulsificantes, conservantes y similares. Las composiciones de la invención se pueden formular a efectos de facilitar una liberación rápida, mantenida o retardada del ingrediente... [Seguir leyendo]
Reivindicaciones:
1. Camsilato de amlodipina amorfo, preparado por disolución de camsilato de amlodipina cristalino en un disolvente orgánico seleccionado entre el grupo que comprende acetona, metanol, etanol, acetonitrilo, tetrahidrofurano, dioxano, acetato de metilo, acetato de etilo, cloruro de metileno, cloroformo y una mezcla de los mismos, y
eliminando el disolvente de la solución resultante.
2. Compuesto farmacéutico para el tratamiento de una enfermedad cardiovascular, que comprende el camsilato de amlodipina amorfo de la reivindicación 1 como ingrediente activo y un portador farmacéuticamente aceptable.
Patentes similares o relacionadas:
DERIVADOS DE 4-FENILDIHIDROPIRIDINA PARA EL TRATAMIENTO Y/O PREVENCIÓN DE UNA INFECCIÓN O ENFERMEDAD CAUSADA POR HELICOBACTER, del 23 de Abril de 2020, de FUNDACION INSTITUTO DE INVESTIGACION SANITARIA ARAGON: Derivados de 4-fenildihidropiridina de fórmula I y composiciones farmacéuticas de los mismos, donde el significado para R1, R2, […]
Derivados de 4-fenildihidropiridina para el tratamiento y/o prevención de una infección o enfermedad causada por Helicobacter, del 20 de Abril de 2020, de FUNDACION INSTITUTO DE INVESTIGACION SANITARIA ARAGON: Derivados de 4-fenildihidropiridina para el tratamiento y/o prevención de una infección o enfermedad causada por Helicobacter. Derivados de 4-fenildihidropiridina de fórmula […]
Clorhidrato de lercanidipino amorfo, del 13 de Noviembre de 2019, de RECORDATI IRELAND LIMITED: Hidrocloruro de lercanidipino amorfo que presenta una pureza de por lo menos el 95%.
Aril dihidropiridinonas y piperidinonas como inhibidores de MGAT2, del 13 de Febrero de 2019, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de Formula (I):**Fórmula** o un estereoisomero, un tautomero o una sal farmaceuticamente aceptable, en la que: indica un enlace simple […]
Arilhidrazidas que contienen una fracción de 2-piridona como agentes antibacterianos selectivos, del 29 de Octubre de 2018, de ABAC THERAPEUTICS, S.L: Un compuesto de la fórmula (I): **Fórmula** una sal, solvato, isótopo, polimórfo o tautómero farmacéuticamente aceptable del mismo, en donde A es […]
Aril dihidropiridinonas y piperidinonas como inhibidores de MGAT2, del 18 de Mayo de 2016, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de Formula (I):**Fórmula** o un estereoisomero, un tautomero, una sal farmaceuticamente aceptable o un solvato del mismo, en la que: […]
Preparación de dihidropiridinas, del 10 de Febrero de 2016, de LABORATORIOS LESVI, S.L.: Un proceso para la preparación de butirato de clevidipina que comprende la etapa: (i) hacer reaccionar un compuesto de fórmula (I): **Fórmula** […]
 Agente reductor de triglicéridos y agente de mejora del hiperinsulinismo, del 8 de Febrero de 2016, de KOWA COMPANY LTD.: Uso de un compuesto de pitavastatina y amlodipino o una sal del mismo para
- producir un agente reductor de triglicéridos o
- para producir un agente preventivo y/o terapéutico […]
Agente reductor de triglicéridos y agente de mejora del hiperinsulinismo, del 8 de Febrero de 2016, de KOWA COMPANY LTD.: Uso de un compuesto de pitavastatina y amlodipino o una sal del mismo para
- producir un agente reductor de triglicéridos o
- para producir un agente preventivo y/o terapéutico […]