Producto intermedio de dimeglumina de fosaprepitant, fosaprepitant neutro y dimeglumina de fosaprepitant amorfa, y procesos para sus preparaciones.
Un proceso para la preparación de una forma cristalina de ácido dibencil {3-[2(R)-[(1R)-1-[3,
5- bis(trifluorometil)fenil]etoxi]-3(S)-(4-fluorofenil)morfolin-4-il}-5-oxo-4,5-dihidro-[1,2,4]-triazol-1-il}fosfónico de fórmula (II),**Fórmula**
y el proceso comprende:
(a) proporcionar una solución de ácido dibencil {3-[2(R)-[(1R)-1-[3,5-bis(trifluorometil)fenil]etoxi]-3(S)-(4- fluorofenil)morfolin-4-il}-5-oxo-4,5-dihidro-[1,2,4]-triazolil}fosfónico en un solvente o una mezcla de solventes;
(b) adicionar un anti-solvente a la solución del paso (a) para hacer precipitar un sólido; y
(c) recuperar la forma cristalina de ácido dibencil{3-[2(R)-[(1R)-1-[3,5-bis(trifluorometil)fenil]etoxi]-3(S)-(4- fluorofenil)morfolin-4-il}-5-oxo-4,5-dihidro-[1,2,4]-triazol-1-il}fosfónico como un precipitado, en cuyo caso la precipitación se lleva a cabo a un rango de temperaturas desde -10 °C a 35 °C.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/IN2009/000408.
Solicitante: Glenmark Generics Limited.
Nacionalidad solicitante: India.
Dirección: Glenmark House HDO-Corporate Building, Wing-A B.D. Sawant Marg Chakala Andheri (East) Mumbai 400099 INDIA.
Inventor/es: GANESHBHATT,NAVIN, RASIKLALTRIVEDI,NIKHIL, KHEDEKAR,MAHESH, SINHA,SUKUMAR, AHMED KHAN,MUBEEN, YADAV,RAMJILAL.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07F9/6558 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07F COMPUESTOS ACICLICOS, CARBOCICLICOS O HETEROCICLICOS QUE CONTIENEN ELEMENTOS DISTINTOS DEL CARBONO, HIDROGENO, HALOGENOS, OXIGENO, NITROGENO, AZUFRE, SELENIO O TELURO (porfirinas que contienen metal C07D 487/22; compuestos macromoleculares C08). › C07F 9/00 Compuestos que contienen elementos de los grupos 5 o 15 del sistema periódico. › que contienen al menos dos heterociclos diferentes o diferentemente sustituidos no condensados entre sí ni con un carbociclo o sistema carbocíclico común.
PDF original: ES-2550003_T3.pdf



Fragmento de la descripción:
Producto intermedio de dimeglumina de fosaprepitant, fosaprepitant neutro y dimeglumina de fosaprepitant amorfa, y procesos para sus preparaciones
Antecedentes de la invención
1. Campo técnico
La presente invención se refiere en términos generales a un proceso para la preparación de un producto intermedio de dimeglumina de fosaprepitant y a su uso en la preparación de dimeglumina de fosaprepitant; a una forma neutra de fosaprepitant, más específicamente en un estado sólido, y a procesos para la preparación de la misma; y a dimeglumina de fosaprepitant amorfa estable y a un proceso para la preparación de la misma.
2. Descripción de la técnica relacionada
La dimeglumina de fosaprepitant está aprobada para el tratamiento de emesis, náusea, toxicidad de terapia cancerosa y se encuentra disponible en el mercado con el nombre de marca EMEND® en los Estados Unidos y el nombre de marca IVEMEND® en Europa, con dosis con potencia de 115 mg de base equivalente.
Dimeglumina de fosaprepitant se conoce químicamente como 1-desoxi-1-(metilamino)D-glucitol[3-[([2R,3S)-2-[(1R)- 1 -[3,5-bis(trifluorometil)fenil]-etoxi]-3-(4-fl uorofenil)4-morfolinil]metil]-2,5-dihidro-5-oxo-1 H-1,2,4-triazol-1 -il]fosfonato (2:1) (sal) y se representa estructuralmente tal como sigue:
**(Ver fórmula)**La publicación de patente estadounidense 2007/0265442 describe el proceso para la preparación de dimeglumina de fosaprepitant usando éster monobencílico de fosaprepitant como un producto intermediario; pero no divulga ni caracteriza el polimorfo obtenido.
La patente estadounidense No. 5,691,336 (la patente '336) describe compuestos de morfolina que incluyen fosaprepitant y sus sales farmacéuticamente aceptables. La patente '336 ejemplifica el proceso para la preparación de dimeglumina de fosaprepitant como polvo amorfo mediante liofilización de una solución acuosa. Véase también J. Med.Chem., 2000, 43,1234-1241, EP0748320 B1 y W02006/060110 A2 para la preparación de dimeglumina de fosaprepitant y sus intermedios.
Fosaprepitant en estado sólido, en forma aislada, no ha sido reportado en la bibliografía hasta la fecha. Los polimorfos de la forma neutra de fosaprepitant tampoco han sido reportados en la bibliografía.
La diferencia en las propiedades físicas de las diferentes formas de estado sólido resulta de la orientación y de las interacciones intermoleculares de moléculas adyacentes o complejos en el sólido. Por consiguiente, los polimorfos son sólidos distintos que comparten la misma fórmula molecular mientras tienen propiedades físicas distintas que pueden ser ventajosas en relación con otras formas de estado sólido del mismo compuesto o complejo.
El descubrimiento de fosaprepitant en estado sólido proporciona una nueva oportunidad para mejorar el desempeño del ingrediente farmacéutico activo (API), dimeglumina de fosaprepitant u otras sales, produciendo formas sólidas de fosaprepitant puro que tienen características mejoradas tales como la estabilidad, la fluidez y la solubilidad. La forma
en estado sólido de un compuesto también puede afectar su comportamiento al compactar y la estabilidad durante el almacenamiento.
De esta manera, existe la necesidad en la técnica de proporcionar fosaprepitant en estado sólido y formas polimórficas posibles de fosaprepitant. La disponibilidad de fosaprepitant neutro en forma sólida sería una ventaja adicionada en la preparación de sales farmacéuticamente aceptables de fosaprepitant, tales como dimeglumina de fosaprepitant, que son útiles en la preparación de formulaciones farmacéuticas, particularmente parenterales, formas de dosificación para el tratamiento de emesis, náusea, toxicidad de terapia en cáncer.
Resumen de la invención
La presente invención se refiere en términos generales a un proceso para la preparación de un producto intermedio de dimeglumina de fosaprepitant y a su uso en la preparación de dimeglumina de fosaprepitant.
En una primera modalidad, la presente invención proporciona un proceso para la preparación de éster dibencílico de fosaprepitant, el cual comprende:
a) proporcionar una solución de éster dibencílico en un solvente o una mezcla de solventes;
b) adicionar un anti-solvente a la solución para precipitar el sólido;
c) recobrar el éster dibencílico de fosaprepitant sólido precipitado y secar.
En una segunda modalidad, la presente invención proporciona un proceso para la preparación de un ácido dibencil {3-[2(R)-[(1R)-1-[3.5-bis(trifluorometil)fenil]etoxi]-3(S)-(4-fluorofenil)morfolin-4-il}-5-oxo-4,5-dihidro-[1,2,4]-triazol-il} fosfónico estable de fórmula (II) (en lo sucesivo denominado éster dibencílico de fosaprepitant).
En una tercera modalidad, la presente invención proporciona un éster dibencílico de fosaprepitant aislado, sólido y estable.
En una cuarta modalidad, la presente invención proporciona una forma cristalina de un éster dibencílico de fosaprepitant.
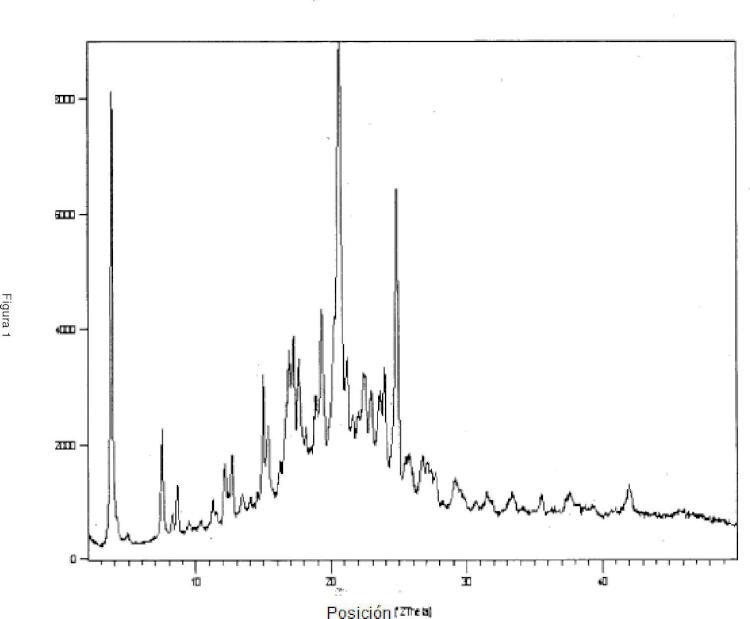
En una quinta modalidad, la presente invención proporciona una forma cristalina de éster dibencílico de fosaprepitant la cual tiene un patrón de difracción de polvo de rayos X (XRPD) que se encuentra de conformidad con la figura 1.
En una sexta modalidad, la presente invención proporciona una forma cristalina de éster dibencílico de fosaprepitant que tiene un termograma de calorimetría de barrido diferencial (DSC) el cual se encuentra sustancialmente de acuerdo con la figura 2.
En una séptima modalidad, la presente invención proporciona un éster dibencílico de fosaprepitant aislado que tiene menos de alrededor de 1.5% de área de ácido monobencil {3-12(R)-[( 1 R)-1 -[3,5-bis(trifluorometil)fenil]etoxi]-3(S)-(4- fluorofenil)morfolin-4-il}-5-oxo-4,5-dihidro-[1,2,4]-triazol-1 -iIJfosfónico de fórmula (III), tal como se mide mediante HPLC.
**(Ver fórmula)**SnO "y
O
MI)
**(Ver fórmula)**En una octava modalidad, la presente invención proporciona un éster dibencílico de fosaprepitant, que tiene menos de aproximadamente 0.5% de ácido monobencil {3-[2(R)-[(1R)-1[3,5-bis(trifluorometil)fenil]etoxi]-3(S)-(4- fluorofenil)morfolin-4-il}-5-oxo-4,5-dihidro-[1,2,4]triazol-1 -iljfosfónico de fórmula (111), tal como se mide mediante HPLC.
En una novena modalidad, la solicitud proporciona un proceso para la purificación de dimeglumina de fosaprepitant, el cual comprende:
a) proporcionar una solución de éster dibencílico de fosaprepitant en un solvente o mezcla de solventes;
b) someter la solución a hidrogenación en presencia de paladio-carbón y N-metil-D-glucamina; y
c) recuperar la dimeglumina de fosaprepitant con la pureza deseada mediante recristalización.
En una décima modalidad, la solicitud proporciona dimeglumina de fosaprepitant, obtenida mediante el proceso descrito en la presente, que tiene al menos aproximadamente 99.7% de pureza con un contenido de aprepitant no mayor a (NMA) aproximadamente 0.15%, tal como se mide mediante HPLC.
En una undécima modalidad, la solicitud proporciona dimeglumina de fosaprepitant que tiene aproximadamente 99.7% de pureza con un contenido de aprepitant NMA 0.05%, tal como se mide mediante HPLC.
En una duodécima modalidad, la solicitud proporciona dimeglumina de fosaprepitant que tiene al menos aproximadamente 99.7% de pureza con un contenido de aprepitant NMA aproximadamente 0.15%, un contenido de éster dibencílico de fosaprepitant que está por debajo del límite de detección, tal como se mide mediante HPLC.
En una decimotercera modalidad, la solicitud se refiere a un proceso para la preparación de una forma neutra de fosaprepitant, el cual comprende a) proporcionar una solución de sal de fosaprepitant en una mezcla de agua y un solvente orgánico; b) adicionar un ácido a la solución en a) para un pH de aproximadamente 1 hasta aproximadamente 5; c) recuperar la forma neutra deseada de fosaprepitant.
En una decimocuarta modalidad, la solicitud se refiere a una forma neutra de fosaprepitant.
La solicitud proporciona una forma neutra de fosaprepitant caracterizada por su patrón de difracción de polvo de rayos X (XRPD), el cual está sustancialmente de conformidad con la figura 3.
La solicitud proporciona una forma neutra de fosaprepitant caracterizada por un termograma de acuerdo con la figura 4, con una endoterma aguda a 207 °C con inicio en aproximadamente 200.79 °C y finalización en aproximadamente 212.92 °C.
La solicitud proporciona la forma neutra, que está en forma de estado sólido, de fosaprepitant obtenida por el proceso descrito en la presente que puede convertirse opcionalmente en una sal farmacéuticamente aceptable de fosaprepitant mediante... [Seguir leyendo]
Reivindicaciones:
1. Un proceso para la preparación de una forma cristalina de ácido dibencil {3-[2(R)-[(1R)-1-[3,5- bis(trifluorometil)fenil]etoxi]-3(S)-(4-fluorofenil)morfolin-4-il}-5-oxo-4,5-dihidro-[1,2,4]-triazol-1 -il}fosfónico de fórmula
(II),
y el proceso comprende:
(a) proporcionar una solución de ácido dibencil {3-[2(R)-[(1R)-1-[3,5-bis(trifluorometil)fenil]etoxi]-3(S)-(4- fluorofenil)morfolin-4-il}-5-oxo-4,5-dihidro-[1,2,4]-triazolil}fosfónico en un solvente o una mezcla de solventes;
(b) adicionar un anti-solvente a la solución del paso (a) para hacer precipitar un sólido; y
(c) recuperar la forma cristalina de ácido dibencil{3-[2(R)-[(1R)-1-[3,5-bis(trifluorometil)fenil]etoxi]-3(S)-(4- fluorofenil)morfolin-4-il}-5-oxo-4,5-dihidro-[1,2,4]-triazol-1 -il}fosfónico como un precipitado, en cuyo caso la precipitación se lleva a cabo a un rango de temperaturas desde -10 °C a 35 °C.
2. El proceso de acuerdo con la reivindicación 1, en el cual el solvente o la mezcla de solventes se seleccionan del grupo consistente en un acetato de etilo, acetato de n-propilo, acetato de isopropilo, acetato de n-butilo, acetato de ¡sobutilo, acetato de butilo terciario y mezclas de los mismos.
3. El proceso de acuerdo con la reivindicación 1 o 2, en el cual la proporción del ácido dibencil {3-[2(R)-[(1R)-1-[3,5- bis(trifluorometil)fenil]etoxi]-3(S)-(4-fluorofenil)morfolin-4-il}-5-oxo-4,5-dihidro-[1,2,4]- triazoliIJfosfónico al solvente es de alrededor de 1:2 hasta 1:10.
4. El proceso de acuerdo con las reivindicaciones 1-3, en el cual el anti-solvente se selecciona del grupo consistente en n-pentano, n-hexanol, n-heptano, ciclohexano o mezclas de los mismos.
5. El proceso de acuerdo con las reivindicaciones 1-4, en el cual la proporción del anti-solvente a la solución del paso (a) es de alrededor de 1:4 a 1:10.
6. El proceso de acuerdo con las reivindicaciones 1-5, en el cual la forma cristalina del precipitado de ácido dibencil {3-[2(R)-[(1R)-1-[3,5-bis(trifluorometil) fenil]etoxi ]-3(S)-(4-fluorofenil)morfolin-4-il}-5-oxo-4,5-dihidro-[1,2,4]-triazol-1- iljfosfónico está caracterizada por un patrón de XRPD con picos en aproximadamente: 3.8, 7.5, 15.0, 16.9, 17.3, 17.6, 19.3, 20.6, 21.2, 23.9 y 24.8 ± 0.2 grados 2 theta.
7. El proceso de acuerdo con las reivindicaciones 1-6, en el cual la forma cristalina del precipitado del ácido dibencil{3-[2(R)-[(1R)-1-[3,S-bis(trifluorometil)fenil]etoxi]-3(S)-(4-fluorofenil)morfolin-4-il}-5-oxo-4,5-dihidro-[1,2,4]-
triazol-1 -iljfosfónico está caracterizada por tener un patrón de difracción de polvo de rayos X (XRPD) que se encuentra sustancialmente de acuerdo con la figura 1.
8. Una forma cristalina aislada de ácido dibencil {3-[2(R)-[(1R)-1-[3,5-bis(trifluorometil)fenil]etoxi]-3(S)-(4- fluorofenil)morfolin-4-il}-5-oxo-4,5-dihidro-[1,2,4]-triazol-1 -iljfosfónico de fórmula (II)
**(Ver fórmula)**O
(IJ>.
cf3
**(Ver fórmula)**Y
CF,
O
(II).
9. La forma cristalina aislada de ácido dibencil {3-[2(R)-[(1R)-1-[3,5bis(trifluorometil)fenil]etoxi]-3(S)-(4- fluorofenil)morfolin-4-il}-5-oxo-4,5-dihidro-[1,2,4]-triazol-1-il}fosfónico según la reivindicación 8, la cual está caracterizada por un patrón de XRPD con picos en: 3.8, 7.5, 15.0, 16.9, 17.3, 17.6, 19.3, 20.6, 21.2, 23.9, y 24.8 ±
5 0.2 grados 2 theta.
10. La forma cristalina aislada de ácido dibencil{3-[2(R)-[(1R)-1-[3,5bis(trifluorometil)fenil]etoxi]-3(S)-(4- fluorofenil)morfolin-4-il}-5-oxo-4,5-dihidro-[1,2,4]-triazol-1-il}fosfónico de fórmula (II) según la reivindicación 8 o 9, la cual está caracterizada por tener un patrón de difracción de polvo de rayos X (XRPD) que se encuentra de acuerdo con la figura 1.
10 11. La forma cristalina aislada de ácido dibencil {3-[2(R)-[(1R)-1-[3,5bis(trifluorometil)fenil]etoxi]-3(S)-(4-
fluorofenil)morfolin-4-il}-5-oxo-4,5-dihidro-[1,2,4]-triazol-1 -iljfosfónico de acuerdo con las reivindicaciones 8-10, la cual tienen menos de 0.5% de área de ácido monobencil {3-[2(R)-[(1R)-1 [3,5-bis(trifluorometil)fenil]-etox¡]-3(S)-(4- fluorofenil)morfolin-4-il}-5-oxo-4,5-dihidro-[1,2,4]-triazol-1 -iljfosfónico de fórmula (III), tal como se mide mediante cromatografía líquida de alto rendimiento.
12. Uso de un compuesto de fórmula II tal como se define en la reivindicación 8 para preparación de dimeglumina de fosaprepitant.
**(Ver fórmula)**CF3
O
ílllv
Patentes similares o relacionadas:
Sofosbuvir en forma cristalina y procedimiento para su preparación, del 20 de Noviembre de 2019, de HC-Pharma AG: Sofosbuvir en forma cristalina a caracterizada por un XRPD que comprende los siguientes picos: 7.96; 10.28; 12.32; 16.64; 18.56; 19.28; 19.88; 20.72; 21.88; 23.08; […]
Compuestos de pirrol como inhibidores de proteínas cinasas ERK y composiciones farmacéuticas que contienen esos compuestos, del 25 de Septiembre de 2019, de VERTEX PHARMACEUTICALS INCORPORATED: Un compuesto de fórmula I:**Fórmula** o una sal farmacéuticamente aceptable del mismo, en el que: R1 es un grupo alifático C1-6, en […]
Derivado de imidazol usado como agente antiviral y uso del mismo en la preparación de un medicamento, del 18 de Septiembre de 2019, de Shandong Danhong Pharmaceutical Co., Ltd: Un compuesto representado por la fórmula (XI) o una sal farmacéuticamente aceptable del mismo,**Fórmula** en donde la unidad estructural**Fórmula** […]
Compuestos usados en la síntesis de oxazolidinonas, del 14 de Agosto de 2019, de MERCK SHARP & DOHME CORP: Un compuesto de la fórmula:**Fórmula** en la que: R1a y R1b se seleccionan independientemente entre H y F, siempre que al menos uno de […]
Compuestos heteroarilo útiles como inhibidores de la enzima activadora SUMO, del 7 de Agosto de 2019, de MILLENNIUM PHARMACEUTICALS, INC.: Una entidad química seleccionada de :**Fórmula** y sales farmacéuticamente aceptables de los mismos.
Inhibidor de proteína quinasa de 2-aminopiridina sustituida, del 13 de Junio de 2019, de Chia Tai Tianqing Pharmaceutical Group Co., Ltd: Un compuesto de Fórmula (III),**Fórmula** en donde el sustituyente R4' en la posición 3 es F, los sustituyentes R4' en la posición 2 y posición 6 son Cl, y el sustituyente […]
Nuevas fenoxiacetamidas anilladas, del 5 de Junio de 2019, de BOEHRINGER INGELHEIM INTERNATIONAL GMBH: Un compuesto de fórmula (I),**Fórmula** en la que R1 y R2 se seleccionan independientemente entre etilo, 2-hidroxietilo, 2-tetrahidrofuranilmetilo y […]
Óxido de arilfósforo y sulfuro de arilfósforo espirocíclicos, del 29 de Mayo de 2019, de Qilu Pharmaceutical Co., Ltd: Un compuesto representado por la fórmula (I) o la fórmula (II) o una sal farmacéuticamente aceptable del mismo,**Fórmula** en las que, T1 se selecciona […]