MicroARN modificados.
MicroARN modificados.
La presente invención se refiere a moléculas de ácido nucleico,
preferiblemente, pre-microARN modificados por su unión a moléculas fluorescentes de tipo FRET, pero que presentan una estructura molecular semejante a la endógena, permitiendo así su metabolización a través de su ruta biológica de actuación dentro de su célula diana. Adicionalmente, la presente invención describe los diferentes usos de los pre-microARN modificados, tanto para terapia como para la investigación de los diferentes patrones de maduración y procesos biológicos en los que los miRNAs están inmersos.
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P201431474.
Solicitante: UNIVERSIDAD DE JAEN.
Nacionalidad solicitante: España.
Inventor/es: FRANCO JAIME,Diego, ARÁNEGA JIMÉNEZ,Amelia Eva, HERNÁNDEZ TORRES,Francisco.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C12Q1/68 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12Q PROCESOS DE MEDIDA, INVESTIGACION O ANALISIS EN LOS QUE INTERVIENEN ENZIMAS, ÁCIDOS NUCLEICOS O MICROORGANISMOS (ensayos inmunológicos G01N 33/53 ); COMPOSICIONES O PAPELES REACTIVOS PARA ESTE FIN; PROCESOS PARA PREPARAR ESTAS COMPOSICIONES; PROCESOS DE CONTROL SENSIBLES A LAS CONDICIONES DEL MEDIO EN LOS PROCESOS MICROBIOLOGICOS O ENZIMOLOGICOS. › C12Q 1/00 Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones. › en los que intervienen ácidos nucleicos.
- G01N21/64 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 21/00 Investigación o análisis de los materiales por la utilización de medios ópticos, es decir, utilizando rayos infrarrojos, visibles o ultravioletas (G01N 3/00 - G01N 19/00 tienen prioridad). › Fluorescencia; Fosforescencia.
- G01N33/52 G01N […] › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › Utilización de compuestos o de composiciones para investigaciones colorimétricas, espectrofotométricas o fluorométricas, p. ej. utilización de cintas de papel indicador.
Fragmento de la descripción:
la presente invención se refiere a pre-microARNs que están marcados con al menos dos moléculas fluorescentes en una posición determinada dentro de la molécula lineal del pre-microARN, donde el espectro de emisión de una de las moléculas fluorescentes, denominada "donadora" es capaz de activar el espectro de absorción de la otra molécula fluorescente, denominada "receptora". Además, la presente invención también se refiere al uso de dichos pre-microARNs como medicamentos y específicamente para el tratamiento de patologías relacionadas con microARNs y a métodos para la detección y trazabilidad o seguimiento de la presencia de miARNs maduros en una muestra de un sujeto al que previamente se le ha administrado un pre-microARN descrito en la presente invención.
ESTADO DE LA TÉCNICA
los micro ARNs (miARNs o miRNAs por sus siglas en inglés) son ARN monocatenarios cortos, con una longitud de entre 21 y 25 nucleótidos, que se 20 transcriben como un RNA primario (pri-miR) de mayor longitud, que luego es procesado para dar lugar a un precursor, pre-miRNA, de aproximadamente 70-90 nucleótidos que, habitualmente, forma una estructura en horquilla debido a apareamientos internos de sus regiones autocomplementarias (pre-microARN) . Una vez producido el pre-microRNA, éste es transportado al citoplasma y procesado por la 25 RNasa 111 Dicer en animales o por la nucleasa DCl1 en plantas, para producir el miRNA maduro y activo. l os microARN activos presentan la capacidad de regular la expresión de otros genes mediante diversos procesos, utilizando para ello la ruta de ribointerferencia. Con una mayor estabilidad y valor predictivo que las moléculas de ARNm, los microARNs se han convertido en una herramienta muy importante en el 30 diagnóstico y el pronóstico de diferentes enfermedades. Este hecho convierte a estas moléculas en potenciales herramientas en el campo de la biomedicina y la terapia génica, ya que podrían modular la expresión de genes rompiendo el bucle de desregulación génica con el que ciertas patologías cursan, mejorando notablemente el cuadro clínico del paciente y su calidad de vida. Sin embargo, la homología de 35 secuencia que presentan los microARNs, junto con una amplia abundancia y unido a sus estructuras secundarias comunes, hace que sean necesarias técnicas muy
precisas para su detección, trazabilidad y cuantificación, para que sean útiles como herramientas terapéuticas y/o diagnósticas.
En este sentido, ya en la actualidad se están utilizando microARNs como terapia para el tratamiento de enfermedades como el Alzheimer, el cáncer o la cardiomiopatía hipertrófica, entre otras. El resultado, aunque está siendo esperanzador, todavía dista mucho del objetivo final, que implicaría la remisión del cuadro patológico. Las vías de administración de dichos microRNAs a los sujetos a tratar son diversas. Entre dichas vías de administración se encuentra la inyección sistémica de dichos microRNAs en el
torrente sanguíneo del sujeto a tratar. Este abordaje genera un importante problema de trazabilidad de los microARNs administrados, ya que no podemos determinar cuántas de las moléculas de microRNAs inyectadas son capaces de llegar a su órgano diana y cuantas, simplemente, quedan en el torrente sanguíneo hasta que son eliminadas sin llegar a su nicho de actuación. Otra de las vías de administración de los microRNAs a un sujeto, para su tratamiento, es la inyección directa de dichos microRNAs en los órganos diana. Sin embargo, y a pesar de su naturaleza invasiva, esta metodología tampoco asegura que los microARNs administrados sean capaces de atravesar la membrana celular y llegar al citoplasma , donde estas moléculas son activadas. Además, incluso en el supuesto de que las moléculas de microARNs sean capaces de llegar al interior celular, tampoco hay modo de averiguar si están siendo procesadas y activadas.
Por lo tanto, existe una necesidad en el estado de la técnica para el desarrollo de moléculas de microARNs que permitan trazar la presencia de las mismas en el interior
de cualquier órgano y/o célula de un organismo al que previamente se le han administrado dichos microARNs con fines terapéuticos y/o de diagnóstico, además de permitir distinguir en qué momento y en qué tipo celular están siendo procesadas de manera activa, dichas moléculas.
DESCRIPCiÓN DE LA INVENCiÓN
Para superar los problemas previamente mencionados, la presente invención describe moléculas precursoras de microARNs, denominadas pre-microARNs modificados respecto a los pre-microARN endógenos o nativos, que permiten trazar su presencia y 35 activación a microARN en el interior de cualquier órgano y/o tejido de un organismo, tanto in vivo como in vitro, en una muestra aislada obtenida de dicho individuo, al que previamente se le ha administrado dichos pre-microARNs con fines terapéuticos y/o de diagnóstico. Además, gracias a los pre-microARN descritos en la presente invención se determina si dicho pre-microARN ha sido procesado y se encuentra activo como microARN en el órgano y/o tejido diana al que iba dirigido.
Los pre-microARN modificados según se describe en la presente invención presentan una serie de ventajas y efectos técnicos respecto a pre-microARN endógenos o incluso frente a pre-microARN o microARN modificados, que permiten además de una fácil administración sistémica de los mismos, la trazabilidad del tránsito sistémico de 10 dichos pre-microARN, tanto con una finalidad terapéutica y/o diagnóstica, como con una finalidad científica que ayudará a conocer y describir patrones de maduración de microARNs, tanto in vivo como in vitro, que servirán para analizar los procesos biológicos en los que están implicadas dichas moléculas. Adicionalmente, el uso de dichos pre-microARNs permite conocer si han alcanzado el órgano diana al que iban dirigidos y sí están en su configuración madura y activa en el interior celular.
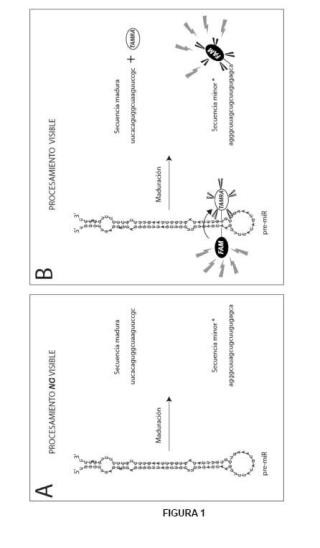
Así, en un primer aspecto, la presente invención se refiere a una molécula de premicroARN, que presenta una estructura molecular semejante a la endógena, y que se caracteriza por que está unida o marcada con al menos dos moléculas fluorescentes, 20 preferentemente fluoróforos, donde una de dichas moléculas fluorescentes, denominada "donadora", está unida al último nucleótido de la secuencia 5p o secuencia minar de dicho pre-miRNA y la otra molécula fluorescente, denominada "receptora" o "aceptora", está unida en el nucleótido complementario al nucleótido marcado de la secuencia 5p, en la secuencia 3p o secuencia madura, y en donde además, el espectro de emisión de la molécula donadora excita al espectro de absorción de la molécula receptora (Figura 1) .
Los pre-microARN diseñados en la presente invención, como hemos mencionado previamente, presentan una estructura semejante a la estructura endógena para 30 permitir así la metabolización de los mismos a través de su ruta biológica de actuación dentro de la célula y posteriormente su detección mediante el análisis de la fluorescencia emitida, haciendo uso de la tecnología FRET (Fluorescent Resonance Energy Transger, en sus siglas en inglés) . Este diseño permite tener un premicroARN, precursor de un microARN que emite fluorescencia al excitarse con una 35 determinada longitud de onda pero que, al ser metabolizado en su configuración molecular activa, podrá ser trazada su localización y estado de activación, mediante la excitación-emisión con otra longitud de onda diferente.
La tecnología FRET implica la participación de dos fluoróforos a los que se les denomina comúnmente como pareja o par de sondas o fluoróforos FRET, donde uno de ellos, denominado "fluoróforo aceptar" es excitado por la longitud de onda que emite el otro "fluoróforo donador" después de que éste último fuese excitado previamente por una radiación electromagnética a una determinada longitud de onda, específicamente a la longitud de onda de su pico de absorbancia. La aceptación de la energía donada por un aceptar FRET requiere el cumplimiento de dos premisas. La compatibilidad entre el aceptor y donador, así como la proximidad física entre ellos. Un aceptor compatible es una molécula cuyo espectro de absorción se solapa con el espectro de emisión de una molécula donadora. Así, si el espectro de absorbancia del aceptar solapa con el espectro de emisión del donador, la energía emitida por el
donador o emisor será capaz de excitar a dicho aceptar, siempre y cuando ambos se encuentren lo suficientemente cerca físicamente. La tecnología FRET ya ha servido para generar las "Molecular Beacons" o las "Sondas Taqman". Estas moléculas son oligonucleótidos modificados a los que se las añaden elementos de naturaleza fluorescente que...
Reivindicaciones:
1. Pre-microARN modificado caracterizado por que está marcado con al menos dos moléculas fluorescentes donde una de dichas moléculas fluorescentes denominada "donador" está unida al último nucleótido de la secuencia 5p del pre miRNA y la otra molécula fluorescente, denominada "receptor" , está unida al nucleótido complementario del nucleótido marcado en la secuencia 5p, en la secuencia 3p, y donde el espectro de emisión de la molécula donadora excita al espectro de absorción de la molécula receptora.
2. Pre-microARN según la reivindicación 1 dónde las moléculas fluorescentes donadoras se seleccionan de la lista que comprende: f1uoresceína (FAM) , ácido íodoacetil-amino-naftaleno-sulfónico (IAEDANS) , ácído aminoetíl-amino-naftaleno
sulfónico (EDANS) , triptófano, dansyl, naftaleno, pireno y ~-ficoeritrina.
3. Pre-microARN según la reivindicación 1 dónde las moléculas fluorescentes receptoras se seleccionan de la lista que comprende: tetrametilrhodamina (TAMRA) , isotiocianato de fluoresceína (FITC) , 5- (lodoacetamido) de f1uoresceína (5-IAF) , fluoresceína (FAM) , 4- (4-dimetilaminofenil) azobenzoico (DABCYL) ,
IAEDANS, dansyl, pireno, coumarina, cianina (Cy5) .
4. Pre-microARN según cualquiera de las reivindicaciones 1 a 3 caracterizado por que las moléculas fluorescentes son preferentemente parejas de moléculas fluorescentes FRET.
5. Pre-microARN según la reivindicación 4 donde las parejas de moléculas fluorescentes FRET se seleccionan de la lista que comprende cualquiera de las enumeradas en la Tabla 1. Parejas de sondas FRET, de la descripción.
6. Pre-microARN según la reivindicación 5 dónde la pareja de moléculas fluorescentes FRET se seleccionan de la lista que comprende: FAM-TAMRA y 13ficoeritrina-fianina (Cy5) .
7. Uso de los pre-microARN según cualquiera de las reivindicaciones 1 a 6 para la 35 elaboración de una composición farmacéutica.
8. Composición que comprende al menos un pre-microARN según cualquiera de las reivindicaciones 1 a 6.
9. Composición según la reivindicación 8 caracterizada por que es una composición 5 farmacéutica o veterinaria.
10. Composición según cualquiera de las reivindicaciones 8 a 9 caracterizada porque además comprende excipientes y/o vehículos farmacéutica y/o veterinariamente aceptables.
11. Composición según cualquiera de las reivindicaciones 8 a 10 caracterizada por que además comprende al menos otro principio activo.
12. Uso de la composición según cualquiera de las reivindicaciones 8 a 11 para la 15 elaboración de un medicamento.
13. Método in vitro para detectar la presencia de un miRNA maduro en una muestra biológica obtenida de un individuo al que previamente se le ha administrado un pre-miRNA según cualquiera de las reivindicaciones 1 a 6 o la composición según cualquiera de las reivindicaciones 8 a 11, que comprende las siguientes etapas: a) excitar la muestra biológica a la longitud de onda de absorción de la molécula fluorescente donadora; b) obtener una imagen a la longitud de onda de emisión de la molécula fluorescente donadora y, opcionalmente, 25 c) obtener una imagen a la longitud de onda de emisión de la molécula fluorescente receptora,
donde, i) la presencia de fluorescencia en la imagen obtenida a la longitud de onda de emisión de la molécula fluorescente donadora es indicativo de que el 30 pre-miRNA ha sido procesado a miRNA en el órgano diana y
ii) la presencia de fluorescencia en la imagen obtenida a la longitud de onda de emisión de la molécula fluorescente receptora es indicativo de que el pre-miRNA no ha sido procesado a miRNA en el órgano diana.
14. Método in vitro según la reivindicación 13 caracterizado por que la muestra biológica se selecciona de entre cualquiera de las siguientes: células y/o tejidos.
15. Método in vitro según cualquiera de las reivindicaciones 13 a 14 caracterizado por que las moléculas fluorescentes donadoras se seleccionan de entre cualquiera de las siguientes: f1uoresceína (FAM) , ácido iodoacetil-amino-naftaleno-sulfónico (IAEDANS) , ácido aminoetil-amino-naftaleno-sulfónico (EDANS) , triptófano, dansyl, naftaleno, pireno y j3-ficoeritrina.
16. Método in vitro según cualquiera de las reivindicaciones 13 a 14 caracterizado por que las moléculas fluorescentes receptoras se seleccionan de entre cualquiera de las siguientes: tetrametilrhodamina (TAMRA) , isotiocianato de f1uoresceína (FITC) , 5- (lodoacetamido) de fluoresceína (5-IAF) , f1uoresceina (FAM) , 4- (4dimetilaminofenil) azobenzoico (DABCYL) , IAEDANS, dansyl, pireno, coumarina, eianina (Cy5) .
17. Método in vitro según cualquiera de las reivindicaciones 13 a 16 caracterizado por que las moléculas fluorescentes son preferentemente parejas de moléculas fluorescentes FRET.
18. Método in vitro según la reivindicación 17 donde las parejas de moléculas fluorescentes FRET se seleccionan de entre cualquiera de las enumeradas en la Tabla 1. Parejas de sondas FRET, de la descripción.
19. Método in vitro según cualquiera de las reivindicaciones 17 a 18 dónde la pareja de moléculas fluorescentes FRET se seleccionan de la lista que comprende FAM25 TAMRA Y ~-fieoeritrina-fianina (Cy5) .
20. Método in vitro según cualquiera de las reivindicaciones 13 a 19 caracterizado por que las imágenes de las etapas b) y, opcionalmente en la etapa c) , se obtienen mediante microscopio de fluorescencia.
Patentes similares o relacionadas:
Método para analizar ácido nucleico molde, método para analizar sustancia objetivo, kit de análisis para ácido nucleico molde o sustancia objetivo y analizador para ácido nucleico molde o sustancia objetivo, del 29 de Julio de 2020, de Kabushiki Kaisha DNAFORM: Un método para analizar un ácido nucleico molde, que comprende las etapas de: fraccionar una muestra que comprende un ácido nucleico molde […]
Nanoparticulas de AG2S súper fluorescentes en la región del infrarrojo cercano y metódo de obtención, del 15 de Julio de 2020, de UNIVERSIDAD COMPLUTENSE DE MADRID: Nanopartículas de Ag2S súper fluorescentes en la región del infrarrojo cercano y método de obtención. El marcaje con sondas fluorescentes […]
DISPOSITIVO DE MONITORIZACIÓN DE SUSTANCIAS TÓXICAS EN AGUA Y SISTEMA QUE LO COMPRENDE, del 7 de Julio de 2020, de UNIVERSITAT ROVIRA I VIRGILI: Dispositivo de monitorización de sustancias tóxicas en agua y sistema que lo comprende. El dispositivo incorpora una cámara de referencia con un filtro depurativo […]
Ensayo de toxina botulínica con sensibilidad mejorada, del 1 de Julio de 2020, de BioMadison, Inc: Un método para aumentar la sensibilidad de la detección basada en células de una toxina botulínica, que comprende: (i) proporcionar una célula […]
Kit, su uso y procedimiento para la calibración de un sistema de medición de fotoluminiscencia, del 24 de Junio de 2020, de BAM BUNDESANSTALT FUR MATERIALFORSCHUNG UND -PRUFUNG: Kit para la calibracion trazable de un sistema de medicion de fotoluminiscencia, que comprende: a) al menos en cada caso uno de los siguientes patrones de fluorescencia (i) […]
Monitor de aerosol en tiempo real, del 17 de Junio de 2020, de Wuxi Maitong Scientific Instrument Co., Ltd: Un monitor de aerosol en tiempo real, que comprende: un conjunto de fuente de luz láser , configurado para emitir un rayo láser y generar […]
Un sistema óptico integrado para el examen de materiales de muestra, del 10 de Junio de 2020, de Iris Technology Solutions SL: Un sistema óptico que comprende: una fuente de luz ; un sistema de suministro de luz que comprende un reflector de una primera abertura […]
Dispositivo de soporte de elementos cromóforos, del 3 de Junio de 2020, de Genewave: Dispositivo de tipo biochip que comprende un sustrato cuya capa superficial forma una guía de onda plana , llevando dicha capa superficial elementos […]