Forma polimórfica del clorhidrato de lercanidipino y el proceso para su preparación.
Clorhidrato de lercanidipino en la forma polimórfica V que tiene al menos una de las siguientes características:
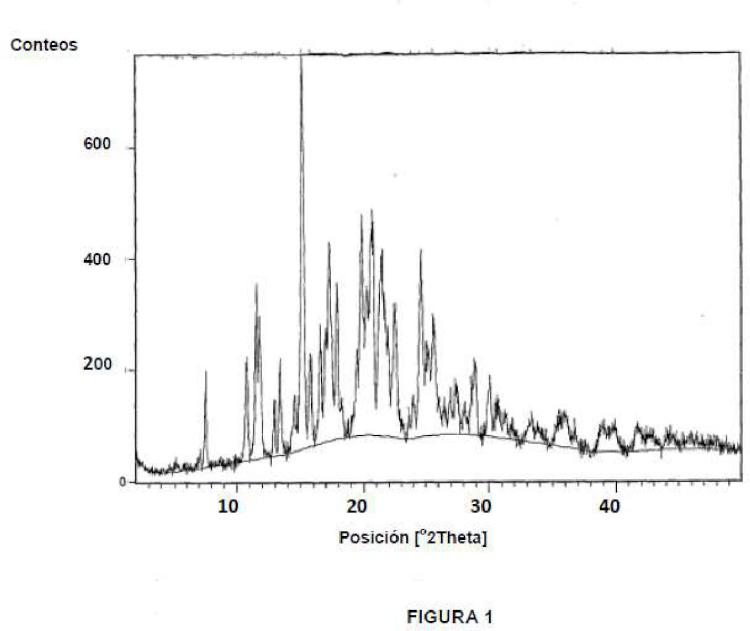
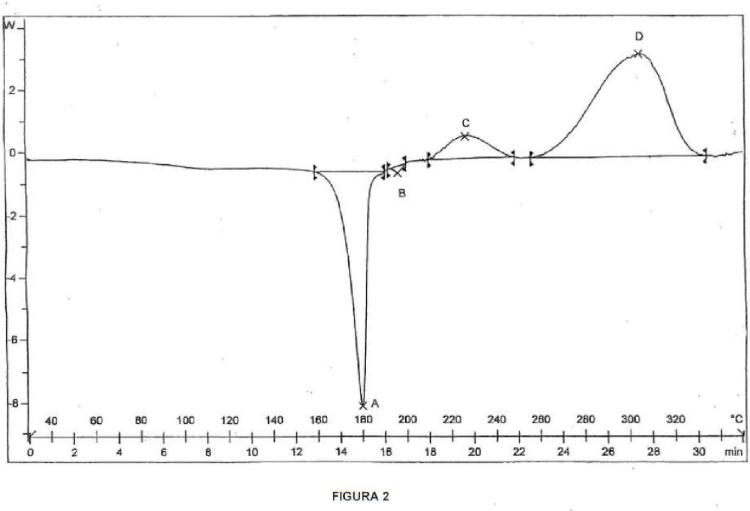
(a) que presenta picos de difracción de rayos X (XRD) característicos (expresados en grados 2θ ± 0,2 °θ) en una o más de las posiciones: aproximadamente 17,2752 y aproximadamente 19,8836, y (b) un termograma calorimétrico diferencial de barrido (DSC) que presenta un pico predominante a aproximadamente 179,5°C.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/IB2006/002579.
Solicitante: GLENMARK PHARMACEUTICALS LIMITED.
Nacionalidad solicitante: India.
Dirección: Glenmark House HDO-Corporate Bldg. Wing A, B.D. Sawant Marg Chakala, Andheri (East) Mumbai 400 099 INDIA.
Inventor/es: SAWANT,MANGESH SHIVRAM, BISWAS,MALOYESH MATHURESH, KHAN,MUBEEN AHMED, SHINHA,SUKUMAR, PRADHAN,NITIN SHARAD CHANDRA.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07D211/90 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 211/00 Compuestos heterocíclicos que contienen ciclos hidrogenados de piridina, no condensados con otros ciclos. › Atomos de carbono que tienen tres enlaces a heteroátomos con a lo sumo un enlace a halógeno.
PDF original: ES-2547478_T3.pdf
Fragmento de la descripción:
Forma polimórfica del clorhidrato de lercanidipino y el proceso para su preparación Antecedentes de la invención
1. Campo técnico
La presente invención se refiere generalmente a un novedoso polimorfo de clorhidrato de lercanidipino y el proceso para su preparación. La presente invención se refiere generalmente además a un proceso para la purificación del clorhidrato de lercanidipino.
2. Descripción de la técnica relacionada
El clorhidrato de lercanidipino, conocido además como clorhidrato del ácido 1,4-dihidro-2,6-dimetíl-4-(3-nitrofenil)-3,5- piridinadicarboxílico 2-[(3,3-difenilpropil)metilamino]-1,1 -dimetiletilmetil éster o, se representa por la estructura de Fórmula I.
**(Ver fórmula)**m
El clorhidrato de lercanidipino es un antihipertensivo sintético bloqueador del canal de calcio vendido bajo los nombres comerciales de Lercadip, Lerdip, Lerzam, Zanedip, y Zanidip® El clorhidrato de lercanidipino es una dihidropiridina bloqueador del canal de calcio usada para el tratamiento de la hipertensión. Se puede reducir la presión sanguínea arterial sistémica con una acción de duración prolongada y se cree que retrasa la progresión de la aterosclerosis. Ver, por ejemplo, The Merck Index, trigésima edición, 2001, p. 973, monografía 5465.
La patente Europea núm. 0153016 ("la 'patente 016") y lapatente de los Estados Unidos núm. 4.968.832 ("la 'patente 832") describen el clorhidrato de lercanidipino. Las patentes '016 y '832 describen además los procesos para la preparación del clorhidrato de lercanidipino y la forma amorfo del clorhidrato de lercanidipino. Inconvenientes asociados con estos procesos incluyen, por ejemplo, la producción de impurezas. Como consecuencia, puede ser ventajoso reducir el nivel de impurezas en la preparación del clorhidrato de lercanidipino.
La patente de los Estados Unidos núm. 5.912.351 describe un proceso más simple para la preparación del clorhidrato de lercanidipino. Este implica la reacción del ácido 1,4-dihidro-2,6-dimetil-5-meoxicarbonil-4-(3-nitrofenil)piridin-3- carboxílico con el cloruro de tionilo en diclorometano y dimetilformamida a una temperatura entre -4 y +1°C y la posterior esterificación del cloruro del ácido obtenido con el alcohol 2, N-dimetil-N-(3,3-difenilpropil)-1 -amino-2-propilo a una temperatura entre -10 y 0°C. El proceso rinde clorhidrato de lercanidipino en una forma cristalina no higroscópica anhidra, y evita la formación de subproductos indeseados y la posterior purificación en columnas de cromatografía.
Una impureza que se cree está presente en la producción de clorhidrato de lercanidipino es el ácido 1,4-dihidro-2,6- dimetilo-4-(3-nitrofenil)piridina-3,5-dicarboxílico 2-[N-(3,3-difenilpropil)-N-metilamino]-1,1 -dimetil etil propill diéster, como se determina a partir de un análisis por HPLC de diferentes lotes de clorhidrato de lercanidipino producido por la reacción del ácido butanoico, clorhidrato del 2-[(3-nitrofenil)metileno]-3-oxo-2-[(3,3-difenilpropil)metilamino]- 1,1 -dimetil etil éster y metil-3 -amino crotonato en la presencia de oftrietil amina y n-propanol empleando el procedimiento que se muestra en el Ejemplo 16 de EP 0153016. La estructura del ácido 1,4-dihidro-2,6-dimetilo-4-(3-nitrofenil)piridina-3,5- dicarboxílico 2-[N-(3,3-difenilpropil)-N-metilamino]-1,1 -dimetil etil propil diéster o se representa por la estructura de la Fórmula II.
**(Ver fórmula)**La impureza se forma debido a la transesterificación del clorhidrato de lercanidipino en la posición 5 con n-propanol en presencia del HCI en n-propanol. Además, esta impureza es muy difícil de eliminar del clorhidrato de lercanidipino crudo.
La patente de los Estados Unidos núm. 6.852.737 ("la 'patente 737") describe las Formas I y II cristalinas y la Formas A y B en bruto del clorhidrato de lercanidipino y los procesos para su preparación. La Forma A crudo del clorhidrato de lercanidipino se describe en el Ejemplo 2 que tiene un pico calorimétrico diferencial de barrido (DSC, por sus siglas en inglés) de 150-152°C. La Forma B crudo del clorhidrato de lercanidipino se describe en el Ejemplo 3 que tiene un pico DSC de 131-135°C. La patente '737 además describe que la patente de los Estados Unidos núm. 5.912.351 ("la 'patente 351") produce una tercera forma en crudo de clorhidrato de lercanidipino, denominada Forma C crudo. La Forma C crudo se informa que tiene un pico DSC de 186-192°C. Además, la patente '737 describe que los estudios termogravimétricas muestran que la Forma A crudo contiene 3-4% de acetato de etilo residual, la Forma B crudo contiene 0,3-0,7% de acetato de etilo residual y la Forma C crudo contiene 0-0,1% de disolventes residuales. Las Formas I y II cristalinas de clorhidrato de lercanidipino están bien caracterizadas por análisis XRD en la patente '737. El Ejemplo 12 de la patente ' 737 describe que la Forma I cristalina tiene una temperatura de fusión (pico T) de 198,7°C y una temperatura de inicio de 179,8°C, y la Forma II cristalina tiene una temperatura de fusión (pico T) de 209,3°C y una temperatura de inicio de 169,0°C.
WO 2006/089787 describe el clorhidrato de lercanidipino amorfo con una pureza de al menos 95% y un método para su preparación. El método incluye disolver el clorhidrato de lercanidipino cristalino en un disolvente orgánico para proporcionar una solución y aislar el clorhidrato de lercanidipino amorfo ya sea mediante (a) la adición de agua a la solución para formar un precipitado y recoger el precipitado o (b) la evaporación del disolvente orgánico. WO 03/014084 describe las Formas I y II cristalinas o el clorhidrato de lercanidipino. WO 96/35668 describe un proceso para la preparación del clorhidrato de lercanidipino en el cual el clorhidrato de lercanidipino se precipita a partir del etanol. EP1 423 367describe solvatos del clorhidrato de lercanidipino y las Formas II y IV cristalinas del clorhidrato de lercanidipino.
El polimorfismo es la aparición de diferentes formas cristalinas de un único compuesto y es una propiedad de algunos compuestos y complejos. Así, los polimorfos son sólidos distintos que comparten la misma fórmula molecular, aunque, cada polimorfo pueden tener propiedades físicas distintas. Por lo tanto, un único compuesto puede dar lugar a una variedad de formas polimórficas donde cada forma tiene propiedades físicas diferentes y distintas, tales como diferentes perfiles de solubilidad, diferentes temperaturas de punto de fusión y/o diferentes picos de difracción de rayos x. Debido a que la solubilidad de cada polimorfo puede variar, identificar la existencia de polimorfos farmacéuticos es esencial para proporcionar productos farmacéuticos con perfiles de solubilidad predecibles. Se desea investigar todas las formas en estado sólido de un fármaco, incluyendo todas las formas polimórficas, y determinar las propiedades de estabilidad, disolución y flujo de cada forma polimórfica. Las formas polimórficas de un compuesto se pueden distinguir en un laboratorio mediante espectroscopia de difracción por rayos X y por otros métodos tales como, espectrometría de infrarrojo. Además, las formas polimórficas de la misma sustancia fármaco o ingrediente farmacéutico activo, se puede administrar por sí mismo o se formula como un producto farmacéutico (conocido también como la forma de dosificación final o terminada), y son bien conocidas en la técnica farmacéutica para afectar, por ejemplo, la solubilidad, estabilidad, fluidez, maleabilidad y compresibilidad de las sustancias fármacos y la seguridad y eficacia de los productos farmacéuticos.
El descubrimiento de nuevas formas polimórficas de un compuesto farmacéuticamente útil proporciona una nueva oportunidad para mejorar las características de desempeño de un producto farmacéutico. Se adiciona además al material que una formulación científica tiene disponibilidad para el diseño, por ejemplo, una forma de dosificación farmacéutica de un fármaco con un perfil de liberación dirigida u otra característica deseada. Una nueva forma polimórfica del clorhidrato de lercanidipino se ha descubierto ahora.
Se hacen esfuerzos además para preparar productos farmacéuticos de un alto grado y con una mínima cantidad de impurezas presentes. El control de impurezas requiere un estudio de varias opciones para decidir sobre las condiciones de reacción y probar los protocolos necesarios para asegurar que los fármacos que se administran al público son prácticamente puros. En consecuencia, permanece la necesidad de un procedimiento mejorado para la preparación del clorhidrato de lercanidipino que elimina o reduce las impurezas de una manera conveniente y rentable para proporcionar formas prácticamente puras de clorhidrato de lercanidipino.
Resumen de la... [Seguir leyendo]
Reivindicaciones:
1. Clorhidrato de lercanidipino en la forma polimórfica V que tiene al menos una de las siguientes características:
(a) que presenta picos de difracción de rayos X (XRD) característicos (expresados en grados 20 ± 0,2 °0) en una o más de las posiciones: aproximadamente 17,2752 y aproximadamente 19,8836, y (b) un termograma calorimétrico diferencial de barrido (DSC) que presenta un pico predominante a aproximadamente 179,5°C.
2. El clorhidrato de lercanidipino en la forma polimórfica V de la reivindicación 1, caracterizado además por picos XRD característicos (expresados en grados 20 ± 0,2 °0) aproximadamente en una o más de las posiciones: aproximadamente 11,5702, aproximadamente 15,1595, aproximadamente 17,2752, aproximadamente 19,8836, aproximadamente 20,7967, aproximadamente 21,4870 y aproximadamente 24,6309.
3. El clorhidrato de lercanidipino en la forma polimórfica V de la reivindicación 1, caracterizado por picos XRD (expresados en grados 20 ± O,2°0) en las posiciones aproximadamente 17,2752 y aproximadamente 19,8836.
4. El clorhidrato de lercanidipino en la forma polimórfica V de la reivindicación 1,caracterizado por picos XRD en posiciones aproximadamente 11,5702, aproximadamente 15,1595, aproximadamente 17,2752, aproximadamente 19,8836, aproximadamente 20,7967, aproximadamente 21,4870 y aproximadamente 24,6309.
5. El clorhidrato de lercanidipino en la forma polimórfica V de la reivindicación 1, que tiene un patrón XRD de acuerdo con la Figura 1.
6. El clorhidrato de lercanidipino en la forma polimórfica V de cualquiera de las reivindicaciones 1-5, que tiene un termograma DSC de acuerdo con la Figura 2.
7. El clorhidrato de lercanidipino en la forma polimórfica V de cualquiera de las reivindicaciones 1-6, que tiene una pureza igual o mayor que aproximadamente 98,5%, medida por cromatografía líquida de alta eficacia.
8. Una composición farmacéutica que comprende una cantidad terapéuticamente eficaz de clorhidrato de lercanidipino en la forma polimórfica V de cualquiera de las reivindicaciones 1-7.
9. La composición farmacéutica de la reivindicación 8, en donde el clorhidrato de lercanidipino en la forma polimórfica V es un clorhidrato de lercanidipino micronizado en la forma polimórfica V que tiene un tamaño de partícula de menos de aproximadamente 150 mieras.
10. Un proceso para la preparación de clorhidrato de lercanidipino en la forma polimórfica V de la reivindicación 1, el proceso que comprende: (a) disolver clorhidrato de lercanidipino en metanol; (b) calentar la solución de 50°C a 55°C; (c) enfriar la solución a temperatura ambiente, (d) añadir acetato de ¡sopropilo mientras se mantiene la solución a temperatura ambiente con agitación; (e) filtrar el precipitado, y (f) lavar y secar el precipitado de clorhidrato de lercanidipino en la forma polimórfica V.
11. El proceso de acuerdo con la reivindicación 10 en donde en la etapa (f) el precipitado se lava con un disolvente que contiene éster.
12. Un proceso para la preparación de clorhidrato de lercanidipino puro en la forma polimórfica V de la reivindicación 1, el proceso que comprende:
(a) reaccionar una solución que comprende ácido butanoico, clorhidrato de 2-[(3-nitrofenil) metilen]-3-oxo-2- {(3,3-difenil propil) metilamino] -1,1 -dimetil etil éster y dicloruro de metileno, con crotonato de metilo 3-amino y n-propanol y ajustar el pH de la solución a aproximadamente 8 a aproximadamente 9 con una base;
(b) destilar n-propanol para obtener un residuo ;
(c) disolver el residuo en acetato de ¡sopropilo;
(d) tratar la solución que contiene acetato de ¡sopropilo con un agente clarificante para formar una solución clarificada;
(e) concentrar la solución clarificada para formar una solución clarificada concentrada;
(f) disolver la solución clarificada concentrada en metanol y acetato de ¡sopropilo;
(g) sembrar la solución con un clorhidrato de lercanidipino en la forma polimórfica V, y
(h) recuperar el clorhidrato de lercanidipino en la forma polimórfica V
13. El proceso de la reivindicación 12, que comprende además:
enfriar la masa de reacción a una temperatura de aproximadamente 50°C a aproximadamente 55°C; destilar n-propanol para obtener un primer residuo;
disolver el primer residuo en n-propanol,
ajustar el pH de la masa de reacción usando n-propanol/HCI y destilar n-propanol para obtener un segundo residuo;
disolver el segundo residuo en acetato de isopropllo y lavar con agua para obtener una solución;
pirolizar la solución y destilar el acetato de isopropilo para obtener un tercer residuo; disolviendo el tercer
residuo en metanol y acetato de isopropilo
sembrar la solución con la forma polimórflca V de clorhidrato de lercanldipino y filtrar los sólidos; y secar los sólidos para obtener clorhidrato de lercanidipino prácticamente en la forma polimórflca V.
14. El proceso de acuerdo con la reivindicación 12, en donde en la etapa (h) el clorhidrato de lercanidipino recuperado se lava con un disolvente que contiene áster.
15. Un proceso de acuerdo con la reivindicación 11 o la reivindicación 14 donde el disolvente que contiene áster es acetato de isopropilo.
Patentes similares o relacionadas:
DERIVADOS DE 4-FENILDIHIDROPIRIDINA PARA EL TRATAMIENTO Y/O PREVENCIÓN DE UNA INFECCIÓN O ENFERMEDAD CAUSADA POR HELICOBACTER, del 23 de Abril de 2020, de FUNDACION INSTITUTO DE INVESTIGACION SANITARIA ARAGON: Derivados de 4-fenildihidropiridina de fórmula I y composiciones farmacéuticas de los mismos, donde el significado para R1, R2, […]
Derivados de 4-fenildihidropiridina para el tratamiento y/o prevención de una infección o enfermedad causada por Helicobacter, del 20 de Abril de 2020, de FUNDACION INSTITUTO DE INVESTIGACION SANITARIA ARAGON: Derivados de 4-fenildihidropiridina para el tratamiento y/o prevención de una infección o enfermedad causada por Helicobacter. Derivados de 4-fenildihidropiridina de fórmula […]
Clorhidrato de lercanidipino amorfo, del 13 de Noviembre de 2019, de RECORDATI IRELAND LIMITED: Hidrocloruro de lercanidipino amorfo que presenta una pureza de por lo menos el 95%.
Aril dihidropiridinonas y piperidinonas como inhibidores de MGAT2, del 13 de Febrero de 2019, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de Formula (I):**Fórmula** o un estereoisomero, un tautomero o una sal farmaceuticamente aceptable, en la que: indica un enlace simple […]
Arilhidrazidas que contienen una fracción de 2-piridona como agentes antibacterianos selectivos, del 29 de Octubre de 2018, de ABAC THERAPEUTICS, S.L: Un compuesto de la fórmula (I): **Fórmula** una sal, solvato, isótopo, polimórfo o tautómero farmacéuticamente aceptable del mismo, en donde A es […]
Aril dihidropiridinonas y piperidinonas como inhibidores de MGAT2, del 18 de Mayo de 2016, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de Formula (I):**Fórmula** o un estereoisomero, un tautomero, una sal farmaceuticamente aceptable o un solvato del mismo, en la que: […]
Preparación de dihidropiridinas, del 10 de Febrero de 2016, de LABORATORIOS LESVI, S.L.: Un proceso para la preparación de butirato de clevidipina que comprende la etapa: (i) hacer reaccionar un compuesto de fórmula (I): **Fórmula** […]
 Agente reductor de triglicéridos y agente de mejora del hiperinsulinismo, del 8 de Febrero de 2016, de KOWA COMPANY LTD.: Uso de un compuesto de pitavastatina y amlodipino o una sal del mismo para
- producir un agente reductor de triglicéridos o
- para producir un agente preventivo y/o terapéutico […]
Agente reductor de triglicéridos y agente de mejora del hiperinsulinismo, del 8 de Febrero de 2016, de KOWA COMPANY LTD.: Uso de un compuesto de pitavastatina y amlodipino o una sal del mismo para
- producir un agente reductor de triglicéridos o
- para producir un agente preventivo y/o terapéutico […]