Espectrometría de masas de conjugados de anticuerpos.
Un método para detectar compuestos conjugados de anticuerpo-fármaco que comprende:
(i) procesar mediante selección con membrana de inmunoafinidad una muestra biológica que se ha recogido de una fuente biológica en contacto previamente con un compuesto conjugado de anticuerpo-fármaco que tiene la Fórmula I:
Ab-(L-D)p I
en la que
Ab es un anticuerpo que se une a uno o más antígenos asociados a tumores o receptores de superficie celular;
D es un resto de fármaco seleccionado de un maitansinoide o de auristatina;
L es un enlazador unido covalentemente a Ab y unido covalentemente a D, en donde L se forma a partir de un reactivo enlazador seleccionado de 4-(2-piridiltio) propanoato de N-succinimidilo (SPDP), succinimidil-4- (N-maleimidometil)ciclohexano-1-carboxilato (SMCC) y N-succinimidil-4-(2-piridiltio)pentanoato (SPP), o L se selecciona de maleimidocaproilo (MC), maleimidopropanoilo (MP) y maleimidocaproil-valina-citrulina-paraaminobenciloxicarbonilo
(MC-vc-PAB); y
p es 1, 2, 3, 4, 5, 6, 7 u 8;
en el que una muestra de análisis se forma poniendo en contacto la muestra biológica con una membrana de inmunoafinidad que comprende un antígeno inmovilizado y la elución de la muestra de análisis;
(ii) aplicar la muestra de análisis a un medio de separación para efectuar la separación de más de una muestra constituyente en donde un constituyente de la muestra separada comprende un fragmento de anticuerpo de un compuesto conjugado de anticuerpo-fármaco que tiene la Fórmula I, o un fragmento de anticuerpo o metabolito del mismo, y en la que p es 0, 1, 2, 3 , 4, 5, 6, 7 u 8; y
(iii) establecer la masa o la relación entre la masa y la carga y cuantificar uno o más constituyentes de la muestra separados que es un fragmento de anticuerpo o un compuesto conjugado de anticuerpo-fármaco que tiene la Fórmula I o un metabolito del mismo, en donde p es 0, 1, 2, 3, 4, 5, 6, 7 u 8, mediante espectrometría de masas con monitorización de ion único (SIM).
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2005/011675.
Solicitante: GENENTECH, INC..
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 1 DNA WAY SOUTH SAN FRANCISCO, CA 94080-4990 ESTADOS UNIDOS DE AMERICA.
Inventor/es: KADKHODAYAN,MIRYAM, MANN,EMILY.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- G01N33/68 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › en los que intervienen proteínas, péptidos o aminoácidos.
PDF original: ES-2549077_T3.pdf



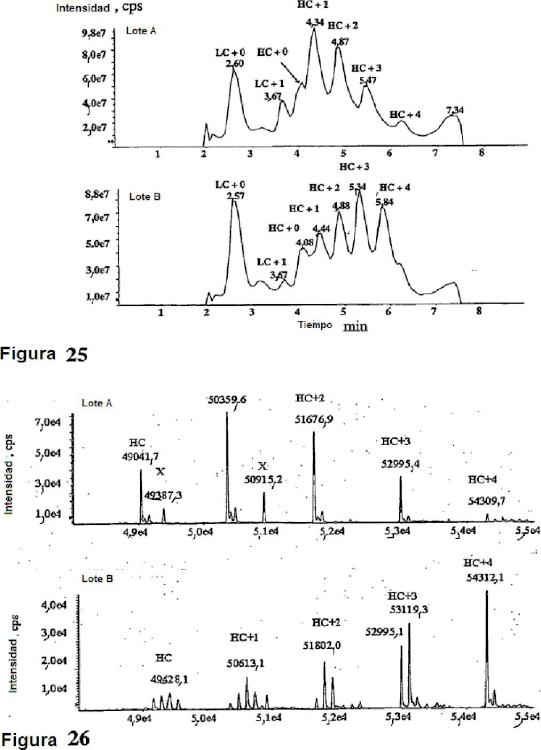
Fragmento de la descripción:
Espectrometría de masas de conjugados de anticuerpos Campo de la invención
La invención se refiere en general a métodos para detectar, analizar, seleccionar, caracterizar y cuantificar compuestos conjugados de anticuerpos, incluyendo conjugados de anticuerpo-fármaco, y sus fragmentos y metabolitos, mediante espectrometría de masas. La invención también se refiere a métodos para preparar muestras para espectrometría de masas para estudios farmacocinéticos.
Antecedentes de la invención
Las terapéuticas anticancerosas dirigidas están diseñadas para reducir las toxicidades inespecíficas e incrementar la eficacia con respecto a la quimioterapia convencional para el cáncer. Este abordaje está ilustrado por la potente capacidad para dirigir anticuerpos monoclonales para liberar específicamente terapéuticas de molécula pequeña conjugadas y altamente potentes frente a una célula cancerosa. La farmacocinética y la biodistribución de un anticuerpo desempeñan un papel importante en la determinación de si su uso en la clínica tendrá éxito. Por tanto, el anticuerpo debe ser capaz de ser liberado en el sitio de acción y ser retenido allí durante el tiempo necesario para alcanzar su propósito. Para evaluar las propiedades tales como la farmacocinética y la toxicidad de estos conjugados anticuerpo-fármaco, es útil ser capaz de caracterizar y cuantificarlos a partir de plasma, orina y otras muestras biológicas. Además, la capacidad para cuantificar el fármaco libre (no conjugado con el anticuerpo) en el método de la misma muestra y la misma inyección cromatográfica también sería útil.
Se han usado diversas técnicas de espectrometría de masas para la identificación y cuantificación de terapéuticas de moléculas pequeñas en los estudios farmacocinéticos, tales como: impacto de electrones (IE), ionización química (IQ), Ionización química por desorción (IQD), bombardeo rápido con átomos (BRA), ionización por electropulverlzaclón (ESI), ¡onlzaclón/desorción por láser asistida por matriz (MALDI) y espectrometría de masas en tándem (EM/EM) (Yao et al (2001) Jour, de Chrom B 752:9 - -16; Royer et al (1995) Rapid Comm. in Mass Spec. 9:495 - 502), Incluyendo el modo de monltorización on ion único (SIM) de selección de iones para desconvolución (Souppart et al (2002) Jour. of Chrom. B 774:195 - -203; Wong et al (2001) Jour. of Chrom. 765:55-62; Yao et al (1998) Jour. of Chrom. B 718:77-85; Abdel-Hamid et al (2001) Jour. of Chrom. B 753:401-408; Marques et al (2001) Jour. of Chrom. 762:87-95). Estos métodos e instrumentación requieren la separación de los diversos analitos a partir de fluidos biológicos para la sensibilidad suficiente. Tal purificación puede ser muy laboriosa, lenta, y requerir grandes volúmenes de fluidos de muestra debido a la baja concentración de los analitos de interés en muestras, tales como medio de cultivo celular, plasma humano, orina y bilis.
La combinación directa de una etapa frontal de separación/aislamiento/purificación acoplada a detección/caracterización/cuantificación mediante espectrometría de masas es eficaz para los estudios metabólicos de muestras biológicas complejas. Normalmente, la CL/EM se utiliza para la caracterización de los anticuerpos (Martin et al (1997) Cáncer Chemother. Pharmacol. 40:189 - -201; documentos WO 03/046571; WO 03/046572), y se utiliza ELISA para la cuantificación en matrices biológicas (Murray et al (2001) J. Imm. Methods 255:41 - -56; Kirchner et al (2004) Clin. Pharmacokinetics 43(2):83-95). Normalmente los ensayos de ELISA son sensibles y susceptibles a tamizados de alto rendimiento.
Los recientes avanzas en el análisis de proteínas mediante espectrometría de masas (EM) se deben a las técnicas frontales de introducción e ionización en fase de gas tal como ionización por elecetropulverización (ESI), ionización por desorción láser asistida por matriz (MALDI, documento US 2003/0027216) e ionización de desorción láser con potenciación de superficie (SELDI, documento US 6020208), así como mejoras en la sensibilidad del instrumento, resolución, exactitud de la masa, bioinformática y algoritmos de desconvolución de datos en software ("Electrospray lonization Mass Spectrometry: Fundamentáis, Instrumentation, and Applications", Colé, R. B., Ed. (1997) Wiley, New York; "Modern Protein Chemistry: Practical Aspects", Howard, G. C. y Brown, W. E., Eds. (2002) CRC Press, Boca Ratón, FL, p. 71 - -102;). La estructura primaria (secuencia), secundaria y terciaria de las proteínas se puede sondar y deducir con EM. La ionización por electropulverización (ESI) proporciona la ionización a presión atmosférica (IPA) de una muestra de líquido. El proceso de electropulverización crea gotitas altamente cargadas que, en virtud de la evaporación, crean iones representativos de las especies contenidas en la solución. Un orificio de muestreo de iones de un espectrómetro de masas puede utilizarse para obtener muestras de estos iones en fase gaseosa para el análisis de masas. La respuesta para un analito medida mediante el detector de espectrómetro de masas depende de la concentración del analito en el fluido y es independiente del caudal del fluido.
La terapia de anticuerpos se ha establecido para el tratamiento dirigido y el diagnóstico de pacientes con cáncer, trastornos inmunológicos y trastornos angiogénicos. Un ejemplo, HERCEPTIN® (trastuzumab; Genentech, Inc.; South San Francisco, CA) es un anticuerpo monoclonal humanizado derivado de ADN recombinante que se une selectivamente al dominio extracelular (DEC) de la proteína del receptor 2 del factor de crecimiento epidérmico humano HER2 (ErbB2) (documento US 5821337; documento US 6054297; documento US 6407213; documento US 6639055; Coussens et al (1985) Science 230:1132 - -9; Slamon, et al (1989) Science 244:707 - -12). Trastuzumab
es un anticuerpo lgG1 kappa que contiene regiones marco humanas con las regiones determinantes de complementariedad (CDR) de un anticuerpo murino (4D5) que se une a HER2. Trastuzumab se une al antígeno HER2 y, por lo tanto, inhibe la proliferación de células tumorales humanas que sobreexpresan HER2 (Hudzlak RM, et al Cell Blol (1989) Mol 9: 1165-72; Lewis GD, et al (1993) Cáncer Immunol Immunother; 37: 255-63; Baselga J, et al (1998) Cáncer Res. 58:2825-2831). HERCEPTIN® como agente único está indicado para el tratamiento de pacientes con cáncer de mama metastásico cuyos tumores sobreexpresan la proteína HER2 y que han recibido uno o más regímenes de quimioterapia para su enfermedad metastásica. HERCEPTIN® en combinación con paclitaxel está indicado para el tratamiento de pacientes con cáncer de mama metastásico cuyos tumores sobreexpresan la proteína HER2 y que no han recibido quimioterapia para su enfermedad metastásica. HERCEPTIN® es clínicamente activa en pacientes con cánceres de mama metastásicos que sobreexpresan ErbB2 que han recibido extenso tratamiento antineoplásico previo (Baselga et al (1996) J. Clin. Oncol. 14:737-744).
El objetivo de la terapia y el diagnóstico con anticuerpos es explotar la combinación de alta especificidad y afinidad de la Interacción anticuerpo-antígeno, para permitir la detección y/o tratamiento de una lesión o trastorno particular. El anticuerpo se usa solo, o se conjuga, es decir, cargado, con otro resto tal como un marcador detección, modificador farmacocinético, radioisótopo, toxina, o fármaco. El uso de conjugados anticuerpo-fármaco (ADC), es decir, inmunoconjugados, para la administración local de agentes citotóxicos o citostáticos para matar o inhibir células tumorales en el tratamiento del cáncer (Syrigos y Epenetos (1999) Anticancer Research 19:605-614; Niculescu-Duvaz and Springer (1997) Adv. Drug Del. Rev. 26:151-172; US 4975278) permite, teóricamente, la administración dirigida del resto de fármaco a los tumores, y la acumulación ¡ntracelular en los mismos, en los que la administración sistémica de estos agentes farmacológicos no conjugados puede dar lugar a niveles inaceptables de toxicidad para las células normales, así como para las células tumorales que se desea eliminar (Baldwin et al (1986) Lancet pp. (Mar. 15, 1986):603-05; Thorpe, (1985) "Antibody Carriers Of Cytotoxic Agents In Cáncer Therapy: A Review," in Monoclonal Antibodies 84: Biological And Clinical Applications, A. Pinchera et al (eds), pp. 475-506). De este modo se busca una eficacia máxima con una toxicidad mínima. Los esfuerzos para diseñar y perfeccionar los ADC se han centrado en la selectividad de los anticuerpos monoclonales (MAb), así como en las propiedades de unión a fármacos o de liberación de fármacos. Se ha notificado que tanto los anticuerpos policlonales como los anticuerpos monoclonales unidos a fármacos, incluidos daunomicina, doxorubicina, metotrexato,... [Seguir leyendo]
Reivindicaciones:
1. Un método para detectar compuestos conjugados de anticuerpo-fármaco que comprende:
(i) procesar mediante selección con membrana de ¡nmunoafinidad una muestra biológica que se ha recogido de una fuente biológica en contacto previamente con un compuesto conjugado de anticuerpo-fármaco que tiene la Fórmula I:
Ab-(L-D)P I
en la que
Ab es un anticuerpo que se une a uno o más antígenos asociados a tumores o receptores de superficie celular;
D es un resto de fármaco seleccionado de un maltanslnolde o de auristatina;
L es un enlazador unido covalentemente a Ab y unido covalentemente a D, en donde L se forma a partir de un reactivo enlazador seleccionado de 4-(2-pir¡diltio) propanoato de N-succinimidilo (SPDP), succinimidil-4- (N-male¡m¡domet¡l)c¡clohexano-1-carbox¡lato (SMCC) y N-succinimidil-4-(2-piridiltiojpentanoato (SPP), o L se selecciona de malelmldocaprollo (MC), maleimidopropanollo (MP) y maleimidocaproil-valina-citrulina-para- amlnobenclloxlcarbonllo (MC-vc-PAB); y p es 1, 2, 3, 4, 5, 6, 7 u 8;
en el que una muestra de análisis se forma poniendo en contacto la muestra biológica con una membrana de ¡nmunoafinidad que comprende un antígeno inmovilizado y la elución de la muestra de análisis;
(ii) aplicar la muestra de análisis a un medio de separación para efectuar la separación de más de una muestra constituyente en donde un constituyente de la muestra separada comprende un fragmento de anticuerpo de un compuesto conjugado de anticuerpo-fármaco que tiene la Fórmula I, o un fragmento de anticuerpo o metabolito del mismo, y en la que p es 0, 1, 2, 3,4, 5, 6, 7 u 8; y
(iii) establecer la masa o la relación entre la masa y la carga y cuantificar uno o más constituyentes de la muestra separados que es un fragmento de anticuerpo o un compuesto conjugado de anticuerpo-fármaco que tiene la Fórmula I o un metabolito del mismo, en donde p es 0, 1,2, 3, 4, 5, 6, 7 u 8, mediante espectrometría de masas con monitorización de ion único (SIM).
2. El método de la reivindicación 1 que comprende además repetir las etapas (i) y (¡i) una o más veces.
3. El método de la reivindicación 1, en el que la fuente biológica se selecciona de un mamífero, tejido y un cultivo celular.
4. El método de la reivindicación 1, en el que la muestra biológica es sangre, bilis, orina o heces.
5. El método de la reivindicación 4, en el que la muestra biológica es sangre y la sangre se procesa para formar plasma o suero.
6. El método de la reivindicación 3 en el que el mamífero se selecciona de un ratón, una rata, un perro, un mono y un ser humano.
7. El método de la reivindicación 1, en el que la muestra biológica se procesa adicionalmente mediante formulación, inmovilización, centrifugación, aislamiento, digestión, inducción o prevención de la coagulación de las células sanguíneas, hidrólisis o purificación de la muestra de análisis
8. El método de la reivindicación 1, en el que la muestra de análisis es un lisado celular, un lisado tisular o un lisado de órganos.
9. El método de la reivindicación 1, en el que la muestra de análisis se desnaturaliza.
10. El método de la reivindicación 9, en el que la muestra de análisis se desnaturaliza mediante un reactivo desnaturalizante seleccionado de formamida, dimetilformamida y acetonitrilo.
11. El método de la reivindicación 1, en el que la muestra de análisis se trata con un agente reductor.
12. El método de la reivindicación 11, en el que el agente reductores DTT o TCEP.
13. El método de la reivindicación 1, en el que la membrana de ¡nmunoafinidad se selecciona de:
(i) poliestireno, vidrio de poro controlado, vidrio, gel de sílice, sílice, poliacrilamida, poliacrilato, hidroxietiImetacriIato, poliamida, polietileno, polietilenoxi, agarosa, dextrina, celulosa, así como sus copolímeros, sus mezclas y sus productos injertados.
14. El método de la reivindicación 1, en el que la membrana de inmunoafinidad comprende grupos funcionales azolactam o un monolito de polímero poroso.
15. El método de la reivindicación 1, en el que la membrana de Inmunoafinidad comprende al menos un canal de flujo continuo en comunicación fluida con un depósito de recogida.
16. El método de la reivindicación 15, en el que la membrana de Inmunoafinidad está configurada en un recipiente de flujo continuo, en donde la muestra de la fuente biológica se Introduce en un extremo u orificio, y una muestra se eluye en el otro extremo u orificio.
17. El método de la reivindicación 16, en el que la membrana de Inmunoafinidad está distribuida en una pluralidad de recipientes de flujo continuo, cada uno en comunicación con un depósito de recogida separada.
18. El método de la reivindicación 17, en el que los vasos y depósitos están configurados en un formato de 96 pocilios de mlcrotltulaclón de 12 x 8 columnas y filas, o un formato de 384 pocilios de microtltulación de 24 x 16 columnas y filas.
19. El método de la reivindicación 1 que comprende además la etapa de tratar la muestra de análisis con un reactivo de desgllcosilación.
20. El método de la reivindicación 19, en el que el reactivo de desglicosilación es PNGasaF.
21. El método de la reivindicación 1, en el que la muestra de análisis se aplica de forma intermitente a los medios de separación o se aplica de forma continua a los medios de separación.
22. El método de la reivindicación 1, en el que el medio de separación es un soporte de cromatografía.
23. El método de la reivindicación 22, en el que el soporte de cromatografía es un adsorbente de fase inversa.
24. El método de la reivindicación 23 en el que la fase inversa es poliestireno, o un injerto o un copolímero de poliestireno.
25. El método de la reivindicación 22 en el que un efluente del soporte de cromatografía se analiza de forma intermitente por espectrometría de masas para establecer la relación masa a carga de más de uno de los constituyentes aclarados separados.
26. El método de la reivindicación 1, en el que un constituyente de la muestra comprende un fragmento de anticuerpo de cadena ligera o de cadena pesada.
27. El método de la reivindicación 26, en el que el fragmento de anticuerpo de cadena ligera o de cadena pesada comprende además uno o más restos de fármaco.
28. El método de la reivindicación 1, en el que Ab es un fragmento de anticuerpo.
29. El método de la reivindicación 28 en el que el fragmento de anticuerpo se selecciona de un fragmento Fab, Fab', F(ab')2, Fv, diacuerpo, anticuerpo lineal y molécula de anticuerpo de una sola cadena.
30. El método de la reivindicación 1, en el que Ab se selecciona del grupo que consiste en anticuerpos humanizados huMAb4D5-1, huMAb4D5-2, huMAb4D5-3, huMAb4D5-4, huMAb4D5-5, huMAb4D5-6, huMAb4D5-7 y huMAb4D5-8.
31. El método de la reivindicación 30, en del que Ab es anticuerpo humanizado huMAb4D5-8.
32. El método de la reivindicación 1, en el que Ab es un anticuerpo anti-ErbB2.
33. El método de la reivindicación 32, en el que Ab es un anticuerpo anti-ErbB2 que se une al epítopo 4D5.
34. El método de la reivindicación 1, en el que el anticuerpo del compuesto conjugado anticuerpo-fármaco que tiene la Fórmula I, o UN fragmento de anticuerpo o metabolito del mismo, se une a un antígeno asociado a tumor o un receptor de la superficie celular en la fuente biológica.
35. El método de la reivindicación 1 en el que anticuerpo del compuesto conjugado de anticuerpo-fármaco se une a uno o más antígenos asociados a tumores o receptores de la superficie celular seleccionados de (1 )-(35):
(1) BMPR1B (receptor de la proteína morfogenética ósea de tipo IB, N° de registro en Genbank NM_001203);
(2) E16 (LAT1, SLC7A5, n° de registro en Genbank NM_003486);
(3) STEAP1 (seis antígenos epiteliales transmembrana del la próstata, n° de registro en Genbank NM_012449);
(4) 0772P (CA125, MUC16, n° de registro en Genbank AF361486);
(5) MPF (MPF, MSLN, SMR, factor potenciador de megacariocitos, mesotelina, n° de registro en Genbank NM_005823);
(6) Napi3b (NAPI-3B, NPTIIb, SLC34A2, familia 34 de transportadores de soluto (fosfato sódico), transportador 3b de fosfato dependiente de sodio de tipo II, miembro 2, n° de registro en Genbank NM_006424);
(7) Sema 5b (FLJ10372, KIAA1445, Mm.42015, SEMA5B, SEMAG, Semaforina 5b Hlog, dominio sema, siete repeticiones de trombospondina (tipo 1 y similar al tipo 1), dominio transmembrana (TM) y dominio citoplásmico corto, (semaforina) 5B), n° de registro en Genbank AB040878);
(8) PSCA hlg (2700050C12Rik, C530008016Rik, RIKEN ADNc 2700050C12, RIKEN ADNc 2700050C12 gen, n° de registro en Genbank AY358628);
(9) ETBR (receptor de tipo B de la endotelina; n° de registro en Genbank A275463);
(10) MSG783 (RNF124, proteína hipotética FLJ20315); n° de registro en Genbank NM_017763);
(11) STEAP2 (HGNC_8639, IPCA-1, PCANAP1, STAMP1, STEAP2, STMP, gen 1 asociado al cáncer de próstata, proteína 1 asociada al cáncer de próstata, seis antígenos epiteliales transmembrana de la próstata 2, seis proteínas prostéticas transmembrana, n° de registro en Genbank AF455138);
(12) TrpM4 (BR22450, FLJ20041, TRPM4, TRPM4B, potencial canal catiónico del receptor transitorio, subfamilia M, miembro 4, n° de registro en Genbank NM_017636);
(13) CRIPTO (CR, CR1, CRGF, CRIPTO, TDGF1, factor de crecimiento derivado de teratocarcinoma, n° de registro en Genbank NP_003203 o NM_003212);
(14) CD21 (CR2 (receptor 2 del complemento) o C3DR (receptor C3d/del virus de Epstein Barr) o Hs 73792) n° de Registro en Genbank M26004);
(15) CD79b (CD79B, CD79(3, IGb (beta asociado a ¡nmunoglobulina), B29, n° de registro en Genbank NM_000626);
(16) FcRFI2 (IFGP4, IRTA4, SPAP1A (proteína 1a de anclaje de fosfatasa que contiene el dominio SH2), SPAP1B, SPAP1C, n° de registro en Genbank NM_030764);
(17) FIER2 (n° de registro en Genbank M11730);
(18) NCA (n° de registro en Genbank M18728);
(19) MDP (n° de registro en Genbank BC017023);
(20) IL20Ra (n° de registro en Genbank. AF184971);
(21) Brevican (n° de registro en Genbank AF229053);
(22) Ephb2R (n° de registro en Genbank NM_004442);
(23) ASLG659 (n° de registro en Genbank AX092328);
(24) PSCA (n° de registro en Genbank AJ207436);
(25) GEDA (n° de registro en Genbank AY260763;
(26) BAFF-R (receptor del factor de activación de células B, receptor BLyS 3, BR3, NP_443177.1); y
(27) CD22 (receptor de células B, isoforma CD22-B, NP-001762.1);
(28) CD79a (CD79A, CD79a, alfa asociada con ¡nmunoglobulina, una proteína específica de células B que interacciona covalentemente con Ig beta (CD79B) y forma un complejo sobre la superficie con moléculas de Ig M, transduce una señal implicada en la diferenciación de las células B, n° de registro en Genbank NP_001774.1);
(29) CXCR5 (receptor 1 del linfoma de Burkitt, un receptor acoplado a proteína G que está activado por la quimioquina CXCL13, funciona en la migración de linfocitos y la defensa humoral, desempeña un papel en la infección por VIH-2 y, quizá, el desarrollo de SIDA, linfoma, mieloma y leucemia, n° de registro en Genbank NP_001707.1);
(30) HLA-DOB (subunidad Beta de la molécula de clase II del MHC (antígeno la) que se une a los péptidos y los presenta a los linfocitos T CD4+, n° de registro en Genbank NP_002111.1);
(31) P2X5 (canal iónico 5 dependiente de ligando P2X del receptor purinérgico, un cana iónico dependiente de ATP extracelular, puede estar implicado en la transmisión sináptica y la neurogénesis, la deficiencia puede contribuir a la fisiopatología de la inestabilidad idiopática del detrusor, n° de registro en Genbank NP_002552.2);
(32) CD72 (antígeno CD72 de diferenciación de las células B, Lyb-2, n° de registro en Genbank NP_001773.1);
(33) LY64 (antígeno 64 de linfocitos (RP105), proteína de membrane de tipo I de la familia de repeticiones ricas en leucina (LRR), regula la activación y la apoptosis de células B, la pérdida de función está asociada a un incremento de la actividad de la enfermedad en pacientes con lupus eritematoso sistémico, n° de registro en Genbank NP_005573.1);
(34) FCRH1 (proteína 1 similar al receptor de Fe, un receptor putativo para el dominio Fe de ¡nmunoglobulina que contiene los dominios ITAM y similar a Ig de tipo C2, pueden tener un papel en la diferenciación de linfocitos B, n° de registro en Genbank NP_443170.1); y
(35) IRTA2 (receptor 2 de la superfamilia de inmunoglobulinas asociado con la translocación, un inmunorreceptor putativo con posibles papeles en el desarrollo de las células B y la linfomagénesis; en algunas neoplasias de células B se produce alteración de la regulación del gen mediante translocación, n° de registro en Genbank NP_112571.1).
36. El método de la reivindicación 1 en el que el compuesto conjugado anticuerpo-fármaco había sido administrado a un mamífero en una dosis de 0,1 a 10 mg/kg de peso corporal.
37. El método de la reivindicación 1, en el que L está unido covalentemente a un grupo amino, carboxilo o tiol de Ab.
38. El método de la reivindicación 1 en la que D es un maitansinoide, que tiene la estructura:
**(Ver fórmula)**5 en la que la línea ondulada indica la unión covalente del átomo de azufre de D al enlazador (L) del conjugado anticuerpo-fármaco, R se selecciona independientemente de H y alquilo C1-C6.
39. El método de la reivindicación 38, en el que D es DM1 que tiene la estructura:
**(Ver fórmula)**40. El método de la reivindicación 1, en el que D es una auristatina que es: (i) MMAE, que tiene la estructura:
**(Ver fórmula)**(¡i) MMAF, que tiene la estructura:
**(Ver fórmula)**
Patentes similares o relacionadas:
Métodos y composiciones para el diagnóstico y pronóstico de lesión renal e insuficiencia renal, del 29 de Julio de 2020, de Astute Medical, Inc: Un método para evaluar el estado renal en un sujeto, que comprende: realizar una pluralidad de ensayos configurados para detectar una […]
Neuregulina para tratar la insuficiencia cardíaca, del 29 de Julio de 2020, de Zensun (Shanghai) Science & Technology, Co., Ltd: Neuregulina para usar en un método para tratar la insuficiencia cardíaca crónica en un paciente, donde el paciente tiene un nivel plasmático de NT-proBNP […]
Inmunomoduladores, del 29 de Julio de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de la fórmula (I) **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: A se selecciona de **(Ver fórmula)** en donde: […]
Detección de interacciones proteína a proteína, del 15 de Julio de 2020, de THE GOVERNING COUNCIL OF THE UNIVERSITY OF TORONTO: Un método para medir cuantitativamente la fuerza y la afinidad de una interacción entre una primera proteína de membrana o parte de la misma y una […]
Método para llevar a cabo el seguimiento de la enfermedad de Gaucher, del 15 de Julio de 2020, de Centogene GmbH: Un método para determinar la evolución de la enfermedad de Gaucher en un sujeto, que comprende la etapa de determinar en varios puntos en el […]
Procedimiento para evaluación de la función hepática y el flujo sanguíneo portal, del 15 de Julio de 2020, de The Regents of the University of Colorado, a body corporate: Procedimiento in vitro para la estimación del flujo sanguíneo portal en un individuo a partir de una única muestra de sangre o suero, comprendiendo el procedimiento: […]
Biomarcadores de pronóstico y predictivos y aplicaciones biológicas de los mismos, del 1 de Julio de 2020, de INSTITUT GUSTAVE ROUSSY: Un método para evaluar la sensibilidad o la resistencia de un tumor frente a un agente antitumoral, que comprende evaluar la cantidad de complejo eiF4E-eiF4G (complejo Cap-ON) […]
Evaluación asistida del pronóstico en la enfermedad inflamatoria, del 24 de Junio de 2020, de KINGS COLLEGE LONDON: Un método in vitro de recopilación de información útil para predecir el resultado clínico en un sujeto, en donde el sujeto tiene o se sospecha que tiene una enfermedad […]