Determinación de un cambio en una población de células.
Un método para determinar un cambio en una población de células que comprende al menos una célula,
comprendiendo dicho método las etapas de
adquirir secuencialmente al menos dos imágenes de la población de células
comparar al menos una parte de las al menos dos imágenes para obtener al menos una imagen de diferencia calcular un parámetro de la al menos una imagen de diferencia, y
basándose en dicho parámetro calculado, determinar si se ha producido un cambio,
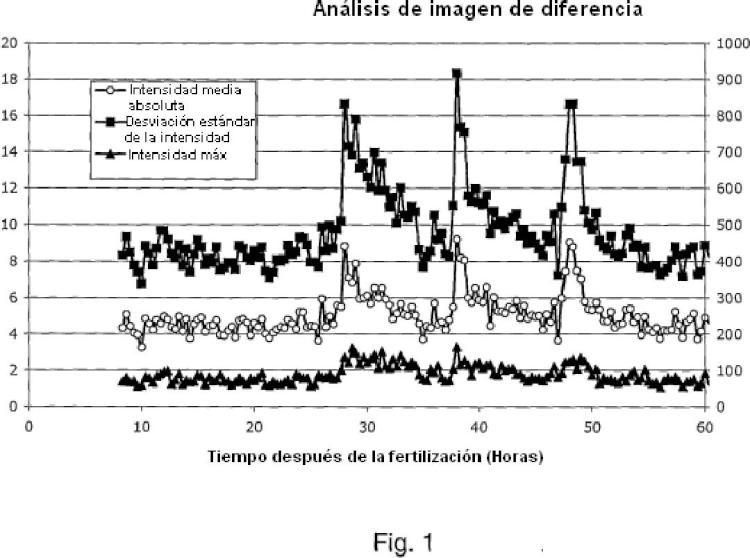
caracterizado por que el parámetro calculado es una desviación estándar o varianza de valores para los píxeles en la imagen de diferencia.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/DK2006/000581.
Solicitante: UNISENSE FERTILITECH A/S.
Nacionalidad solicitante: Dinamarca.
Dirección: Tueager 1 8200 Aarhus N DINAMARCA.
Inventor/es: RAMSING,NIELS B, BERNTSEN,Jørgen.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C12M1/34 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12M EQUIPOS PARA ENZIMOLOGIA O MICROBIOLOGIA (instalaciones para la fermentación de estiércoles A01C 3/02; conservación de partes vivas de cuerpos humanos o animales A01N 1/02; aparatos de cervecería C12C; equipos para la fermentación del vino C12G; aparatos para preparar el vinagre C12J 1/10). › C12M 1/00 Equipos para enzimología o microbiología. › Medida o ensayo de detección de las condiciones del medio, p. ej. por contadores de colonias.
- C12M1/36 C12M 1/00 […] › que incorporan un mecanismo de control en función del tiempo o de las condiciones del medio, p. ej. fermentadores controlados automáticamente.
- C12M3/00 C12M […] › Equipos para el cultivo de tejidos, de células humanas, animales o vegetales, o de virus.
- G06T7/00 FISICA. › G06 CALCULO; CONTEO. › G06T TRATAMIENTO O GENERACIÓN DE DATOS DE IMAGEN, EN GENERAL. › Análisis de imagen.
- G06T7/20 G06T […] › G06T 7/00 Análisis de imagen. › Análisis del movimiento (estimación del movimiento para codificación, decodificación, compresión o descompresión de señales de vídeo digitales H04N 19/43, H04N 19/51).
PDF original: ES-2549205_T3.pdf




Fragmento de la descripción:
Determinación de un cambio en una población de células La presente invención se refiere a un método y un sistema para la determinación de un cambio en una población de células, como un método para el uso de dicho método y sistema para la estimación de una medida de la calidad de los embriones y para seleccionar embriones para fertilización in vitro.
Antecedentes La infertilidad afecta a más de 80 millones de personas en todo el mundo. Se estima que un 10 % de todas las parejas experimentan infertilidad primaria o secundaria (Vayena et al. 2001) . La fertilización in vitro (FIV) es un tratamiento médico opcional que puede proporcionar a una pareja, que de otro modo ha sido incapaz de concebir, una posibilidad para conseguir un embarazo. Es un proceso en el que se toman óvulos (ovocitos) de los ovarios de una mujer y a continuación se fertilizan con esperma en el laboratorio. Los embriones creados en este proceso se colocan en el útero para la implantación potencial. Para evitar embarazos múltiples y partos múltiples solamente se transfieren unos pocos embriones (normalmente menos de cuatro y de forma ideal solamente uno (Bhattachar y a et al. 2004) ) . La selección de embriones adecuados para la transferencia es una etapa crítico en cualquier tratamiento de IVF. Los procedimientos de selección actuales, en su mayoría, se basan en la evaluación morfológica del embrión en diferentes puntos de tiempo durante el desarrollo y en particular en una evaluación en el momento de la transferencia usando un microscopio estereoscópico convencional. Sin embargo, está ampliamente reconocido que el procedimiento de evaluación necesita mejoras cualitativas así como cuantitativas.
División celular temprana. Un nuevo enfoque prometedor es el uso de la ’división temprana’ en la etapa de 2 células, (es decir, antes de 25-27 h después de la inseminación/inyección) , como un indicador de calidad. En este enfoque, los embriones se inspeccionan visualmente 25-27 horas después de la fertilización para determinar si se ha completado la primera división celular. Varios estudios han demostrado una fuerte correlación entre la escisión temprana y el potencial de desarrollo posterior de los embriones individuales. (Shoukir et al., 1997; Sakkas et al., 1998, 2001; Bos-Mikich et al., 2001; Lundin et al., 2001; Petersen et al., 2001; Fenwick et al., 2002; Neuber et al., 2003; Salumets et al., 2003; Windt et al., 2004) . Varios observadores han señalado la necesidad de una observación más frecuente, sin embargo, las observaciones visuales frecuentes con transferencias asociadas desde la incubadora a un microscopio invertido inducen un estrés físico que puede impedir o incluso detener el desarrollo del embrión. También es un proceso lento y difícil de incorporar en la rutina diaria de las clínicas de IVF.
Varios investigadores han realizado adquisición de imágenes de intervalos de tiempo durante el desarrollo del embrión. Esto se ha realizado principalmente mediante la colocación de un microscopio de investigación dentro de una incubadora o construyendo una "plataforma de incubadora" en una platina de un microscopio con la adquisición automatizada de imágenes. La "incubadora" mantiene una temperatura aceptable (37 ºC) , humedad (> 90 %) y composición del gas (CO2 al 5 % y en algunos casos concentración de oxígeno reducida) . La evaluación manual de imágenes con intervalos de tiempo ha proporciona una información importante sobre el calendario y la duración de las divisiones celulares (Grisart et al, . 1994, Holm et al, . 1998, Majerus et al, . 2000, Holm et al, . 2002, Holm et al, . 2003, Lequarre et al, . 2003, Motosugi et al, . 2005) .
Una configuración experimental alternativa implica la colocación de un sistema de adquisición de imágenes dentro de una incubadora para observar los embriones durante el desarrollo sin producirles estrés moviéndolos fuera de las condiciones optimizadas dentro de la incubadora. Un sistema comercial, el Embr y oGuard, está siendo fabricado y comercializado por IMT international (véase la lista de la bibliografía) . En esta configuración, es posible observar los embriones en línea dentro de la incubadora.
Análisis de imágenes convencional. La puntuación morfológica de imágenes de embriones y vídeos a intervalos de tiempo del desarrollo embrionario se ha basado en el análisis manual en el que el espectador proporciona calidades a la imagen y el ordenador solamente hace un seguimiento de esta clasificación, generando una línea de tiempo con anotaciones que muestran cuando se produjeron grandes cambios. Un ejemplo de este tipo de software es el software de anotación proporcionado con el sistema de adquisición de imágenes a intervalos de tiempo de Embr y oGuard. Algunos ejemplos de análisis manual de vídeos a intervalos de tiempo se pueden encontrar en Grisart et al. 1994, Holm et al. 1998, Majerus et al, . 2000, Holm et al, . 2002, Holm et al, . 2003, Lequarre et al, . 2003, Motosugi et al, . 2005.
El software actual para análisis cuantitativo de imágenes de fotografías de embriones usa un algoritmo semiautomático o asistido por ordenador. Se trata de una puntuación de imágenes asistida por ordenador en la que el usuario usa herramientas de dibujo para delinear estructuras embrionarias que posteriormente se cuantifican basándose en el esquema de las mismas generado por el usuario. En el mercado están disponibles varios programas para realizar análisis semiautomático de embriones (por ejemplo, FertiMorph de ImageHouse, Copenhague, Dinamarca) . Se han realizado varios intentos para fabricar un sistema de análisis totalmente automatizado (por ejemplo, tesis PhD de Christina Hnida) para fotografías de embriones. Sin embargo, el uso general de imágenes de contraste de modulación de Hoffmann (HMC) en embriología y laboratorios de IVF ha hecho que la detección celular automática sea difícil.
Se ha desarrollado análisis de imágenes automatizado para otras aplicaciones tales como detección de células mitóticas (Eccles et al., 1986, Klevecz et al., 1988 documento de patentes de Estados Unidos Nº US4724543, Belien et al., 1997, y Curl et al., . 2004) . Todos los algoritmos automáticos informados usan el esquema clásico para análisis cuantitativo de imágenes:
1. Adquirir imagen
2. Aumentar imagen
3. Segmentar imágenes en regiones de interés (de ROI) mediante formación de umbrales
4. Hacer recuento y caracterizar las ROI (tamaño, densidad, etc.)
Una descripción general de estas etapas y numerosas variantes de cada una se puede encontrar en artículos de revisión y libros de texto sobre análisis de imágenes (por ejemplo, la revisión del análisis de imágenes histológicas de Oberholzer et al., 1996 o The Image Processing Handbook, 4ª Ed. 2002 de John Russ) . Los mejores métodos para mejorar la presentación de estructuras de interés depende de la imagen a la mano (por ejemplo, fotografías en microscopio) y la representación de la estructura de interés (por ejemplo, núcleos) , y se han usado muchas variantes diferentes. Sin embargo, siempre se han usado procedimientos de aumento para facilitar la segmentación de la imagen con el fin de identificar y definir regiones de interés. Una vez que estas regiones se han encontrado el identificado, se pueden caracterizar adicionalmente con respecto al área, tamaño, intensidad, posición, etc.
La segmentación en sí misma se consigue mediante la comparación de la intensidad de los píxeles (o una función derivada de la intensidad de los píxeles) hasta un umbral dado. Las áreas por encima del umbral pertenecen a la región de interés (ROI) que normalmente ser objeto (por ejemplo, núcleos) que se debe medir. Se usa en numerosos algoritmos diferentes para esta segmentación, pero siempre sirven para la misma finalidad, es decir, 1 segmentación de la imagen.
El análisis automatizado de imágenes de microscopía en intervalos de tiempo para detectar la división celular se presenta en un artículo de Eccles et al., 1986. El artículo describe un método para la detección automatizada de la división celular en células de mamífero sincronizadas mediante análisis de imágenes en una serie de intervalos de tiempo. El algoritmo de análisis de imágenes que se describe y se usa en este artículo no usa diferencias de intensidad en fases consecutivas. En su lugar, analizar cada imagen mediante la extracción de componentes de la imagen de alta frecuencia, y a continuación formando umbrales y sondeando objetos anulares indicativos de supuestas células mitóticas. Esta operación constituye la segmentación de la imagen para detectar los contornos de la célula y su posición relativa. Las relaciones espaciales y temporales entre... [Seguir leyendo]
Reivindicaciones:
1. Un método para determinar un cambio en una población de células que comprende al menos una célula, comprendiendo dicho método las etapas de adquirir secuencialmente al menos dos imágenes de la población de células comparar al menos una parte de las al menos dos imágenes para obtener al menos una imagen de diferencia calcular un parámetro de la al menos una imagen de diferencia, y basándose en dicho parámetro calculado, determinar si se ha producido un cambio, caracterizado por que el parámetro calculado es una desviación estándar o varianza de valores para los píxeles en la imagen de diferencia.
2. El método de la reivindicación 1, en el que el parámetro mencionado se calcula a partir la al menos una imagen de diferencia basándose en la imagen de diferencia completa.
3. El método de acuerdo con cualquiera de las reivindicaciones anteriores, en el que el parámetro mencionado se calcula sin segmentación adaptativa de la imagen en regiones de interés, y regiones que no tienen interés.
4. El método de acuerdo con cualquiera de las reivindicaciones precedentes, en el que la población de células es un embrión.
5. El método de acuerdo con cualquiera de las reivindicaciones precedentes, en el que el cambio en la población de células es reorganización celular, tal como movimiento celular.
6. El método de acuerdo con cualquiera de las reivindicaciones precedentes, en el que el cambio en la población de células es división celular.
7. El método de acuerdo con cualquiera de las reivindicaciones precedentes, en el que el cambio en la población de células es muerte de al menos una célula.
8. El método de acuerdo con cualquiera de las reivindicaciones precedentes, en el que la imagen de diferencia se obtiene restando valores para los píxeles correspondientes en las al menos dos imágenes.
9. El método de acuerdo con cualquiera de las reivindicaciones precedentes, en el que la imagen de diferencia se obtiene calculando la proporción de valores para los píxeles correspondientes en las al menos dos imágenes.
10. El método de acuerdo con cualquiera de las reivindicaciones precedentes, en el que la imagen de diferencia es una imagen de diferencia de intensidad.
11. El método de acuerdo con cualquiera de las reivindicaciones precedentes, en el que los valores de los píxeles en la imagen de diferencia corresponden a diferencia de intensidad.
12. El método de acuerdo con cualquiera de las reivindicaciones 1 a 9, en el que los valores de los píxeles en la imagen de diferencia corresponden a diferencia en característica espectral.
13. El método de acuerdo con cualquiera de las reivindicaciones precedentes, en el que las al menos dos imágenes se someten a escala idéntica antes de dicha comparación para obtener al menos una imagen de diferencia.
14. El método de acuerdo con cualquiera de las reivindicaciones precedentes, en el que se obtiene una pluralidad de imágenes de diferencia a partir de una secuencia de imágenes consecutivas y un cambio en dicho parámetro calculado es indicativo de un cambio en la población de células.
15. El método de acuerdo con la reivindicación 14, en el que cada una de dichas imágenes de diferencia se obtienen a partir de dos imágenes consecutivas y la recogida de los parámetros calculados de dichas imágenes de diferencia forman una serie temporal.
16. El método de acuerdo con las reivindicaciones 14 o 15 en el que un extremo en dicho parámetro calculado es indicativo de reorganización celular tal como motilidad celular.
17. El método de acuerdo con cualquiera de las reivindicaciones 16, en el que un extremo en dicho parámetro calculado es indicativo de división celular.
18. El método de acuerdo con la reivindicación 17, en el que la forma de dicho extremo indica la naturaleza del cambio que se produce en la población de células.
19. El método de acuerdo con la reivindicación 15 a 18, en el que un pico estrecho intenso indica una división celular rápida con fragmentación mínima.
20. El método de acuerdo con las reivindicaciones 18 o 19, en el que un pico ancho y/o bimodal indica divisiones
celulares más lentas posiblemente división celular asincrónica y/o más fragmentación.
21. El método de acuerdo con la reivindicación 20, en el que dicho pico ancho y/o bimodal indica división celular asincrónica.
22. El método de acuerdo con cualquiera de las reivindicaciones precedentes, en el que la determinación de un cambio en la población de células agrupadas se compara con otras medidas de la población de células agrupadas.
23. Un método para determinar la calidad de una población de células que comprende al menos una célula, comprendiendo dicho método las etapas de adquirir secuencialmente al menos dos imágenes de la población de células comparar al menos una parte de las al menos dos imágenes para obtener al menos una imagen de diferencia calcular un parámetro de la al menos una imagen de diferencia, y basándose en dicho parámetro calculado que determina la calidad de la población de células, caracterizado por que el parámetro calculado es una desviación estándar o varianza de valores para los píxeles en la imagen de diferencia.
24. El método de cualquier reivindicación 23 para determinar la calidad del embrión que comprende controlar el embrión durante un periodo de tiempo, teniendo dicho periodo de tiempo una duración suficiente para comprender al menos un periodo de división celular y al menos una parte de un periodo entre divisiones, y determinar la duración del al menos un periodo de división celular y/o determinar el movimiento celular durante el periodo entre divisiones y/o determinar la duración del periodo de de tiempo del movimiento celular durante un periodo entre divisiones obteniendo de este modo una medida de la calidad del embrión.
25. El método de acuerdo con la reivindicación 24, en el que el embrión se controla durante un periodo de tiempo que comprende al menos dos al menos dos periodos de división celular.
26. El método de acuerdo con la reivindicación 23 para determinar la calidad del embrión que comprende controlar el embrión durante un periodo de tiempo, teniendo dicho periodo de tiempo una duración suficiente para comprender al menos un periodo de reorganización celular y un periodo sin reorganización celular sustancial uso del método que se describe en cualquiera de las reivindicaciones 1 -22 para determinar la distribución temporal de la reorganización celular obteniendo de este modo una medida de la calidad del embrión.
27. El método de acuerdo con la reivindicación 26, en el que el embrión se controla durante un periodo de tiempo que comprende al menos dos periodos de división celular.
28. El método de acuerdo con cualquiera de las reivindicaciones 23 a 27, en el que se determina la duración del tiempo para cada periodo de reorganización y/o periodo de división celular.
29. El método de acuerdo con cualquiera de las reivindicaciones 23 a 28, en el que se determina la duración del tiempo entre cada periodo de reorganización y/o periodo de división celular.
30. El método de acuerdo con cualquiera de las reivindicaciones 2234 a 29, en el que se determina el periodo de movimiento celular en al menos dos periodos entre divisiones.
31. El método de acuerdo con cualquiera de las reivindicaciones 23 a 30, en el que se determina al alcance del movimiento celular en al menos dos periodos entre divisiones.
32. El método de acuerdo con cualquiera de las reivindicaciones 23 a 31, en el que se realiza la determinación de la duración del al menos un periodo de división celular y la determinación del movimiento celular durante el periodo entre divisiones.
33. El método de acuerdo con cualquiera de las reivindicaciones 23 a 32, en el que una duración breve de reordenaciones celulares después de la división celular es indicativo de un embrión de alta calidad.
34. El método de acuerdo con la reivindicación 33, en el que la duración de la reorganización celular se determina mediante cualquiera de los métodos descritos en la reivindicación 1 a 22.
35. El método de acuerdo con cualquiera de las reivindicaciones 23 a 34, en el que un pico del parámetro estrecho intenso determinado mediante cualquiera de los métodos descritos en la reivindicación 1 a 22 es indicativo de un embrión de alta calidad.
36. El método de acuerdo con cualquiera de las reivindicacione.
23. 35, en el que la división citoplasmática prolongada y la reorganización extensa y/o prolongada de los otros blastómeros a continuación indica un embrión de mala calidad.
37. El método de acuerdo con la reivindicación 36, en el que la reorganización extensa y/o prolongada mencionada de los otros blastómeros se indica mediante un pico ancho en la actividad de blastómeros.
38. El método de acuerdo con cualquiera de las reivindicacione.
23. 37, en el que regiones persistentemente inmóviles en un embrión indican un embrión de mala calidad.
39. El método de acuerdo con cualquiera de las reivindicaciones 23 a 38, en el que la ausencia de regiones inmóviles sin movimiento antes de la compactación en la fase de mórula indica un embrión de alta calidad.
40. El método de acuerdo con cualquiera de las reivindicaciones 23 a 39, en el que la proporción de movimiento medio en segmentos temporales adecuados y/o una proporción de desviaciones estándar para la imagen de diferencia en segmentos temporales diferentes es un parámetro de calidad.
41. El método de acuerdo con la reivindicación 40, en el que los segmentos temporales mencionados para un embrión bovino son básicamente d.
3. 60 horas después de la fertilización y/.
6. 75 horas después de la fertilización y/.
7. 90 horas después de la fertilización.
42. El método de acuerdo con cualquiera de las reivindicaciones 23 a 41, en el que los periodos de división celular inferiores a básicamente 1 hora aumentan la medida de la calidad del embrión.
43. El método de acuerdo con cualquiera de las reivindicaciones 23 a 42, en el que un movimiento celular escaso en los periodos entre divisiones aumenta la medida de la calidad del embrión.
44. El método de acuerdo con cualquiera de las reivindicaciones 23 a 43, en el que el comienzo temprano del primer periodo de división celular, es decir, antes de 25 horas después de la fertilización para embriones humanos aumenta la medida de la calidad del embrión.
45. El método de acuerdo con cualquiera de las reivindicaciones 23 a 44, en el que la distribución uniforme de la reorganización celular tal como movimiento celular dentro del embrión en el tiempo aumenta la medida de la calidad del embrión.
46. Un método para seleccionar un ovocito o embrión fertilizado adecuado para trasplante, conservación congelado
o eliminación comprendiendo dicho método determinar los cambios en el ovocito o embrión mediante un método tal como se define en cualquiera de las reivindicaciones 1 -45, y seleccionar el ovocito o embrión adecuado para trasplante, conservación congelado o eliminación.
47. El método de la reivindicación 46, en el que el ovocito o embrión seleccionado mencionado es el ovocito o embrión que tiene la medida de la calidad del embrión más alta.
48. El método de la reivindicación 46, en el que el ovocito o embrión seleccionado mencionado es el ovocito o embrión que tiene la medida de la calidad del embrión más baja.
49. El método de la reivindicación 46, en el que el ovocito o embrión seleccionado mencionado es el ovocito o embrión que tiene atributos en particular tales como un patrón temporal en particular en uno de los parámetros determinados con los métodos de la reivindicación 1-22.
50. Un sistema para determinar un cambio en una población de células que comprende al menos una célula, comprendiendo dicho sistema medios para adquirir secuencialmente al menos dos imágenes de la población de células medios para comparar al menos una parte de las al menos dos imágenes para obtener al menos una imagen de diferencia un ordenador para calcular un parámetro de la al menos una imagen de diferencia, y medios para determinar si se ha producido un cambio basándose en dicho parámetro calculado, caracterizado por que el parámetro calculado es una desviación estándar o varianza de valores para los píxeles en la imagen de diferencia.
51. Un sistema para determinar la calidad de una población de células que comprende al menos una célula, comprendiendo dicho sistema medios para adquirir secuencialmente al menos dos imágenes de la población de células medios para comparar al menos una parte de las al menos dos imágenes para obtener al menos una imagen de diferencia un ordenador para calcular un parámetro de la al menos una imagen de diferencia, y medios para determinar la calidad de la población de células basándose en dicho parámetro calculado, caracterizado por que el parámetro calculado es una desviación estándar o varianza de valores para los píxeles en la imagen de diferencia.
Patentes similares o relacionadas:
BIORREACTOR Y PROCEDIMIENTO DE PRODUCCIÓN DE CULTIVOS CELULARES ADHERENTES QUE EMPLEA EL BIORREACTOR, del 9 de Julio de 2020, de BIOTECH FOODS S.L: Biorreactor y procedimiento de producción de cultivos celulares adherentes que emplea el biorreactor. El biorreactor comprende un recipiente […]
Métodos para la recopilación, estabilización y conservación de muestras, del 8 de Julio de 2020, de Drawbridge Health, Inc: Un método para estabilizar uno o más componentes biológicos de una muestra biológica de un sujeto, comprendiendo el método obtener un […]
Dispositivo para la detección de analitos, del 1 de Julio de 2020, de TECHLAB, INC.: Un dispositivo para detectar por lo menos una sustancia de interés en una muestra líquida, comprendiendo el dispositivo: (a) una unidad que […]
Evaluación de embriones, del 27 de Mayo de 2020, de UNISENSE FERTILITECH A/S: Un método implementado por ordenador para clasificar embriones de FIV para predecir su potencial de desarrollo después de la transferencia; […]
Métodos para la transducción y el procesamiento de células, del 27 de Mayo de 2020, de Juno Therapeutics, Inc: Un método de transducción, que comprende incubar, en una cavidad interna de una cámara de centrífuga, una composición de entrada que comprende células y partículas […]
Un aparato para la incubación y vitrificación combinadas de un material biológico, del 6 de Mayo de 2020, de Esco Medical UAB: Un aparato para la incubación y vitrificación combinadas de un material biológico viable; dicho aparato comprende: una carcasa que tiene una extensión […]
Método y conjunto de electrodo para tratar células adherentes, del 29 de Abril de 2020, de Lonza Cologne GmbH: Procedimiento para someter células adherentes que se adhieren al fondo de un espacio de reacción, a por lo menos un campo eléctrico, en […]
 Biorreactor compuesto por cámara hermética al agua y matriz interna para la generación de implantes médicos con células, del 25 de Marzo de 2020, de Association for the Advancement of Tissue Engineering and Cell Based Technologies & Therapies (A4TEC) - Associação: Biorreactor para la generación de implantes médicos con células caracterizado porque comprende una cámara externa hermética al agua unicompartimentada […]
Biorreactor compuesto por cámara hermética al agua y matriz interna para la generación de implantes médicos con células, del 25 de Marzo de 2020, de Association for the Advancement of Tissue Engineering and Cell Based Technologies & Therapies (A4TEC) - Associação: Biorreactor para la generación de implantes médicos con células caracterizado porque comprende una cámara externa hermética al agua unicompartimentada […]