Células madre mesenquimales y usos de las mismas.
Células madre mesenquimales para uso en el tratamiento o prevención de fibrosis en un humano,
en donde la fibrosis es fibrosis de los riñones asociada con enfermedad renal en etapa terminal o fibrosis de los pulmones.
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E10011225.
Solicitante: Mesoblast International Sàrl.
Nacionalidad solicitante: Suiza.
Dirección: Route de Pre-Bois 20 1217 Meyrin SUIZA.
Inventor/es: PITTENGER, MARK, F., AGGARWAL,SUDEEPTA.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61P7/04 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 7/00 Medicamentos para el tratamiento de trastornos de la sangre o del fluido extracelular. › Antihemorrágicos; Procoagulantes; Hemostáticos; Antifibrinolíticos.
- C12N5/00 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00).
PDF original: ES-2544689_T3.pdf



Fragmento de la descripción:
Células madre mesenquimales y usos de las mismas.
La invención se relaciona con células madre mesenquimales para uso en el tratamiento o prevención de fibrosis en un humano, en donde la fibrosis es fibrosis de los riñones asociada con enfermedad renal de etapa terminal de la fibrosis de los pulmones. 5
La células madre mesenquimales (MSCs) son células madre potentes que pueden diferenciarse rápidamente en líneas que incluyen osteoblastos, miocitos, condrocitos y adipocitos (Pittenger, et al., Science, Vol. 284, pg. 143 (1999) ; Haynesworth, et al., Bone, Vol. 13, pg. 69 (1992) ; Prockop, Science, Vol. 276, pg. 71 (1997) ) . Estudios in vitro han demostrado la capacidad de las MSCs para diferenciarse en músculos (Wakitani, et al., Muscle Nerve, Vol. 18" pg. 1417 (1995) ) , precursores tipo neuronal (Woodbur y , et al., J. Neurosci. Res., Vol. 69, pg. 908 (2002) ; 10 Sánchez-Ramos, et al., Exp. Neurol., Vol. 171, pg. 109 (2001) ) , cardiomiocitos (Toma, et al., Circulation, Vol. 105, pg. 93 (2002) ; Fakuda, Artif. Organs, Vol. 25, pg. 187 (2001) ) y posiblemente otros tipos de células. Además, las MSCs han demostrado proveer capas de alimentación efectivas para la expansión de células madre hematopoyéticas y embrionales (Eaves, et al., Ann. N.Y. Acad. Sei., Vol. 938. pg. 63 (2001) ; Wagers, et al., Gene Therapy, Vol. 9, pg. 606 (2002) ) . Estudios recientes con una variedad de modelos animales han demostrado que las 15 MSCs pueden ser útiles en la reparación o regeneración de tejidos óseos, de cartílagos, meniscos o del miocardio deteriorados (DeKok, et al., Clin. Oral Implants Res., Vol. 14, pg. 481 (2003) ) ; Wu, et al., Transplantation, Vol. 75, pg. 679 (2003) ; Noel, et al., Curr. Oin. Investig. Drugs. Vol. 3, pg. 1000 (2002) ; Ballas, et al., J. Cell. Biochem. Suppl., Vol. 38, pg. 20 (2002) ; Mackenzie, et al., Blood Cells Mol. Dis., Vol. 27 (2002) ) . Varios investigadores han utilizado las MSCs con resultados alentadores para el trasplante en modelos de enfermedad en animales incluyendo 20 osteogénesis imperfecta (Pereira, et al., Proc. Nat. Acad. Sci., Vol. 95, pg. 1142 (1998) ) , parkinsonismo (Schwartz, et al., Hum. Gene Ther., Vol. 10, pg. 2539 (1999) ) , lesiones de la médula espinal (Chopp, et al., Neuroreport, Vol. 11, pg. 3001 (2000) ; Wu, et al., J. Neurosci. Res., Vol. 72, pg. 393 (2003) ) y trastornos cardíacos (Tomita, et al., Circulation, Vol. 100, pg. 247 (1999) . Shake, et al., Ann. Thorac. Surg., Vol. 73, pg. 1919 (2002) ) . De manera importante, se han reportado también resultados prometedores en ensayos clínicos para osteogénesis imperfecta 25 (Horwitz, et al., Blood, Vol. 97, pg. 1227 (2001) ; Horowitz, et al. Proc. Nat. Acad. Sci., Vol. 99, pg. 8932 (2002) ) e injerto potenciado de trasplante de médula ósea heterólogos (Frassoni, et al., Int. Society for Cell Therapy, SA006 (resumen) (2002) ; Koc, et al., J. Clin. Oncol., Vol. 18, pg. 307 (2000) ) .
Las MSCs expresan un antígeno clase I de complejo de histocompatibilidad mayor (MHC) sobre su superficie MHC clase II limitada (Le Blanc, et al., Exp. Hematol., Vol. 31, pg. 890 (2003) ; Potian, et al., J. Immunol., Vol. 171, pg. 30 3426 (2003) ) y no B7 o moléculas coestimuladoras de CD40 (Majumdar, et al., J. Biomed. Sci., Vol. 10, pg. 228 (2003) ) , sugiriendo que estas células tienen un fenotipo inmunogénico bajo (Tse, et al., Transplantation, Vol. 75, pg. 389 (2003) ) . Las MSCs también inhiben respuestas proliferativas de células T en una forma independiente de MHC (Bartholomew, et al., Exp. Hematol., Vol. 30, pg. 42 (2002) ; Devine, et al., Cancer J., Vol. 7, pg. 576 (2001) ; DiNicola, et al., Blood, Vol. 99, pg. 3838 (2002) ) . Estas propiedades inmunológicas de MSCs pueden potenciar su injerto en 35 trasplantes sin limitar la capacidad del sistema inmune receptor para reconocer y rechazar células alogeneicas después del trasplante. La producción de factores por MSCs, que modulan la respuesta inmune y soportan la hematopoyesis junto con su capacidad para diferenciarse en tipos celulares apropiados bajo estímulos locales las convierten en células madre deseables para estudios de trasplante celular (Majumdar, et al., Hematother. Stem Cell Res., Vol. 9, pg. 841 (2000) ; Haynesworth, et al., J. Cell. Physiol., Vol. 166, pg. 585 (1996) . 40
La WO 03/105908 A2 divulga terapias con células madre regenerativas que incluyen el uso de MSCs.
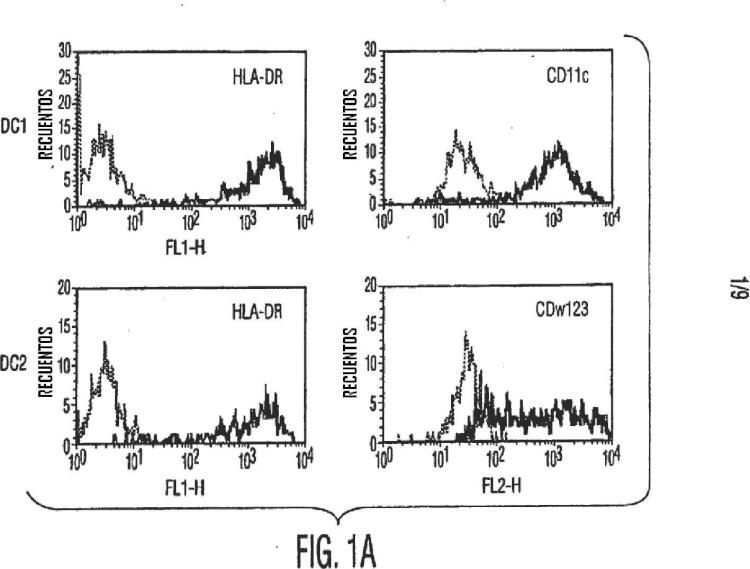
Los solicitantes presentes han examinado las interacciones de células madre mesenquimales con poblaciones celulares inmunes, incluyendo células dendríticas (DC1 y DC2) , células T efectoras (Th1 y Th2) y células NK. Con base en tales interacciones, los solicitantes descubrieron que las células madre mesenquimales pueden regular la producción de diversos factores que pueden regular varias etapas en el proceso de respuesta inmune. Así, las 45 células madre mesenquimales pueden ser empleadas en el tratamiento de condiciones de enfermedad y trastornos que involucran el sistema inmune, o enfermedades, condiciones, o trastornos que involucran la inflamación o respuestas alérgicas. Tales enfermedades, condiciones y trastornos incluyen, pero no se limitan a, enfermedades autoinmunes, alergias, artritis, heridas inflamadas, alopecia araeta (calvicie) , enfermedades periodontales incluyendo gingivitis y periodontitis, y otras enfermedades, condiciones o trastornos que involucran una respuesta inmune. 50
Además, se cree que las células madre mesenquimales estimulan las células mononucleares sanguíneas periféricas (PBMCs) para producir el factor de crecimiento endotelial vascular o VEGF, el cual promueve la angiogénesis estimulando la formación de nuevos vasos sanguíneos.
Adicionalmente, se cree que las células madre mesenquimales estimulan las células dendríticas (DCs) para producir interferón beta (IFN-ß) , el cual promueve la supresión tumoral y la inmunidad contra infecciones virales. 55
El alcance de la presente invención está definido en las reivindicaciones anexas.
También se divulga un método para tratar una enfermedad autoinmune en un animal. El método comprende la administración al animal de células madre mesenquimales en una cantidad efectiva para tratar la enfermedad autoinmune en el animal.
Aunque el alcance de este aspecto de la presente divulgación no debe ser limitado por ningún razonamiento teórico, 5 se cree que al menos un mecanismo mediante el cual las células madre mesenquimales suprimen la enfermedad autoinmune es causando la liberación de interleucina-10 (IL-10) de células T reguladoras (células en cesta) y/o células dendríticas (DC) .
Las enfermedades autoinmunes que pueden ser tratadas de acuerdo con la presente divulgación incluyen, pero no están limitadas a, esclerosis múltiple, diabetes tipo 1, artritis reumatoide, uveítis, enfermedad autoinmune de la 10 tiroides, enfermedad de intestino inflamatorio, enfermedad autoinmune linfoproliferativa (ALPS) , enfermedad desmielinizante, encefalomielitis autoinmune, gastritis autoinmune (AIG) , y enfermedades glomerulares autoinmunes. Debe entenderse, sin embargo, que el alcance de la presente divulgación no debe limitarse al tratamiento de las enfermedades autoinmunes específicas mencionadas aquí.
En una realización, el animal al cual las células madre mesenquimales son administradas, es un mamífero. El 15 mamífero puede ser un primate, incluyendo primates humanos y no humanos.
En general, la terapia con células madre mesenquimales (MSC) se basa, por ejemplo, en la siguiente secuencia: recolección del tejido que contiene MSC, aislamiento y expansión de las MSCs, y administración de las MSCs al animal, con o sin manipulación bioquímica o genética.
Las células madre mesenquimales que son administradas pueden ser una composición homogénea o pueden ser 20 una población celular mixta enriquecida en MSC. Las composiciones de células madre mesenquimales homogéneas pueden ser obtenidas cultivando médula adherente o células perlosteales, y las composiciones con células madre mesenquimales pueden ser obtenidas cultivando células de médula adherentes o periosteales, y las células madre mesenquimales pueden ser identificadas por marcadores de superficie celular específicos que son identificados con anticuerpos monoclonales exclusivos. Un método para obtener una población celular enriquecida en células madre 25 mesenquimales está descrito, por ejemplo, en la Patente de los Estados Unidos No. 5, 486, 359. Fuentes alternativas para células madre mesenquimales incluyen, pero no se limitan a, sangre, piel, cordón umbilical, músculo, grasa, hueso y pericondrio.
Las células madre mesenquimales pueden ser administradas mediante una variedad de procedimientos. Las células madre mesenquimales pueden ser administradas por vía... [Seguir leyendo]
Reivindicaciones:
1. Células madre mesenquimales para uso en el tratamiento o prevención de fibrosis en un humano, en donde la fibrosis es fibrosis de los riñones asociada con enfermedad renal en etapa terminal o fibrosis de los pulmones.
2. Las células madre mesenquimales de la reivindicación 1, para uso de acuerdo con la reivindicación 1 en donde las MSC van a ser administradas en una cantidad que va desde aproximadamente 1 x 105 células por kilogramo de 5 peso corporal hasta aproximadamente 1 x 107 células por kilogramo de peso corporal.
3. Las células madre mesenquimales de la reivindicación 1, para uso de acuerdo con la reivindicación 1 en donde las MSC van a ser administradas en una cantidad que va desde aproximadamente 1 x 106 células por kilogramo de peso corporal hasta aproximadamente 5.0 x 106 células por kilogramo de peso corporal.
4. Las células madre mesenquimales de cualquiera de las reivindicaciones precedentes, para uso de acuerdo con la 10 reivindicación 1 en donde las células madre mesenquimales son alogeneicas.
5. Las células madre mesenquimales de cualquiera de las reivindicaciones precedentes, para uso de acuerdo con la reivindicación 1 en donde las células madre mesenquimales son autólogas.
6. Las células madre mesenquimales de cualquiera de las reivindicaciones precedentes, para uso de acuerdo con la reivindicación 1 en donde las MSC van a ser administradas por administración intravenosa, intraarterial o 15 intraperitoneal.
7. Las células madre mesenquimales de cualquiera de las reivindicaciones precedentes, para uso de acuerdo con la reivindicación 1 en donde las MSC van a ser administradas como una suspensión celular en un medio líquido farmacéuticamente aceptable.
8. Las células madre mesenquimales de cualquiera de las reivindicaciones precedentes, para uso de acuerdo con la 20 reivindicación 1 en donde las células madre mesenquimales son recolectadas a partir de un tejido que contiene células madre mesenquimales, aisladas y expandidas en cultivo.
9. Las células madre mesenquimales de la reivindicación 8, para uso de acuerdo con la reivindicación 1 en donde el tejido que contiene las células madre mesenquimales es sangre, piel, cordón umbilical, músculo, grasa, pericondrio, médula ósea o periostio. 25
10. Las células madre mesenquimales de cualquiera de las reivindicaciones precedentes, para uso de acuerdo con la reivindicación 1 en donde las células madre mesenquimales no son manipuladas genéticamente.
11. Las células madre mesenquimales de cualquiera de las reivindicaciones precedentes, para uso de acuerdo con la reivindicación 1 en donde las MSC van a ser administradas en combinación con un agente terapéutico.
12. Las células madre mesenquimales de la reivindicación 11, para uso de acuerdo con la reivindicación 1 en donde 30 el agente terapéutico es un fármaco antiinflamatorio.
Patentes similares o relacionadas:
Composiciones para la supresión de la formación de inhibidores contra el factor VIII en pacientes con hemofilia A., del 22 de Julio de 2020, de THE TRUSTEES OF THE UNIVERSITY OF PENNSYLVANIA: Una composición que comprende material vegetal liofilizado que comprende al menos un fragmento de FVIII conjugado con la subunidad B de la toxina […]
Antídotos para inhibidores del factor Xa y procedimientos de uso de los mismos, del 24 de Junio de 2020, de PORTOLA PHARMACEUTICALS, INC.: Una composición farmacéutica que comprende un transportador y un polipéptido para uso en terapia donde el polipéptido comprende una secuencia de aminoácidos que tiene […]
Ciclodextrinas como procoagulantes, del 22 de Abril de 2020, de Alveron Pharma B.V: Una ciclodextrina sustituida de la fórmula (I): **(Ver fórmula)** en donde n es un número entero de 3 a 7 y R se selecciona del grupo […]
Anticuerpos que son capaces de unirse específicamente al inhibidor de la vía del factor tisular, del 8 de Abril de 2020, de NOVO NORDISK A/S: Un anticuerpo que se une específicamente dentro de los aminoácidos 186-276 del TFPI (SEQ ID NO: 1), en donde la cadena pesada comprende: • una secuencia […]
Cristales del compuesto 2-acilaminotiazol, del 25 de Marzo de 2020, de ASTELLAS PHARMA INC.: 1. Un cristal de la sal de ácido maleico del ácido 1-(3-cloro-5-{[4-(4-clorotiofen-2-il)-5-(4-ciclohexil piperazin-1-il)tiazol- 2-il]carbamoil} […]
Uso terapéutico sinérgico de concentrados de complejo de protrombina con concentrados de FVIII, del 18 de Marzo de 2020, de CSL BEHRING GMBH: Composición que comprende factores de coagulación FII, FIX, FX y FVII aislados y una composición que comprende FVIII aislado y, opcionalmente, VWF aislado para […]
Preparación líquida anhidra de melatonina, del 26 de Febrero de 2020, de Worphmed Srl: Una solución parenteral a granel sustancialmente libre de agua que consiste en una preparación líquida anhidra de melatonina que contiene al menos: a) […]
Métodos para aumentar la producción de células madre hematopoyéticas y plaquetas, del 22 de Enero de 2020, de Janssen Pharmaceuticals, Inc: Una composición farmacéutica para su uso en un método de (i) proporcionar células madre hematopoyéticas a un sujeto; (ii) reducir el tiempo de injerto […]